小剂量二乙基亚硝胺诱导大鼠肝纤维化模型的建立
2019-01-23玉苏甫吐尔逊赵燕霞
玉苏甫·吐尔逊,赵燕霞
在人体研究肝纤维化过程往往受到多种限制,所以实验性动物模型的应用成了研究者的必然选择[1~5]。本研究采用二乙基亚硝胺(diethylnitrosamine,DEN)诱发大鼠肝纤维化模型,以期为预防和防治肝纤维化的发生和发展提供一种理想的动物模型。
1 材料与方法
1.1 动物、仪器与试剂 SPF级雄性Wistar大鼠30只,体质量(160±20)g,由新疆医科大学实验动物中心提供[许可证号:SCXK(新)2003-001]。S22PS分光光度计(上海棱光技术有限公司),TGL-16G高速常压离心机、TDL-5A低速离心机(上海安亭科学仪器厂),K-S2.4型电热恒温水浴锅(金坛市医疗仪器厂),RM-2135型石蜡切片机(德国 Leica公司),EG-1150C型组织包埋机(德国 Leica公司),CH型OLYMPUS光学显微镜(Olympus公司),Image Pro Plus 5.1图像分析系统(Olympus公司)。检测SOD、GSH-PX、MDA 试剂盒(南京建成生物工程研究所),戊巴比妥钠和DEN(Sigma公司)。
1.2 血清ALT和AST含量测定 使用全自动生化分析仪测定。
1.3 血清SOD、GSH和MDA测定 按南京建成生物工程研究所提供的试剂盒说明由专人检测。
1.4 肝纤维化模型的建立 将30只动物随机分为正常组和模型组,每组15只。给予模型组动物0.1 mg/mL低浓度DEN溶液(用灭菌蒸馏水配制)腹腔注射,1次/d,连续11 w;给予正常组大鼠灭菌生理盐水注射,连续11 w。在11 w末实验结束时,给予大鼠1%戊巴比妥钠0.3ml/100 mg腹腔注射麻醉,剖开腹部,分离腹主动脉取血,-80℃保存待检。处死大鼠后,从肝左叶切取一块大小 1.0 cm×0.8 cm×0.3 cm组织块,迅速置于10%甲醛溶液中固定,5 d后取材、石蜡包埋、切片、HE染色,光学显微镜下观察。取体积小于1 mm3的肝组织块,用4%戊二醛和1%锇酸双固定,丙酮梯度脱水,Epon812环氧树脂包埋,在电镜下观察。
1.5 统计学分析 应用 Excel整理数据,应用SPSS 17.0 软件进行数据分析,计量资料以(±s)表示,行方差齐性检验和单因素方差分析,采用LSD法进行组间两两比较,检验水准为α=0.05,即P<0.05为有统计学意义。
2 结果
2.1 两组血清指标变化的比较 在实验结束时,模型组动物血清ALT和AST水平明显高于对照组(P<0.001),血清SOD和GSH水平较对照组减低,而MDA水平显著升高,均有显著性差异(P<0.01,表1)。
2.2 肝组织病理学变化 模型组动物肝组织出现肝细胞变性、细胞增生、坏死和假小叶形成(图1和图2),正常组肝脏细胞正常,未见水肿、肿胀、坏死(图3和图4)。
2.3 肝组织超微结构的变化 模型组主要以肝细胞核内异染色质增加、细胞器数量减少、基质密度降低和肝糖元减少表现为主(图5和图6);正常组肝细胞内线粒体、内质网结构正常,细胞器分布均匀,肝糖原数量基本正常(图7和图8)。
表1 两组血清指标(±s)比较

表1 两组血清指标(±s)比较
与正常组比,①P<0.001;②P<0.01
只 ALT(U/L) AST(U/L) SOD(U/mg Prot) GSH(U/mg Prot) MDA(nmol/mg prot)正常组 15 56.51±11.2 63.26±10.0 178.57±22.8 45.16±2.9 3.76±0.7模型组 15 410.08±93.6① 399.7±90.9① 83.08±22.0② 24.65±2.0② 9.78±2.0②

图1 模型大鼠肝组织学表现(HE,100×) 肝细胞坏死明显,假小叶形成且界限清晰,见明显的纤维组织增生
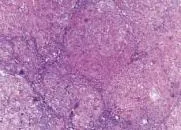
图2 模型大鼠肝组织学表现(HE,100×) 正常肝小叶结构消失,可见大小不一的肝细胞团和假小叶结构形成,有不同程度的纤维组织增生,细胞间隙增宽,还可见到炎细胞浸润,部分肝细胞进一步水肿、变性、坏死,部分小胆管内见胆汁淤积

图3 正常大鼠肝组织学表现(HE,100×) 肝小叶结构完整清晰,肝细胞索排列整齐,围绕小叶中央静脉呈放射状排列,细胞大小一致,肝血窦无狭窄,肝小叶及汇管区无炎性细胞浸润,未见水肿或肿胀的肝细胞,未见坏死的肝细胞,无明显纤维组织增生或纤维化
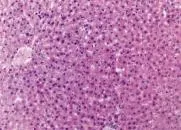
图4 正常大鼠肝组织学表现(HE,100×)

图5 肝组织超微结构变化(9400×)模型组胆管上皮轻微水肿,肝细胞中度水肿,基质密度降低,肝糖元减少,异染色质轻微边集,细胞内可见线粒体和内质网结构基本完整,肝血窦内壁水肿,肝血窦面微绒毛减少,肝细胞间隙增宽

图6 肝组织超微结构变化(9400×)模型组肝细胞内可见线粒体增多,内质网结构基本完整,异染色质边集。肝血窦面微绒毛明显减少,肝细胞水肿明显,基质密度明显降低。肝糖元明显减少,毛细胆管明显扩张,肝血窦内壁水肿,胆管上皮水肿。肝细胞内可见密度较深的颗粒
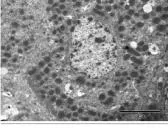
图7 肝组织超微结构变化(9400×) 正常肝细胞线粒体和内质网结构正常,细胞器分布均匀,毛细血管轻微扩张,肝血窦内皮细胞未见肿胀,肝细胞矢状面微绒毛未见异常

图8 肝组织超微结构变化(9400×)
3 讨论
肝纤维化是各种慢性肝病发展为肝硬化的中间环节。肝纤维化的发病机制尚未完全清楚,但肝星状细胞激活并转化为肌成纤维细胞和成纤维细胞,是肝纤维化发生发展的核心环节[6]。肝损伤是引发肝纤维化的始动环节。肝细胞和其他肝非实质细胞旁分泌释放一些细胞因子激活肝星状细胞,活化的肝星状细胞增生,合成细胞外基质,同时表达部分细胞因子自分泌,共同参与调控过程。其结果,肝细胞外基质过度弥漫性沉积,形成肝纤维化肝硬化化[7]。国内外学者对肝纤维化的发病机制,诊断和防治方法进行了不懈的探索。已有资料证明,肝脏慢性损伤过程中细胞外基质累积所形成的肝纤维化,甚至肝硬化是可逆的。但是迄今抗肝纤维化的临床治疗尚无突破,更引起人们对肝纤维化研究的重视化[8]。
众所周知,DEN作为大鼠肝纤维化模型的诱导剂是研究应用最为广泛的化学制剂。研究表明,它是一种具有肝毒性、细胞毒性和免疫毒性药物,且对肝脏有明显的亲和性,使肝脏发生中毒性改变[14,15]。血清AST和ALT含量变化对肝功能损害程度有一定的参考价值。本实验研究提示模型组血清ALT和AST含量较对照组成倍的升高,考虑模型组肝功能不同程度的损害,与文献报道一致[16,17]。DEN是一种选择性的肝脏毒性物质,通过氧化细胞蛋白质DNA以及生物膜脂质,导致肝细胞坏死,形成脂质过氧化终产物MDA,故测定肝组织中MDA可以间接反映肝细胞的损伤程度[18]。SOD是体内重要的抗氧化酶,能消除生物体在新陈代谢过程中产生的有害物质。本实验结果提示,与正常组比较,模型组MDA含量明显升高,SOD含量明显下降,其发生机制可能是SOD与MDA之间的平衡被打破,组织不能抗氧化清除自由基,造成肝纤维化的形成。
GSH是机体内广泛存在的一种含硒抗氧化酶,可通过特异性催化GSH对氢化氧化物的还原反应,而消除细胞内有害的过氧化代谢产物,以阻断脂质过氧化连锁反应,从而对保护细胞代谢的正常进行起到重要作用。随着机体内能导致肝纤维化的自由基水平的不断增多,GSH-Px活性降低,因此可以作为评价肝纤维化的又一个重要指标[19]。肝脏病理学检查结果主要是发现出现不同程度的肝组织内纤维组织增生加重,正常肝小叶结构消失和形成典型的假小叶结构。目前,很多学者认为肝脏假小叶形成,即为肝硬化形成[20,21]。肝脏超微结构方面的改变主要以肝细胞核内异染色质增加、细胞器数量减少、基质密度降低和肝糖元减少等变化,提示肝细胞有进一步的损伤,诱导肝纤维化的形成,与文献[22~24]报道吻合。
本实验表明,低浓度DEN溶液可以建立稳定的肝纤维化大鼠模型,其过程相似于人类纤维化的发生过程,且其肝纤维化形成率高,动物死亡率低,实验重复性好,便于进行药物干预和疗效分析。因此,该模型是较为理想的肝纤维化研究模型。