丙型肝炎病毒相关性冷球蛋白血症肾损害1例并文献复习
2019-01-23孙伟霞牛俊奇
汝 琳,王 悦,刘 杨,孙伟霞*,牛俊奇*
(吉林大学第一医院 a.肝胆胰内科,b.肾病科,吉林 长春130021)
1 临床资料
患者,男,29岁,主因“发现尿蛋白阳性1年余,血肌酐升高1天”入院。1年余前曾因“过敏性紫癜”于外院就诊,偶然发现尿蛋白3+。患者为治疗紫癜,曾规律口服“中药(具体成分及剂量不详)”4个月,1个月前开始口服醋酸泼尼松片15 mg至今,紫癜始终无明显缓解,1天前就诊于我院门诊,发现血肌酐157.5 μmol/L,为求系统诊治入院。既往史:高血压病史1年余,血压控制不佳,过敏性紫癜病史1年余,否认肝炎病史。入院查体:身高191 cm,体重165 kg,血压178/98 mmHg,体型肥胖,四肢及背部可见广泛紫癜,双下肢中度凹陷性水肿。辅助检查:总蛋白50.3 g/L,白蛋白26.2 g/L,尿素12.62 mmol/L,肌酐157.5 μmol/L,胆固醇7.02 mmol/L,甘油三酯2.45 mmol/L,低密度脂蛋白胆固醇5.49 mmol/L,钾6.11 mmol/L;消化泌尿系彩超:胆囊炎、胆囊结石、脾略厚、前列腺钙化灶;蛋白电泳:α1球蛋白6.2%,α2球蛋白14.7%,β球蛋白12.8%;24小时尿蛋白定量:14.74 g/24 h;免疫球蛋白G 4.9 g/L,补体C3 0.56 g/L,补体C4 0.07 g/L,类风湿因子84 IU/ML,ANA系列未见异常;丙型肝炎抗体 21.5S/CO,丙肝病毒定量1.75E+006IU/ML,丙肝基因分型 1b;肾动态显像:肾小球滤过率77.13 ml/min;血清冷球蛋白沉淀阳性,37℃加热后溶解;肾穿刺活检病理:光镜检查:穿刺肾组织见肾小球19个,系膜细胞和系膜基质弥漫中-重度增生,弥漫性内皮细胞肿胀伴明显增生,3个大细胞纤维性新月体,1个细胞纤维性盘状体,3个小细胞纤维性新月体形成,增生的系膜基质节段性插入毛细血管壁,肾小球基底膜弥漫轻度增厚,节段性双轨和多轨征,偶见肾小球内皮细胞下嗜复红蛋白沉积,肾小球内弥漫性多量炎细胞浸润,肾小球内未见明显微血栓。肾小管上皮细胞空泡变性,少部分小管轻度扩张,偶见小管炎,小灶状轻度肾小管萎缩。肾间质局部轻度粘液水肿,灶状和散在淋巴、巨噬细胞浸润,局部见有嗜酸粒细胞,肾间质灶状轻度纤维化。小动脉未见明显异常。免疫荧光:肾小球2个,IgA(-)、IgM(++)、IgG(+/-)、C3(-)、C4(-)、C1q(-)、F(-)、Kappa(+/-)、Lambda(-)沿肾小球毛细血管壁节段性沉积。诊断:符合膜增生性肾小球肾炎,伴轻度亚急性间质性肾炎(图1A,1B,1C,1D)。电镜:肾小球系膜细胞和基质中至重度增生、节段插入,节段性内皮细胞增生、肿胀伴中性白细胞浸润,系膜区团块状电子致密物沉积,基底膜节段皱缩,上皮足突大部分融合;肾小管上皮空泡变性,溶酶体增多;肾间质淋巴单核细胞浸润伴胶原纤维增生。诊断:肾小球呈毛细血管内增生样改变伴节段系膜插入(图1E,1F)。根据身高、体重计算BMI:45.299 kg/m2。综上,临床诊断为“丙型肝炎病毒相关性肾小球肾炎、冷球蛋白血症、冷球蛋白血症肾损害、高血压病3级(很高危)、电解质紊乱-高钾血症、胆囊炎、胆囊结石、肥胖症”。请肝病科教授会诊后,建议应用索磷布韦/维帕他韦口服抗病毒治疗,并将醋酸泼尼松片15 mg逐渐减停。患者出院后规律口服索磷布韦/维帕他韦每日1片,同时口服氯沙坦钾片每日1片降压治疗。1个月后复查相关指标,丙肝病毒定量<100 IU/ML,但血肌酐较前上升至225.9 μmol/L,再次请肝病科教授会诊,考虑肌酐升高不除外应用索磷布韦/维帕他韦所致,建议将药量减至每日1/2片或隔日1片。目前患者仍规律随访中。
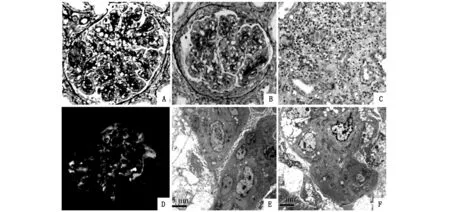
A:系膜细胞和系膜基质弥漫中-重度增生,内皮细胞弥漫增生,增生的系膜基质节段性插入毛细血管壁,节段性双轨和多轨征(PASM+MASSON染色,400倍)。B:大细胞纤维性新月体形成(PAS染色,400倍)。C:肾间质淋巴细胞、巨噬细胞浸润(PAS染色,200倍)。D: IgM沿肾小球毛细血管壁节段性沉积(荧光,400倍)。E:肾小球系膜细胞和基质中至重度增生、节段插入(电镜,4000倍)。F:系膜区团块样电子致密物沉积。(电镜,4000倍)。
图1肾穿刺活检病理
2 讨论
冷球蛋白是一种特殊的免疫球蛋白,遇冷沉淀,遇热则溶解,在正常人体内含量微乎其微。当血清中冷球蛋白含量增高(>100 mg/L),称为冷球蛋白血症,临床上常分为三型:Ⅰ型:单一的单克隆免疫球蛋白(IgM、IgG、IgA 或本琼斯蛋白)组成,多见于淋巴瘤、多发性骨髓瘤;Ⅱ型:单克隆免疫球蛋白(IgM 或IgG 或IgA)和多克隆免疫球蛋白(主要是IgG)混合组成;Ⅲ型:由多株多克隆的免疫球蛋白组成IgM-IgG、IgM-IgG-IgA等复合物,其中II型和III型称为混合型冷球蛋白血症( mixed-cryoglobulinemia,MC),多与感染有关。丙型肝炎病毒(hepatitis C virus,HCV)具有嗜肝细胞和嗜淋巴细胞特性,不仅可导致肝脏病变,还可引起多种肝外表现,如混合型冷球蛋白血症、迟发性皮肤卟啉病、干燥综合征、肾脏疾病等。在HCV 感染的自然病程中,40%-74% 的患者会至少出现1 种肝外表现[1],其中以混合型冷球蛋白血症最为常见。混合型冷球蛋白血症主要是免疫复合物沉积于中小血管,激活补体,导致弥漫性血管炎所致[2],其临床表现多种多样,常累及皮肤,表现为紫癜、溃疡、雷诺现象,也可累及肾脏,表现为血尿、蛋白尿、肾功能减低,除此之外,关节痛、周围神经病变也是混合型冷球蛋白血症常见的临床表现。
据报道,约1/3的HCV相关性混合型冷球蛋白血症患者存在肾脏损害,主要为II型冷球蛋白血症[3],其中膜增生性肾小球肾炎是最常见的肾脏病变。肾脏损害的表现多种多样,最常见的是无症状性血尿、蛋白尿,20%-30%的患者表现为肾炎综合征,20%患者表现为肾病综合征[4],约15%可逐渐进展为终末期慢性肾衰竭,需要透析治疗[5]。关于冷球蛋白血症性肾病的诊断标准,Tarantino等人[6]认为应当满足以下条件:(1)有血尿、蛋白尿等肾脏损害表现;(2)血清中检测到冷球蛋白;(3)肾活检病理结果符合冷球蛋白血症性肾病的病理特征。
对于有症状的HCV相关性冷球蛋白血症患者,治疗的核心以抗病毒为主。HCV的标准治疗方案是聚乙二醇干扰素 (polyethylene glycol interferon,PEG-IFN) 联合利巴韦林 (ribavirin,RBV),即PR方案。该方案的疗程与HCV基因型有关,基因2、3型疗程为24周,基因1、4为48周,少数应答不佳患者则为72周[7]。有研究表明[8],应用PR方案可明显改善HCV相关性冷球蛋白血症的早期肾损伤。但由于RBV主要通过肾脏代谢,如果不能被及时清除,易导致溶血,加重肾脏损害,而PEG-IFN的免疫刺激作用也可能使冷球蛋白血症的血管炎症状加重。近些年来,随着直接抗病毒药物(direct-acting antivirals,DAA)的上市,短疗程、高效、可耐受的DAA联合疗法为丙肝治疗带来了突破性的进展。多项研究[9-11]表明,应用基于DAA的无干扰素方案治疗HCV相关性冷球蛋白血症,不但可获得高持续病毒学应答率(persistent virological response,SVR),还可使人体内冷球蛋白水平显著降低,冷球蛋白血症的血管炎症状明显缓解。
对于HCV相关性冷球蛋白血症,一般不主张应用免疫抑制剂,因为它可促进病毒复制,加重感染,但若累及肾脏,病情较重,如表现为急性肾炎综合征或肾功能不全等,可应用大剂量糖皮质激素冲击治疗,或细胞毒药物(常采用环磷酰胺、硫唑嘌呤)减轻急性期症状,必要时可联合血浆置换。此外,重组嵌合抗CD20抗体利妥昔单抗(rituximab)已被证实对干扰素治疗未能取得持续病毒学应答的患者有效[12]。
本例患者因发现尿蛋白阳性、血肌酐升高入院,丙型肝炎抗体及病毒定量均为阳性,血清冷球蛋白沉淀阳性,肾穿刺活检病理符合膜增生性肾小球肾炎,考虑冷球蛋白血症相关性肾病诊断成立。2018年欧洲肝病学会发布的指南[13]指出,HCV感染相关的混合冷球蛋白血症、肾脏疾病必须采用无干扰素和利巴韦林的DAAs治疗方案。索磷布韦/维帕他韦是我国首个通过审批的泛基因型HCV单一片剂方案,初治患者无需检测基因型即可应用,一般疗程为12周,轻到中度肾功能不全 (肾小球滤过率≥30 ml·min-1·1.73 m-2) 的HCV感染者无需调整剂量,但需密切监测肾功。本例患者住院期间肾动态显像提示肾小球滤过率轻度下降,但应用索磷布韦/维帕他韦1个月后血肌酐升高较明显,考虑不除外与应用该药物有关,遂嘱患者减量,继续定期复查。
总之,临床上对丙型肝炎合并紫癜、高滴度RF、C4下降的患者应考虑冷球蛋白血症,需行冷球蛋白检测确诊,合并肾损害患者应行肾脏病理学检查进一步明确。治疗上以抗病毒为主,但如表现为急性肾炎综合征或肾功能不全,可应用糖皮质激素冲击和/或细胞毒药物治疗,减轻急性期症状。
