胶原结合域改良胰岛素样生长因子(CBD-IGF-1)对预防大鼠早期坐骨神经挤压损伤后肌肉萎缩的研究
2019-01-23于英奇李建安包天翼余双奇杨小玉
于英奇,李建安,夏 鹏,潘 肃,包天翼,余双奇,王 静,孟 洋,尹 飞,杨小玉*
(1.吉林大学第二医院 骨科,吉林 长春130041;2.吉林大学中日联谊医院 骨科,吉林 长春130033)
研究背景:在当今骨科领域,神经损伤后的肌肉萎缩一直制约着患者的疗效。神经损伤后,骨骼肌因为失去了神经的营养作用而出现萎缩,而且出现一些列的形态结构,生理生化及代谢功能改变。目前针对神经损伤后肌肉萎缩有电极刺激等方法[1],但多数都是作为一种辅助的疗法。IGF-1是近年来发现的一种神经营养因子,不但能保护神经元并为神经发育提供营养,而且能促进雪旺细胞增值,从而起到促进神经再生的作用[2],因此IGF-1对中枢神经和周围神经均有修复作用,而且可以预防神经损伤后的肌肉萎缩。而对CBD-IGF-1的前期研究表明重组的蛋白胶原结合活性明显增加,相较于IGF-1,CBD-IGF-1对神经的有效作用时间更长,而且可以更有效地促进神经再生[3]。防止本实验通过制造大鼠坐骨神经损伤模型,将CBD-IGF-1浸润于坐骨神经,四周后测量大鼠肌肉的湿重及肌肉纤维的横截面积及直径,探究CBD-IGF-1对预防大鼠神经损伤后肌肉萎缩的作用,为IGF-1应用于临床预防神经损伤后肌肉萎缩提供参考。
1 材料与方法
胶原结合域改良胰岛素生长因子-1(前期由本课题组在实验室中合成)。实验动物选取健康成年SD雌性大鼠24只(由吉林大学白求恩医学部实验动物中心提供),质量为210 g-240 g之间。
1.1 动物分组及手术方法
采用随机抽样法将实验大鼠随机分为四组,分别为:正常组,IGF-1对照组,CBD-IGF-1实验组,空白对照组。编号1-24。将4组大鼠分别用水合氯醛(400 mg/kg)腹腔内注射麻醉后,股部剪毛 ,俯卧位固定于手术台上。术前行常规碘伏消毒,四组大鼠在无菌条件下显露右侧坐骨神经;分别对IGF-1对照组,CBD-IGF-1实验组,空白对照组大鼠右侧的距离神经梨状肌下缘6 mm处坐骨神经处以持针器钳夹坐骨神经3次,每次5 s,挤压宽度为3 mm,挤压后的坐骨神经呈透明状,分别用CBD-IGF-1对1-6号;IGF-1对7-12 号大鼠的坐骨神经损伤的部位做浸润处理,13-18号为正常组,只做显露,对坐骨神经不做任何处理然,19-24号为对照组,只夹闭神经,不做浸润处理。对24 只大鼠逐层缝合伤口,术后对大鼠腹腔内注射青霉素10万U预防感染,每日1次,时间为3 d。
1.2 取材与组织切片
术后四周用脊髓脱臼法处死各组大鼠,术后显露并从股骨内外髁起点至股骨结节止点完整切取右侧小腿腓肠肌,并同时用同样方法取出对侧腓肠肌,用日本岛津公司生产电子天平libpor ael-40 sm(精确度1∶10 000)测量双侧小腿腓肠肌肌湿重,左侧和右侧腓肠肌做重量对比后.称重结束后将右侧腓肠肌放入4%的甲醛溶液予以固定。常规石蜡包埋,厚度为4 μm,行H.E染色系统测出随机5个视野中每个视野的腓肠肌肌纤维横截面积、肌肉纤维直径,同时光镜下观察肌纤维大体形态 ,使用image pro plus 6.0 软件进行分析测量纤维横截面积、肌肉纤维直径。
1.3 统计学方法

2 结果
2.1 大鼠腓肠肌大体形态观察及湿重变化
24只大鼠左侧腓肠肌及正常组双侧腓肠肌均饱满有弹性,色泽佳;IGF-1对照组,CBD-IGF-1实验组,对照组右侧腓肠肌明显萎缩变薄、色泽苍白。IGF-1对照组,CBD-IGF-1实验组大鼠的右侧腓肠肌萎缩不明显,色泽较佳,四组肌湿重相比差异有非常显著性意义(P<0.01),结果如表1所示。
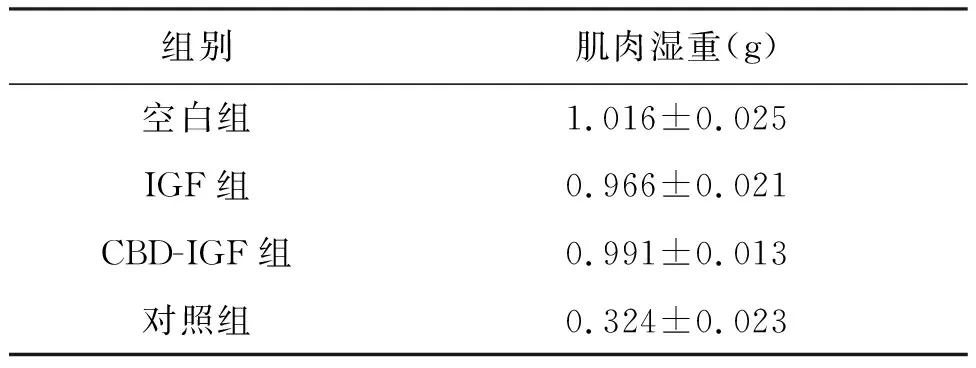
表1 大鼠的肌肉湿重比较
2.2 腓肠肌的镜下观察
正常肌肉纤维细胞在一个束状的多边形结构中,外围有若干细胞核,与正常组相比在CBD-IGF-1,IGF-1,及空白对照组中,肌肉纤维的束状结构均有不同程度的紊乱和改变,这显示了肌肉有不同程度的萎缩,甚至有些已经失去了多边形的结构,肌肉外纤维中细胞核也有不同程度正度的聚集与增生,在对正常组的大鼠的镜下微观形态学观察发现肌肉纤维均以多边形和多核的形式呈束状排列,其核位于肌质膜的周围。在对IGF-1组,CBD-IGF-1组,对照组的镜下观察发现某些肌肉纤维由于神经损伤而出现典型的改变,除了一些纤维丧失特有的多边形形状外,肌肉纤维的束状结构有明显的紊乱和大小的改变,这表明肌肉有不同程度的萎缩,通过观察发现在对照组中肌肉纤维具有更明显的形态学损伤特征,卫星细胞数量增加,细胞核聚集在一侧,肌肉外纤维增加。镜下呈几乎没有呈束状排列的肌肉纤维,肌肉纤维的排列大多呈圆形或椭圆形。但对IGF-1组,CBD-IGF-1组观察发现肌肉萎缩较之空白组并不明显,卫星细胞相较于正常组略增加,肌肉纤维呈多边形束状排列的数量相较于对照组增加,有肌肉损伤特征的肌肉纤维较之空白组减少,但肌肉外纤维组织增生不明显,有一部分受伤的肌肉纤维其中一些在退化,另一些已经在再生,肌肉之间可见有毛细血管,这可能是新生成的毛细血管。这些血管可能参与肌肉的再生。而CBD-IGF-1相比于IGF-1可以看到更多的毛细血管再生,有更多的肌肉细胞接近于正常形态。
2.3 肌肉的横截面积及直径测量
组织切片后对大鼠的腓肠肌肌肉横截面积及肌肉直径进行测量,结果如表2所示,结果显示相比较于正常组,IGF-1对照组,CBD-IGF-1实验组、实验对照组的肌肉横截面积及肌肉直径均有不同程度的缩小,但IGF-1对照组,CBD-IGF-1实验组大于实验对照组,同时CBD-IGF-1实验组大于IGF-1对照组,其差异有非常显著的意义(P<0.01)。

表2 大鼠的肌肉横截面积及肌肉直径
3 讨论
作为周围神经的靶器官,骨骼肌在神经损伤后由于失去了神经的营养作用而出现一系列微观改变包括肌肉纤维变细,肌肉纤维排列紊乱,肌肉纤维溶解,线粒体肿胀变性等 ,而从宏观角度,这些改变导致了肌肉萎缩的发生,这种改变往往是不可逆的,因此临床上常常有由于神经损伤而导致肢体功能丧失的病例[4]。
本研究的所使用的坐骨神经损伤模型可以理解为轴突损伤模型[5,6],这会导致神经肌肉之间的连接中断,这种损伤能导致肌肉形态的变化,如肌肉的横截面积减小,肌纤维的直径变小;肌肉的重量减少;本实验在空白对照组中通过观察证实了神经损伤后神经肌肉传导中断从而产生了相应的形态学变化 polonio也观察到在受伤的坐骨神经支配的肌肉中出现轮廓不规则,细胞核聚集等变化这些变化可能导致不同程度的功能丧失[7]。骨骼肌是神经的靶器官,并且利用神经进行营养物质交换,神经损伤4周后,受损的肌肉纤维仍处在一个在不断再生的过程中,其中有某些炎性介质参与其中[8]。通过观察应用IGF-1-1和CBD-IGF-1的后可以导致炎性反应的增强,血管增生加强,相较于损伤组有更加复杂的组织学形态。
IGF-1是一种多肽生长因子,它含有70个氨基酸,分子量约为7.5 kDa,与胰岛素原有相似结构性[9-11]。IGF-1在组织生长发育过程中具有重要作用,而最近研究表明IGF-1在促进周围神经修复中也有一定潜在的作用,IGF-1对损伤神经的修复作用主要表现在:①IGF-1科一促进雪旺细胞增值和分化。②能够调节轴突及突触的形成,促进树突的生长。③,在神经损伤后的应激状态下IGF-1可以抑制蛋白质分解,避免神经受到过度损伤[12]。但有研究表明是其原生形态作用较为局限,IGF-1的在体内的半衰期为8 h-16 h.因此IGF-1半衰期短、迅速扩散一直制约着IGF-1的广泛应用。而且一旦高剂量应用可能会引起相关并发症。之前的研究显示提内的许多组织,如主动脉、皮肤等含有胶原结合域,因此可以成为胶原结合域结和的靶点,本课题组前期研究合成的CBD-IGF-1蛋白分子量在5 kDa-10 kDa之间,而人体免疫系统清除作为内毒素或抗原的蛋白质往往分子量大于10 kDa[13,14],所以CBD-IGF-1的分子量可以避免被人体免疫系统所清除。而且前期研究在分子生物学角度通过ELISA证明了CBD-IGF-1可以有效地与I型胶原结合并且可以有效地体高细胞增殖率,同时CBD-IGF-1可以诱导施万细胞内的IGF-1-1R mRNA持续且相对稳定的表达,且对NGF mRNA的表达有显著促进作用。
之前有研究表明,神经元的存在能够有效维持骨骼肌的肌力,且能够有效的预防肌肉萎缩[15,16]。所以修复受损的神经是预防肌肉萎缩的关键,而IGF-1近年来已被证明能够有效地促进损伤后的神经修复,但是有其相对局限性。本实验通过模拟大鼠坐骨神经模型,将CBD-IGF-1和IGF-1分别应用于大鼠损伤后的坐骨神经,测量肌肉的横截面积,肌肉纤维的直径,肌肉的湿重数值,对改良后的IGF-1的作用进行评价,结果显示在对大鼠的坐骨神经损伤后出现的肌肉萎缩,CBD-IGF-1相较于IGF-1有更好的预防作用。
