PD-1/PD-L1抑制剂在晚期NSCLC免疫治疗中的应用研究进展
2019-01-23包晓燕陈飞金铁峰高文仓
包晓燕 陈飞 金铁峰 高文仓
2015年中国肺癌新发病例73.3万,病死病例61.0万,其发病率和病死率均居恶性肿瘤首位[1]。肺癌患者中,约80%为非小细胞肺癌(NSCLC),70%的患者在确诊时已处于晚期,往往失去手术治疗的机会[1]。晚期NSCLC的治疗仍以化疗为主,但化疗引起的毒性反应在一定程度上限制了其广泛应用。分子靶向药物具有高精准的特点,临床上效果较好,但治疗靶点阴性患者的远期生存率仍然较低[2]。随着科技的进步,肿瘤免疫治疗成为目前抗肿瘤研究领域的重要方向之一。其中程序性死亡分子-1(PD-1)及其配体(PD-L1)抑制剂颇受关注,有望开启肿瘤治疗的新模式。笔者就PD-1/PD-L1抑制剂在晚期NSCLC免疫治疗中的应用研究进展作一综述。
1 PD-1/PD-L1
PD-1是免疫细胞的共抑制分子之一,隶属于T细胞受体CD28家族,为Ⅰ型跨膜蛋白;其胞外区由1个单一的IgV样域组成,胞质区包含1个免疫受体酪氨酸抑制基序和1个免疫受体酪氨酸转化基序[3]。在外周,PD-1广泛表达于活化的CD4+T细胞、CD8+T细胞、B细胞、单核细胞及树突状细胞表面,参与自身免疫耐受[3-4]。PD-1有2种配体,即PD-L1和PD-L2[5]。PD-L1是负性共刺激分子,主要表达于肿瘤细胞上,也可表达于多种细胞表面[6-7]。PD-L2的结构与PD-L1相似,但它表达范围小,对PD-1/PD-L1/PD-L2信号通路的调节远不及PD-L1;因此,目前研究主要集中在PD-1/PD-L1相互作用上。在PD-1与PD-L1或PD-L2结合后,受抗原受体信号转导,使得PD-1胞质区2个酪氨酸信号基序磷酸化,最终使效应T细胞处于无能状态或凋亡[8-9]。
2 PD-1/PD-L1抑制剂与肿瘤逃逸机制
研究发现,PD-L1作为负性共刺激分子,高表达于多种肿瘤细胞表面(如黑色素瘤、NSCLC、卵巢癌、肾细胞癌等),提示与肿瘤的免疫逃逸有关[10-11]。具体机制有以下几点:PD-L1可以通过上调表面Fas配体及分泌大量IL-10来促进CD8+细胞毒性T淋巴细胞的凋亡[12]。PD-1通过抑制细胞周期蛋白依赖性激酶2对Sma及Mad相关蛋白3的磷酸化促进T细胞向调节性T细胞分化,同时作用于Ras通路,放大调节性T细胞的免疫抑制作用[13]。肿瘤上皮细胞-间充质转化与肿瘤侵袭、转移和抗凋亡的特性有关;Cao等[14]发现小鼠皮肤癌模型PD-L1表达会降低肿瘤细胞上皮钙黏蛋白含量,加快肿瘤上皮细胞-间充质转化和上皮细胞癌变的进展,促进肿瘤细胞的免疫逃逸。此外,PD-1/PD-L1通过影响T细胞能量代谢、诱导细胞毒性T淋巴细胞转变为功能耗竭型T细胞为肿瘤细胞的免疫逃逸提供条件[15]。因此,PD-1/PD-L1抑制剂可以通过多种途径发挥T细胞对抗肿瘤的免疫效应。
3 PD-1/PD-L1抑制剂的现状
PD-1/PD-L1抑制剂相继被FDA、欧盟、日本批准用于黑色素瘤、NSCLC、肾癌、膀胱癌等肿瘤治疗。目前美国FDA批准上市的PD-1/PD-L1抑制剂有5种药物,见表1。国内首个PD-1抑制剂Nivolumab于2018年6月获CFDA批准上市。目前国内多项治疗肺癌的PD-1/PD-L1抑制剂研究已进入Ⅲ期临床试验;多家药企PD-1药物的上市申请尚处于审评、审批阶段。

表1 美国FDA批准上市的PD-1/PD-L1抑制剂
4 PD-1/PD-L1抑制剂在NSCLC治疗中的应用
4.1 PD-1/PD-L1抑制剂单药应用
4.1.1 Nivolumab 基于 CheckMate-017、CheckMate-057这2项Ⅲ期临床试验结果(比较Nivolumab与多西他赛),美国FDA于2015年先后批准Nivolumab用于治疗后进展的鳞癌型和非鳞癌型晚期NSCLC患者的二线治疗[16-17]。随访至今,最新数据显示Nivolumab能给患者持续的生存获益,进一步巩固其在二线治疗中的优势地位[18]。CheckMate-017、CheckMate-057 这 2 项研究主要针对西方人群,那么东亚人群呢?吴一龙团队在中国开展的Ⅲ期临床研究(CheckMate-078)解答了这一问题。据今年4月份美国癌症研究协会会议上口头公布的结果,Nivolumab在耐受性和安全性方面与CheckMate-017、CheckMate-057研究结果一致,见表 2[19]。CheckMate-078临床试验阳性结果证实,Nivolumab对东亚人群也有效果且安全性较好;其亚组研究结果显示,Nivolumab对不同肿瘤组织学类型和PD-L1表达水平的患者都有效果[19]。这有望开启中国肺癌免疫治疗的新时代。
在Nivolumab进军一线治疗的路上,Ⅲ期临床试验(CheckMate-026)显示Nivolumab对患者生存的改善并不优于标准化疗[20]。如何使Nivolumab达到最大的临床获益,未来仍需进一步研究。
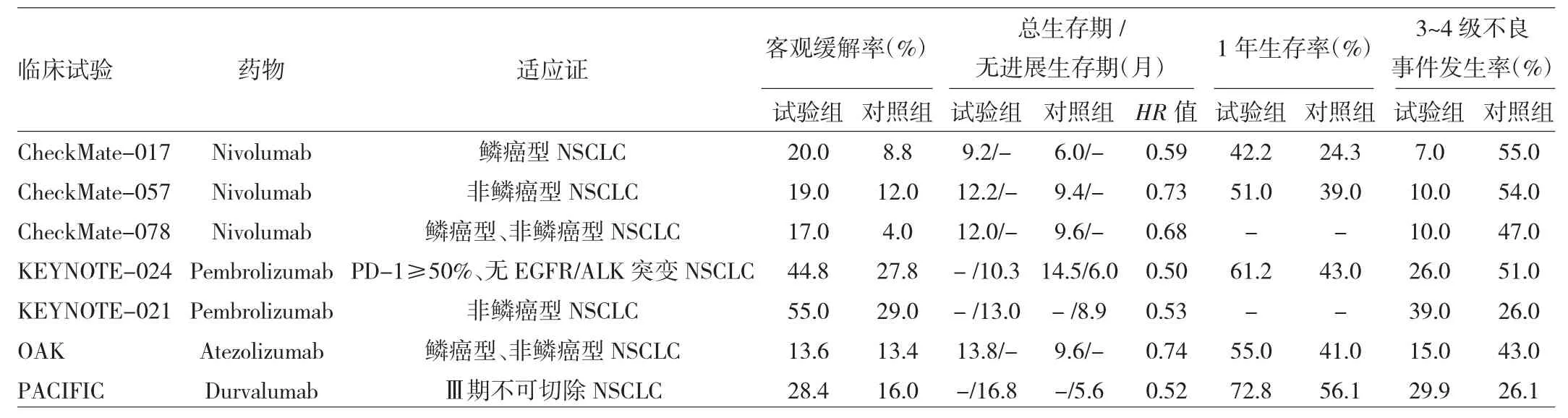
表2 已上市PD-1/PD-L1抑制剂相关Ⅲ期临床试验结果
4.1.2 Pembrolizumab KEYNOTE-001临床试验首次证实了Pembrolizumab对NSCLC的疗效,并发现其疗效与PD-L1表达水平有关[21]。基于该结果,2015年10月美国FDA通过了“Pembrolizumab用于二线治疗PD-L1阳性(≥1%)且在含铂化疗期间或之后发生疾病进展的转移性NSCLC患者”的快速审批[22]。KEYNOTE-010临床试验首次将PD-L1表达作为预测Pembrolizumab疗效的指标,并肯定了其预测价值[23]。在KEYNOTE-024临床试验中,学者评价了Pembrolizumab一线治疗效果,并与化疗进行比较[24]。美国国立综合癌症网络指南推荐Pembrolizumab用于PD-L1阳性(≥50%)转移性NSCLC的一线用药[25]。可见,Pembrolizumab在一线、二线治疗中均有一定优势,可为临床治疗提供更灵活的选择方式;也为先免疫再序贯化疗的治疗顺序提供了依据。
4.1.3 Atezolizumab 基于全球性的Ⅲ期OAK临床试验结果[26],2016年10月美国FDA批准Atezolizumab用于治疗多线治疗失败的转移性NSCLC患者,其疗效及安全性较好,且不受组织类型及PD-L1表达的影响。在PD-L1≥1%的人群中,试验组中位生存期延长了5.4个月(15.7个月vs 10.3个月);在PD-L1低表达或不表达患者中,中位生存期延长了3.7个月(12.6个月vs 8.9个月);鳞癌型与非鳞癌型NSCLC患者有着相似的生存获益。有学者对日本患者进行亚组分析,也得出了相似的结果[27]。但是,Atezolizumab对我国患者的临床获益情况,目前尚缺乏相关研究。
4.1.4 Durvalumab 在全球范围内,约30%的NSCLC患者为Ⅲ期;对于Ⅲ期不可切除NSCLC患者,目前延缓疾病进展的策略是放化疗。2017年欧洲肿瘤内科学会会议报告了Ⅲ期临床研究PACIFIC的结果[28]:试验组无进展生存期较对照组延长11.2个月,不良事件发生率升高不明显。日前,美国FDA批准Durvalumab可用于治疗不可切除、接受放化疗后疾病未进展的Ⅲ期NSCLC,该免疫治疗药物是延缓NSCLC进展的第一种药物。由于89%的Ⅲ期NSCLC患者肿瘤会进展并发生转移,这一延缓疾病进展的治疗显得弥足珍贵。
4.2 PD-1/PD-L1抑制剂联合其他药物应用
4.2.1 PD-1/PD-L1抑制剂联合化疗 基于KEYNOTE-021临床试验结果[29],2017年5月美国FDA批准了Pembrolizumab联合培美曲塞+卡铂用于既往未经治疗、无突变的晚期非鳞癌型NSCLC患者的一线治疗,将肺癌的免疫治疗带入联合化疗的全新治疗模式。虽然该研究入组例数较少,3级以上不良事件发生率有所升高,获批也存在争议,但后续Ⅲ期临床试验KEYNOTE-189、KEYNOTE-407均得出Pembrolizumab联合化疗较单纯化疗提高接近1倍的客观缓解率(58.4%vs 35.0%)[30-31]。关于Atezolizumab联合化疗一线治疗晚期鳞癌型NSCLC患者的IMPower131临床试验中期分析结果于2018年6月美国临床肿瘤学会会议上公布,其效果值得肯定[32]。联合化疗能减少29%的疾病恶化或病死风险,1年无进展生存率增加1倍(24.7%vs 12.0%),且在各亚组中均能观察到,包括PD-L1表达阴性肿瘤和肝转移患者;总生存期数据尚未成熟;在安全性方面,与单药治疗的已知风险一致。从亚组来看,PD-1高表达患者的获益相对呈阶梯式升高,提示虽然联合治疗效果总体上优于单药化疗,但真正从中获益的仍是PDL1高表达的患者。因此,准确选择高获益人群很重要。
4.2.2 PD-1/PD-L1抑制剂联合免疫治疗 自双免疫阻断模式分别于2011、2017年被美国FDA批准用于恶性黑色素瘤和肾细胞癌后,该模式在肺癌治疗方面的研究也不断展开。目前,双免疫阻断的主要模式有PD-1/PDL1抑制剂联合细胞毒性T淋巴细胞相关抗-4抑制剂、PD-1/PD-L1抑制剂联合肺癌疫苗;但尚无PD-1/PDL1抑制剂联合PD-1/PD-L1抑制剂的研究[33]。由于PDL1与细胞毒性T淋巴细胞相关抗-4分别作用于免疫调节的活化及效应阶段[34],所以同时阻断这2个关键点,可能会带来意想不到的效果。CheckMate 227临床试验对Nivolumab联合Ipilimumab与化疗对NSCLC患者的疗效进行了比较,目前报道的主要数据显示,该联合方式的安全性较高,对高肿瘤负荷患者的疗效尤为突出;同时发现PD-L1表达水平与高肿瘤负荷状态无关[35]。
4.2.3 PD-1/PD-L1抑制剂联合分子靶向药物 约50%的亚裔NSCLC患者存在表皮生长因子受体(EGFR)基因的突变[36]。该基因突变能上调肺癌细胞PD-L1的表达,而PD-1/PD-L1抑制剂能明显降低突变肺癌细胞PD-L1的表达,降低其生存能力[37-38]。这为PD-1/PD-L1抑制剂联合EGFR-酪氨酸激酶抑制剂治疗肺癌提供了思路。一项关于Nivolumab联合厄洛替尼治疗晚期NSCLC患者的Ⅰ期临床研究NCT01454102中期数据表明联合治疗有效[39]。值得思考的是,若EGFR-酪氨酸激酶抑制剂下调了PD-L1表达,那么联合PD-1/PD-L1抑制剂能否达到“1+1≥2”的效果?血管内皮生长因子通路不仅促进了肿瘤血管生成,还通过传递抑制性免疫信号促使肿瘤细胞的免疫逃避。贝伐珠单抗可以通过逆转血管内皮生长因子介导的免疫抑制,增加Atezolizumab活化的T细胞杀伤肿瘤的效应。Ⅲ期临床试验IMpower150评估了Atezolizumab+化疗(卡铂和紫杉醇)联合或不联合贝伐珠单抗(B、C组)对初治Ⅳ期非鳞NSCLC的疗效和安全性,还对入组患者进行了治疗标本活检[40]。从今年美国临床肿瘤学会更新数据来看,在野生型(ITT-WT型)患者中,B组总生存期优于C组(19.2个月vs 14.7个月,HR=0.78);A组(贝伐珠单抗+化疗)较C组的总生存期延长,但差异无统计学意义;且PD-L1高表达及肝转移患者获益明显;在EGFR+/间变淋巴瘤激酶(ALK)+患者中,B组无进展生存期优于C组(9.7个月vs 6.1个月,HR=0.59),中位总生存期有望延长12.5个月[40]。目前关于免疫联合一线治疗的临床研究大多排除了EGFR+/ALK+患者,而IMpower150临床研究对EGFR+/ALK+患者进行了疗效分析,是一大特色;但这类患者是否适合一线免疫治疗,有待更多研究进行探索。
5 免疫治疗标志物
PD-1/PD-L1抑制剂在治疗NSCLC方面取得了一定的成功;但有研究表明在未经选择的患者中,仅20%对治疗产生反应[41]。因此,准确选择对PD-1/PD-L1抑制剂治疗有反应的患者至关重要,且在开发与PD-1/PD-L1抑制剂联合治疗方面更为重要。PD-L1表达和高肿瘤负荷是目前较为确定的标志物,但它们不稳定,都是不完美的预测因素。目前对TIM-3、LAG-3、TIGIT、TILs等能否作为标志物,正在探索研究中。
6 小结
免疫治疗已成为备受关注的肿瘤治疗手段之一,也成为许多晚期肿瘤患者的希望。越来越多证据支持PD-1/PD-L1抑制剂在肺癌治疗方面的效果。总的来说,PD-1/PD-L1抑制剂单药在二线治疗方面明显优于标准化疗,已成为一线化疗失败晚期NSCLC的标准治疗方案。在一线治疗方面,Pembrolizumab较其他药物略胜一筹;Durvalumab是唯一可以延缓肺癌进展的免疫药物。在联合治疗方面,PD-1/PD-L1抑制剂联合化疗的优势明显,联合靶向治疗大有前景,双免疫阻断模式对高肿瘤负荷患者的疗效最明显,其他免疫联合有待更多研究进行探索。PD-1/PD-L1抑制剂的不良反应较少,但免疫相关不良反应要引起注意,应及时识别并处理以降低风险。此外,寻找最佳的生物标志物来筛选获益人群是目前最有意义的工作,也是指导晚期NSCLC患者精准、个体化治疗的先决条件。
