miRNA-1271对人乳腺癌细胞增殖的影响
2019-01-23张红晨顾锡冬谢小红
张红晨 顾锡冬 谢小红
乳腺癌发病率居女性癌症的首位,且发病人群有年轻化趋势[1]。手术、放疗、化疗、内分泌治疗及靶向治疗是乳腺癌的主要治疗方式,若复发、转移或产生耐药,患者预后往往较差[2]。微小RNA(miRNA)是一类长度约22nt的非编码单链RNA小分子,通过在转录或转录后水平对其靶基因的表达进行调控,进而参与细胞分化、增殖和凋亡[3]。相关文献表明,miRNA在肿瘤发生、发展及变异过程中发挥着重要的调控作用[4]。本研究对miRNA-1271在乳腺癌组织中的表达以及对人乳腺癌细胞增殖的影响作一探讨,现将结果报道如下。
1 材料和方法
1.1 材料 人乳腺癌细胞株MCF-7和MDA-MB-231来源于中国科学院上海生命科学研究院;SPF级健康雌性裸鼠(4~6周)购于中国科学院上海实验动物中心,体重(20.0±3.0)g。改良杜氏伊格尔(DMEM)培养基购于美国Gibico公司;FBS购自杭州四季青生物技术有限公司;转染过程中使用的LipofectamineTM2000试剂盒及Trizol试剂均购自美国Invitrogen公司;miRNA检测试剂盒购于德国Qiagen公司;凋亡检测试剂盒及结晶紫染液均购于美国Sigma公司。CCK-8试剂盒购于美国BD Biosciences公司。80例乳腺癌组织及其癌旁正常组织标本来源于本院2017年1月至2018年1月经术后病理学证实的原发性乳腺癌患者,所有患者术前未接受过放化疗,年龄 28~75(39,66)岁,均签署知情同意书。
1.2 RT-PCR法检测乳腺癌组织及癌旁正常组织miRNA-1271表达 将乳腺癌及癌旁正常组织标本制备成匀浆,离心除去碎片物质,取上清液,加入裂解液1ml,依次用氯仿、异丙醇抽提,乙醇洗涤,通过紫外分光光度计检测样品中RNA浓度。miRNA-1271引物为5′-CUUGGCACCUAGCAAGCACUCA-3′。 以 95℃ 5min、95℃ 15s、60℃ 30s、72℃ 30s共 40 个循环进行 RT-PCR检测。miRNA反转录反应后,利用TaqMan miRNA检测并量化miRNA-1271在乳腺癌及癌旁正常组织中的相对表达量。
1.3 细胞培养及转染 将人乳腺癌细胞株MCF-7和MDA-MB-231分别置于添加10%FBS的DMEM培养基中,在37℃恒温、5%CO2培养箱内培养。在细胞对数生长期,使用乙二胺四乙酸消化。为研究miRNA-1271对乳腺癌细胞增殖能力的影响,笔者对MCF-7和MDA-MB-231细胞进行质粒转染,以增加miRNA-1271的表达。转染前取培养好的细胞接种于6孔培养板,转染时将培养液更换为无血清无双抗的培养液,按照LipofectamineTM2000转染试剂盒说明书,将miRNA-1271模拟物或阴性对照(空载质粒)与脂质体试剂混匀,室温静置20min,转染后6~8h,更换为正常的完全培养基。RT-PCR法检测实验组及对照组miRNA-1271相对表达量。转染miRNA-1271模拟物质粒的乳腺癌细胞为实验组;转染空载质粒的乳腺癌细胞为对照组。
1.4 miRNA-1271对乳腺癌细胞体外增殖的影响 采用CCK-8实验。收集稳定转染后的MCF-7和MDAMB-231细胞,分别制成单细胞悬液并在显微镜下计数。在96孔培养板中每孔接种细胞1×103个,每孔加入培养液100μl,复孔数设置为6个。连续4d在固定时间点每孔加入CCK-8试剂10μl,摇匀后避光培养3h。利用多功能酶标仪检测(波长490nm处)测定吸光度(OD)值,并绘制细胞生长曲线。
1.5 miRNA-1271对乳腺癌细胞克隆形成的影响 采用集落形成实验。细胞转染24h后,用胰蛋白酶消化细胞,制成细胞悬液。细胞计数后铺于6孔板中,细胞密度为300个/孔。每组设3个复孔,反复吹打并摇匀,防止细胞成团。培养2周后,用4%多聚甲醛固定细胞,0.1%结晶紫染色,在显微镜下计数并分析集落形成数。
1.6 miRNA-1271对乳腺癌细胞凋亡的影响 采用流式细胞术。取稳定转染24h后实验组和对照组乳腺癌细胞,冰PBS洗涤,冰乙醇固定细胞,4℃过夜。离心5min后收集细胞,加入5μl异硫氰酸荧光素并轻轻混匀,3min后再加入10μl碘化丙啶,37℃水箱中避光反应15min;离心后重悬于0.5ml预冷的缓冲液中,混匀后用流式细胞仪检测细胞凋亡情况。
1.7 miRNA-1271对MCF-7乳腺癌细胞体内增殖的影响 采用动物实验。取实验组(稳定过表达miRNA-1271)和对照组MCF-7细胞,分别配置成1×107个/ml细胞悬液,接种于裸鼠右腋皮下。在无病原体环境下饲养裸鼠。细胞接种4周后,处死小鼠,取出移植瘤组织并称重。
1.8 统计学处理 应用SPSS 19.0和GraphPad Prism 5.0统计软件。计量资料用 表示,组间比较采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌组织与癌旁正常组织中miRNA-1271相对表达量比较 乳腺癌组织中miRNA-1271相对表达量为0.55±0.02,明显低于癌旁正常组织中的1.50±0.03,差异有统计学意义(P<0.05),见图1。
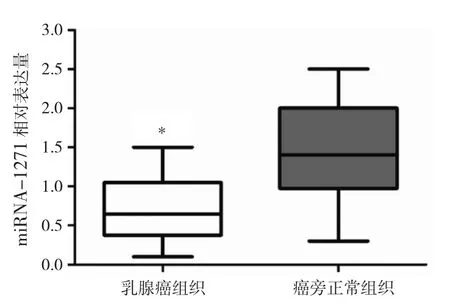
图1 乳腺癌组织与癌旁正常组织中miRNA-1271相对表达量比较(*P<0.05)
2.2 miRNA-1271对乳腺癌细胞体外增殖的影响 与对照组比较,实验组MCF-7和MDA-MB-231细胞中miRNA-1271相对表达量均明显升高(均P<0.05),即转染成功,见图2。与对照组比较,上调miRNA-1271表达后的MCF-7和MDA-MB-231乳腺癌细胞OD值明显低于对照组(均P<0.05),见图3。这表明上调miRNA-1271表达后,MCF-7和MDA-MB-231乳腺癌细胞的体外增殖能力受到明显抑制。
2.3 miRNA-1271对乳腺癌细胞克隆形成的影响 与对照组比较,miRNA-1271过表达后的 MCF-7和MDA-MB-231乳腺癌细胞形成克隆体积更小、数目更少,实验组与对照组集落形成数比较差异有统计学意义(均P<0.05),见图4。这表明miRNA-1271能抑制MCF-7和MDA-MB-231乳腺癌细胞的克隆形成能力。
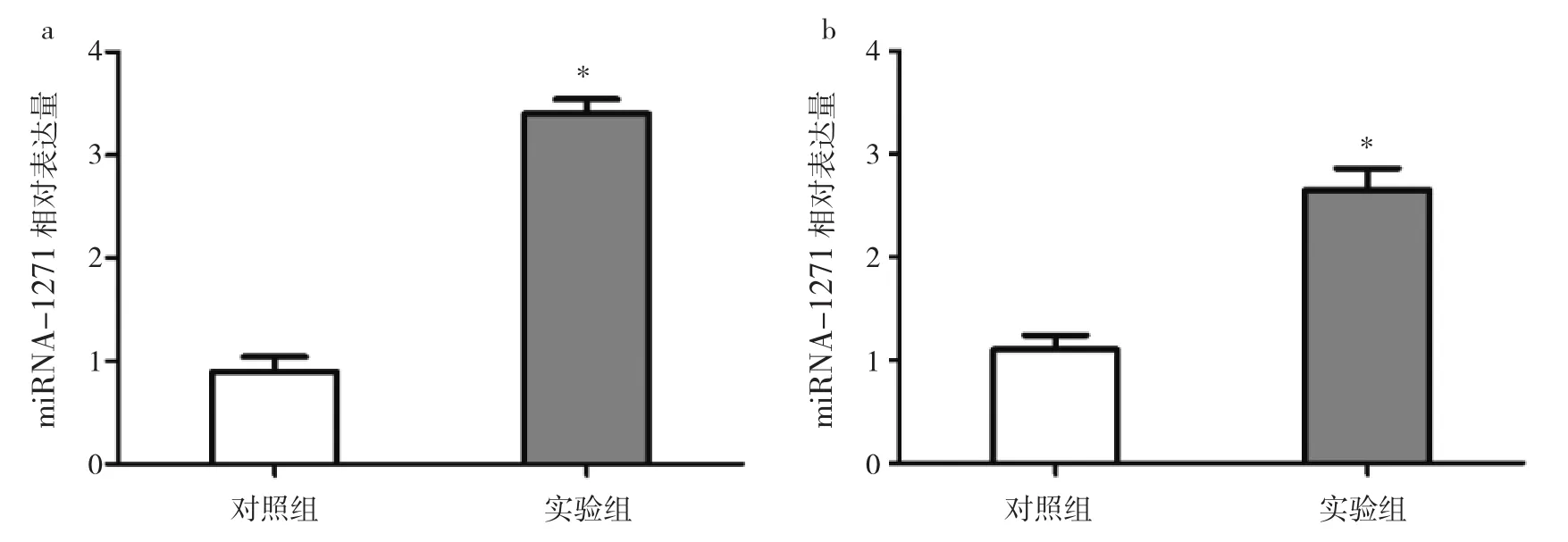
图2 乳腺癌细胞中miRNA-1271的转染效率(a:MCF-7细胞;b:MDA-MB-231细胞;与对照组比较,*P<0.05)

图3 miRNA-1271对乳腺癌细胞体外增殖的影响(a:MCF-7细胞;b:MDA-MB-231细胞;与对照组比较,*P<0.05)
2.4 miRNA-1271对乳腺癌细胞凋亡的影响 与对照组比较,转染miRNA-1271的MCF-7和MDA-MB-231乳腺癌细胞凋亡率明显升高(均P<0.05),见图5。这表明miRNA-1271能促进MCF-7和MDA-MB-231乳腺癌细胞凋亡。

图4 miRNA-1271对乳腺癌细胞克隆形成的影响(a:MCF-7细胞;b:MDA-MB-231细胞;与对照组比较,*P<0.05)
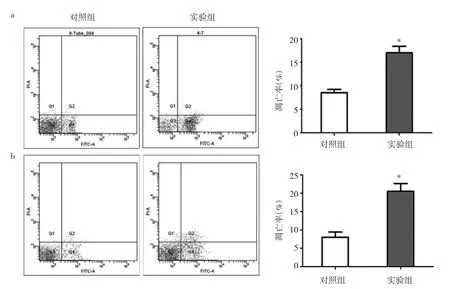
图5 miRNA-1271对乳腺癌细胞凋亡的影响(a:MCF-7细胞;b:MDA-MB-231细胞;与对照组比较,*P<0.05)
2.5 miRNA-1271对MCF-7乳腺癌细胞体内增殖的影响 与对照组比较,实验组裸鼠移植瘤体积明显较小,质量明显较低,差异有统计学意义(P<0.05),见图6。这表明上调miRNA-1271表达后,MCF-7乳腺癌细胞的体内增殖能力受到明显抑制。
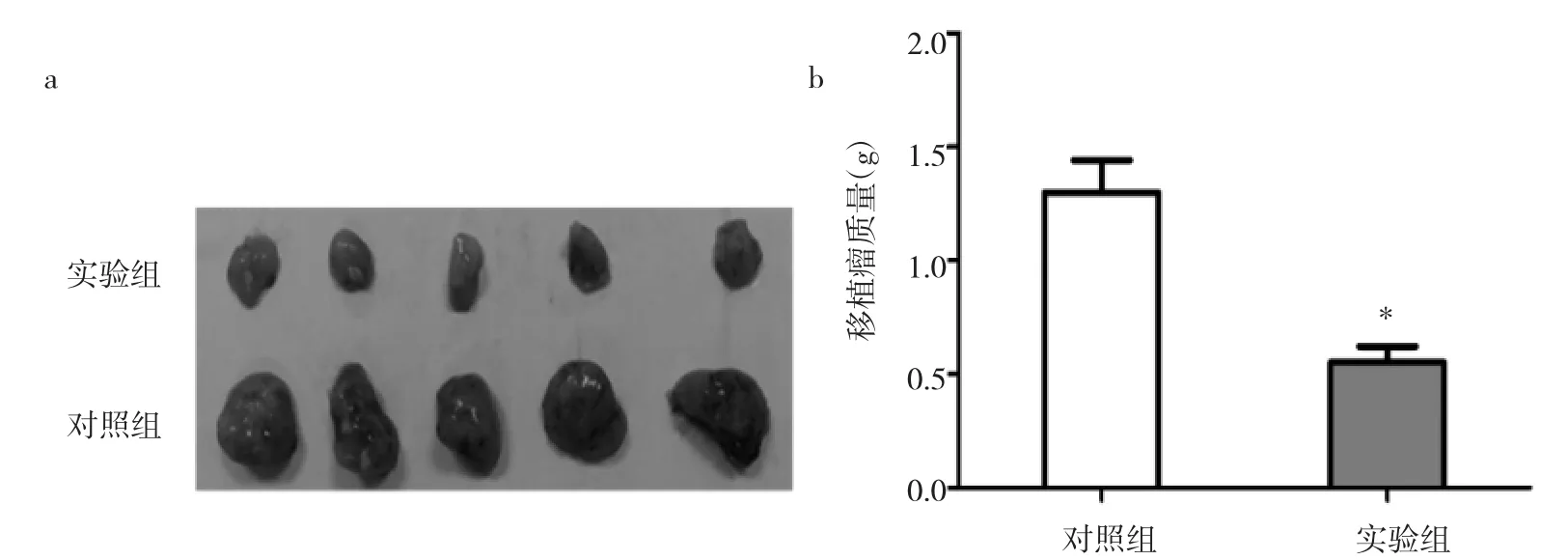
图6 miRNA-1271对乳腺癌细胞体内增殖的影响(a:两组移植瘤体积比较;b:两组移植瘤质量比较,*P<0.05)
3 讨论
在女性恶性肿瘤中,乳腺癌发病率及病死率均居首位,严重威胁着女性健康[5]。miRNA是一组进化保守且具有调控功能的非编码RNA,通过与靶基因mRNA的3′-非翻译区互补配对结合,导致miRNA降解或抑制其翻译表达[6]。许多miRNA发挥着类似于癌基因或抑癌基因的作用,是肿瘤的潜在治疗靶点和预后指标[7]。miRNA-1271是在人类胚胎干细胞中的ARL10基因第2内含子区域被识别,是miRNA-96的同源类似物[8]。最近研究发现,miRNA-1271 在肝癌[9]、肺癌[10]、结肠癌[11]、前列腺癌[12]和胃癌[13]中均呈低表达。在肺癌中,miRNA-1271表达降低;外源性上调其表达后,miRNA-1271通过调控mTOR基因可抑制癌细胞的增殖[10]。在胃癌中,miRNA-1271因甲基化而表达降低,通过靶向调控MEK1/ERK/MAPK信号转导途径在胃癌细胞生长、侵袭和迁移过程中发挥着重要作用[13]。然而,miRNA-1271在乳腺癌中的研究报道尚少,其生物学功能尚待阐明。
本研究对80例乳腺癌及癌旁正常组织中miRNA-1271表达进行检测,结果发现miRNA-1271在乳腺癌组织中呈低表达,说明miRNA-1271可能在乳腺癌中发挥抑癌基因的作用。于是,笔者对MCF-7和MDA-MB-231乳腺癌细胞稳定转染miRNA-1271模拟物,以探究上调miRNA-1271对乳腺癌细胞生物学功能的影响。CCK-8实验结果发现,miRNA-1271的表达水平升高后,乳腺癌细胞的体外增殖能力受到明显抑制;集落形成实验发现,miRNA-1271能明显减弱肿瘤细胞的成瘤能力。裸鼠成瘤实验结果证实,miRNA-1271在体内亦能抑制乳腺癌细胞的增殖。细胞凋亡,即细胞的程序性死亡,是由基因控制的细胞自主的有序的死亡[14]。凋亡是多基因多步骤严格控制的过程,而凋亡调控的失衡是肿瘤发生、发展的重要过程。本实验利用流式细胞术检测细胞凋亡情况,结果发现miRNA-1271能通过促进凋亡的发生来抑制乳腺癌细胞的增殖能力。Qin等[15]实验结果与之相似,在肝癌中低表达的miRNA-1271,通过靶向作用于FOXQ1基因,促进肝癌细胞凋亡比例增加,从而抑制肝癌细胞的增殖。关于乳腺癌的研究发现,FOXQ1是TGF-β信号通路中的一个重要靶点,miRNA-1271促进乳腺癌细胞凋亡的机制可能与FOXQ1相关[16]。Du等[17]近期研究发现,miRNA-1271在乳腺癌组织及细胞中的表达明显降低,并通过靶向调控SPIN1基因表达来抑制乳腺癌细胞增殖、侵袭和迁移能力,呈现出抑癌基因的活性。
综上所述,miRNA-1271在乳腺癌组织中低表达;上调miRNA-1271表达,能抑制乳腺癌细胞的增殖,促进凋亡的发生,具有抑癌作用。本研究为乳腺癌的治疗提供了一个新思路,为后续深入探讨miRNA-1271在乳腺癌中的作用机制提供了前期实验基础。
