细粒棘球绦虫蛋白egG1y162-1、egG1y162-2的抗原表位比较
2019-01-22李玉娇张峰波王红英李智伟周晓涛丁剑冰
沙 桐, 李玉娇, 张峰波, 王红英, 李智伟, 赵 骁, 周晓涛, 丁剑冰,3
(新疆医科大学1基础医学院, 乌鲁木齐 830011; 2第一附属医院, 乌鲁木齐 830054;3省部共建中亚高发病成因与防治国家重点实验室, 乌鲁木齐 830011)
细粒棘球蚴病是由细粒棘球绦虫幼虫感染中间宿主引起的一种地方性和自然疫源性的人兽共患寄生虫病[1]。细粒棘球绦虫(Echinococcus granulosus,Eg)生活史需要两个宿主,成虫寄生在犬(终末宿主)的小肠,其虫卵随粪便排出体外污染环境造成中间宿主羊和人感染,进而发展为包虫病[2]。包虫病在我国新疆和青藏高原地区比较常见,由于人群的自我保护意识较差,疾控的宣传控制力量比较弱,缺乏各种关于包虫病的健康教育,受感染人数比较多。由于包虫病治疗预后差,其预防显得尤为重要。随着分子生物学的发展,寻找并获得Eg的相关保护性疫苗成为近年来的热点。2009年,曹春宝[3]在细粒棘球蚴中发现了新基因--egG1Y162 抗原基因,该抗原基因已送登基因库(Genbank)。曹春宝构建的egG1y162蛋白质是细粒棘球绦虫成虫和原头蚴均表达的蛋白。该蛋白能够跟感染囊性包虫病的病人血清和犬血清进行反应,说明该蛋白具有良好的抗原性,从该蛋白中获得确切的表位信息,进行表位疫苗的构建,或者反复将该表位构建到高分子载体上,能够提高疫苗的保护能力,对未来包虫病感染的预防有着重要的意义[4]。Zhang等[5]在此基础上对egG1y162蛋白的抗原表位进行分析,将软件预测的结果进行多重比较,并对预测的T细胞和B细胞联合表位通过分子生物学的方法进行克隆、诱导和表达,纯化出相应的重组蛋白。又根据预测的3个T-B 联合表位所在的区域结果将抗原截短为2段,其中一段含有1个T-B联合表位,即1~51位氨基酸残基,另外一段含有2个T-B 联合表位,即52~120位氨基酸残基。第一段被命名为egG1y162-1,第二段被命名为egG1y162-2[6]。因此,本次研究将利用生物信息学方法[7-12],通过计算机软件对egG1y162-1和egG1y162-2重组蛋白进行理化性质和空间结构进行分析比较,并对可能的T细胞(人和鼠)及B细胞优势表位进行预测,为深入研究包虫的egG1y162-1/2相关候选疫苗分子的研究奠定基础。
1 材料与方法
1.1egG1y162-1和egG1y162-2的氨基酸序列egG1y162蛋白的氨基酸序列存于GenBank,登录号为AB458259[2],全长120个氨基酸,egG1y162-1为1~51位氨基酸,egG1y162-2为52~120位氨基酸。
1.2egG1y162-1和egG1y162-2的理化性质利用在线软件ProtParam(http://web.expasy.org/protparam/)分别对egG1y162-1和egG1y162-2的理化性质进行分析。
1.3egG1y162-1和egG1y162-2的二级结构使用DNAstar protean软件和SOMPA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl? page=npsa_sopma.html) 在线软件分析egG1y162-1和egG1y162-2的二级结构。
1.4egG1y162-1和egG1y162-2的三级结构运用SWISS MODEL在线软件(https://www.swissmodel.expasy.org/interactive)建立模型,分析egG1y162-1和egG1y162-2的三级结构。
1.5egG1y162-1和egG1y162-2的T细胞抗原表位运用在线软件SYFPEITHI (http://www.syfpeithi.de/bin/mhcserver.dll/epitopeprediction.htm)、IEDB(http://tools.iedb.org/mhcii/)分析egG1y162-1和egG1y162-2的T细胞优势抗原表位。
1.6egG1y162-1和egG1y162-2的B细胞抗原表位运用在线软件ABCpred(http://crdd.osdd.net/raghava/abcpred/ABC_submission.html)、BCPred( http://ailab.ist.psu.edu/bcpred/predict.html)、BepiPred-1.0(http://www.cbs.dtu.dk/services/BepiPred-1.0/)、IEDB(http://tools.iedb.org/bcell/)分析egG1y162-1和egG1y162-2的B细胞可能的优势抗原表位。
2 结果
2.1egG1y162-1和egG1y162-2的氨基酸序列根据GenBank AB458259上的egG1y162蛋白氨基酸序列,确定egG1y162-1(1~51位氨基酸)的序列为:VDPELMAKLTKELKTTLPEHFRWIHVGSRSL-
ELGWNATGLANLHADHIKLT,51个氨基酸残基;egG1y162-2(52~120位氨基酸)的序列为:ANLYTTYVTFKYRNVPIERQKLTLEGLKPSTFY-
EVVVQAFKGGSQVFKYTGFIRTLAPGEDGA-
DRASGF,69个氨基酸残基。
2.2ProtParam在线软件分析结果
2.2.1 egG1y162-1的理化性质 egG1y162-1蛋白由51个氨基酸组成,蛋白分子质量为5789.70 Daltons;理论pI值为7.08;其中含有6个强碱性(+)氨基酸(K,R);6个强酸性(-)氨基酸(D,E);分子式为C262H417N73O73S1;不稳定指数为44.20,归类为不稳定蛋白(>40时,预测蛋白不稳定);平均亲水系数GRAVY:-0.259(GRAVY值的范围为-2~2,负值表明为亲水性蛋白),归类为亲水性蛋白。
2.2.2 egG1y162-2的理化性质 egG1y162-2蛋白由69个氨基酸组成,蛋白分子质量为7743.80 Daltons;理论pI值为9.40;其中含有9个强碱性(+)氨基酸(K,R);6个强酸性(-)氨基酸(D,E);分子式为C357H545N91O102;不稳定指数为19.33,归类为稳定蛋白(>40时,预测蛋白不稳定);平均亲水系数GRAVY:-0.267(GRAVY值的范围在-2~2之间,负值表明为亲水性蛋白),归类为亲水性蛋白。
2.3egG1y162-1和egG1y162-2的二级结构
2.3.1 SOPMA服务器分析 SOMPA分析软件是用来分析蛋白质的α-螺旋、β-折叠、β-转角、无规卷曲等二级结构。蓝色Hh表示α-螺旋,红色Ee表示β-折叠,绿色Tt表示β-转角,紫色Cc表示无规卷曲。egG1y162-1结果见图1,egG1y162-2结果见图2。
2.3.2 DNAstar protean结果 运用DNAstar protean软件中Garnier-Robson法和Chou-Fasman法分析蛋白质二级结构,主要是α-螺旋(Alpha)、β-折叠(Beta)、β-转角(Turn)、无规卷曲(Coil)。egG1y162-1蛋白质二级结构结果分别见图3和表1,两种方法结果均显示egG1y162-1无β-折叠区域,α-螺旋占比最高,易形成表位的转角和无规卷曲区域较少。egG1y162-2蛋白质二级结构结果见图4和表2,两种方法结果显示egG1y162-2的α-螺旋、β-折叠占比较高,但存在许多易形成表位的转角和无规卷曲区域。
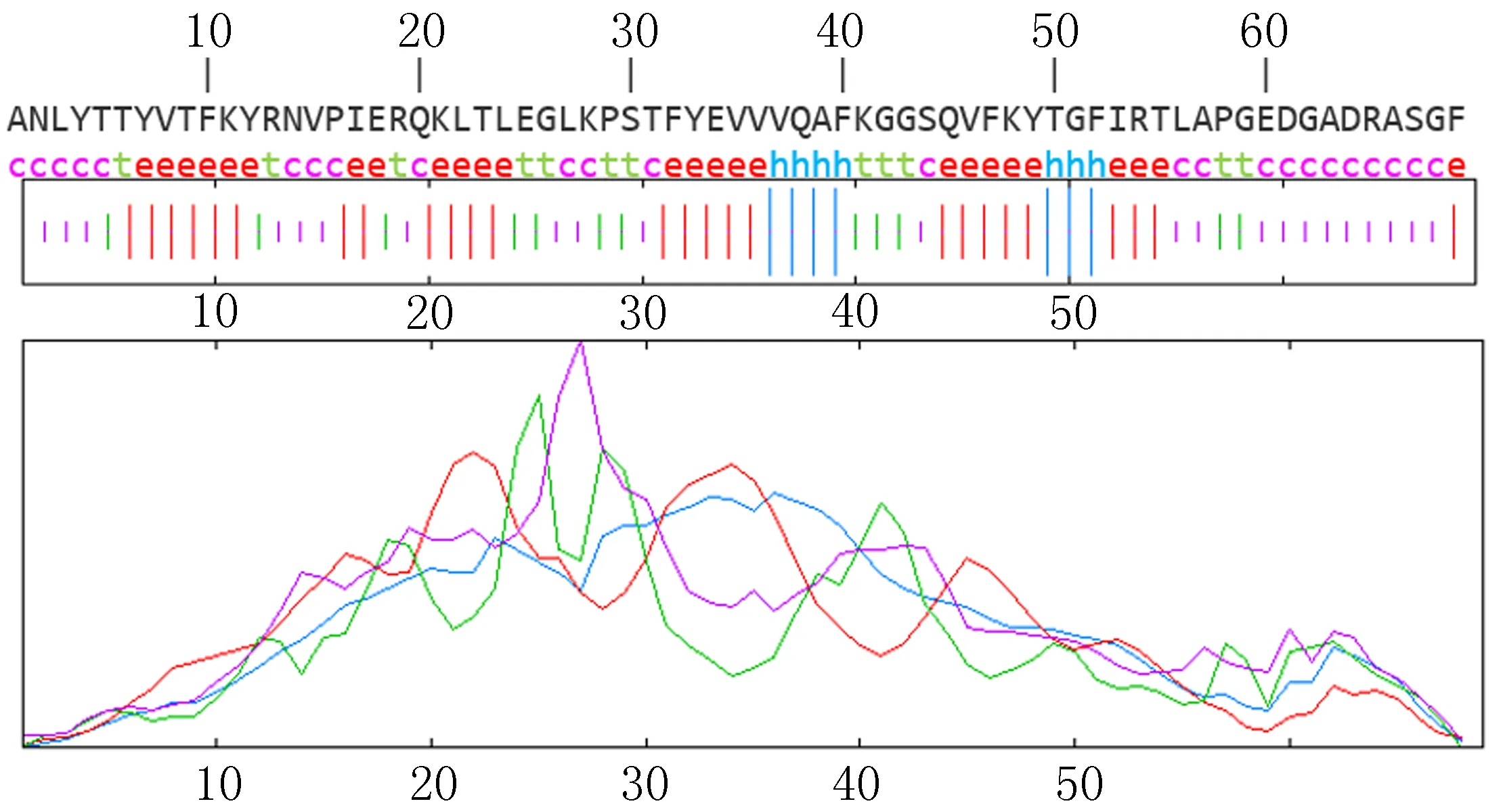
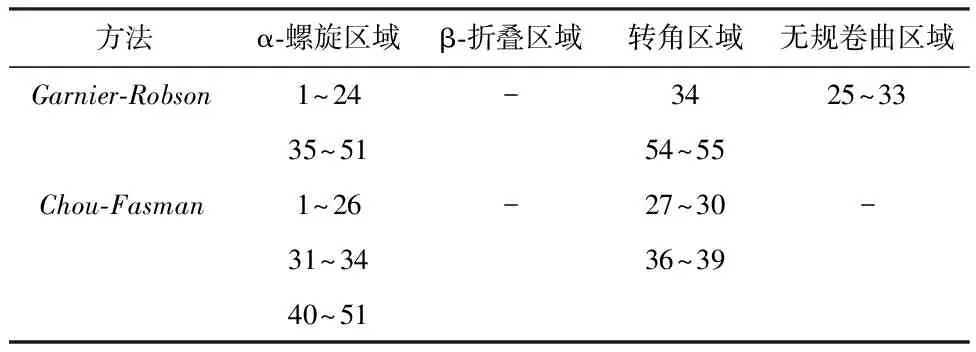
表1 DNAStar Protean预测egG1y162-1蛋白质二级结构
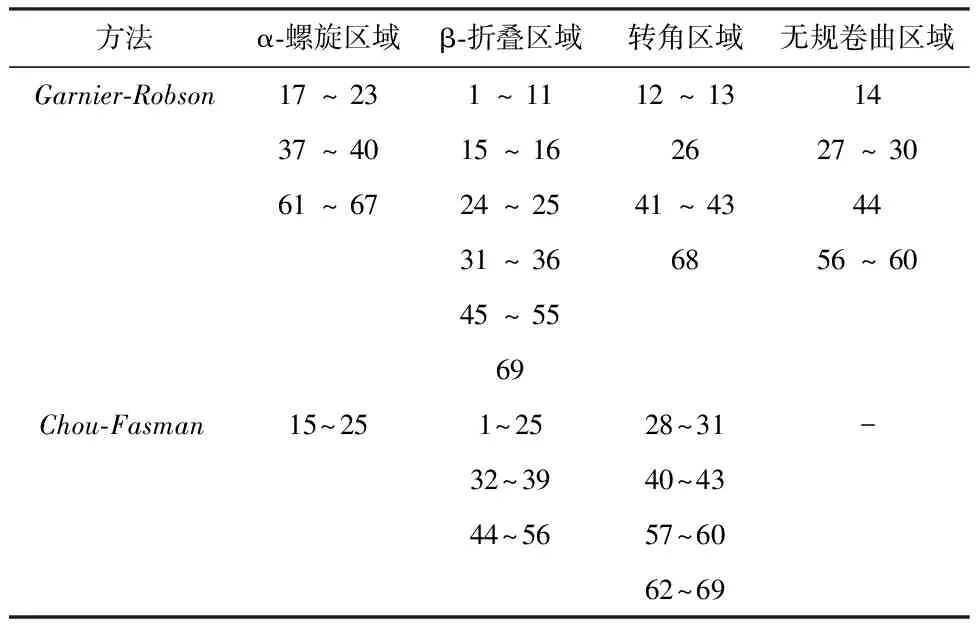
表2 DNAStar Protean预测egG1y162-2蛋白质二级结构

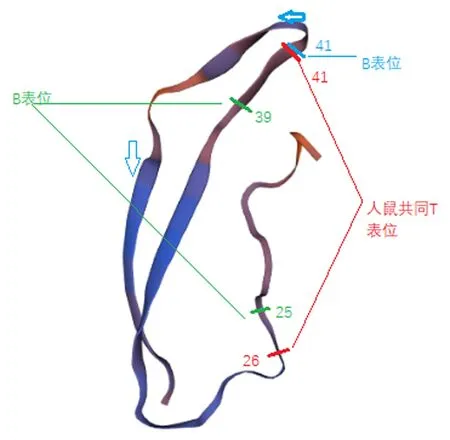
2.4egG1y162-1和egG1y162-2的三级结构运用Swiss-Model建立三维模型, 图5中模型显示的是egG1y162-1上5~38位氨基酸残基可能的空间结构,绿色线段标记的9~28位氨基酸残基为egG1y162-1的B表位,红色线段标记的29~36位氨基酸残基为egG1y162-1的人鼠共同T表位。图6中模型显示的是egG1y162-2上16~56位氨基酸残基可能的空间结构,绿色和蓝色线段分别标记的25~39位、41~60位氨基酸为egG1y162-2的B表位,红色线段标记的26~41位氨基酸残基为egG1y162-2的人鼠共同T表位。

2.5egG1y162-1和egG1y162-2的T细胞抗原表位运用在线软件SYFPEITHI、IEDB分别分析egG1y162-1和egG1y162-2上各自的人和鼠的T细胞抗原表位,选取SYFPEITHI上10个分值最高和IEDB上10个百分等级最低的结果进行比对,结果见表3。
根据各项结果,预测egG1y162-1上人的T表位为22~36位氨基酸残基(RWIHVGSRSLELGWN),鼠的T表位为29~43位氨基酸残基(RSLELGWNATGLANL);egG1y162-2上人的T表位为26~41位氨基酸残基(GLKPSTFYEVVVQAF)、46~60位氨基酸残基(VFKYTGFIRTLAPGE),鼠的T表位为16~30位氨基酸残基(PIERQKLTLEGLKPS)、31~45位氨基酸残基(TFYEVVVQAFKGGSQ)。
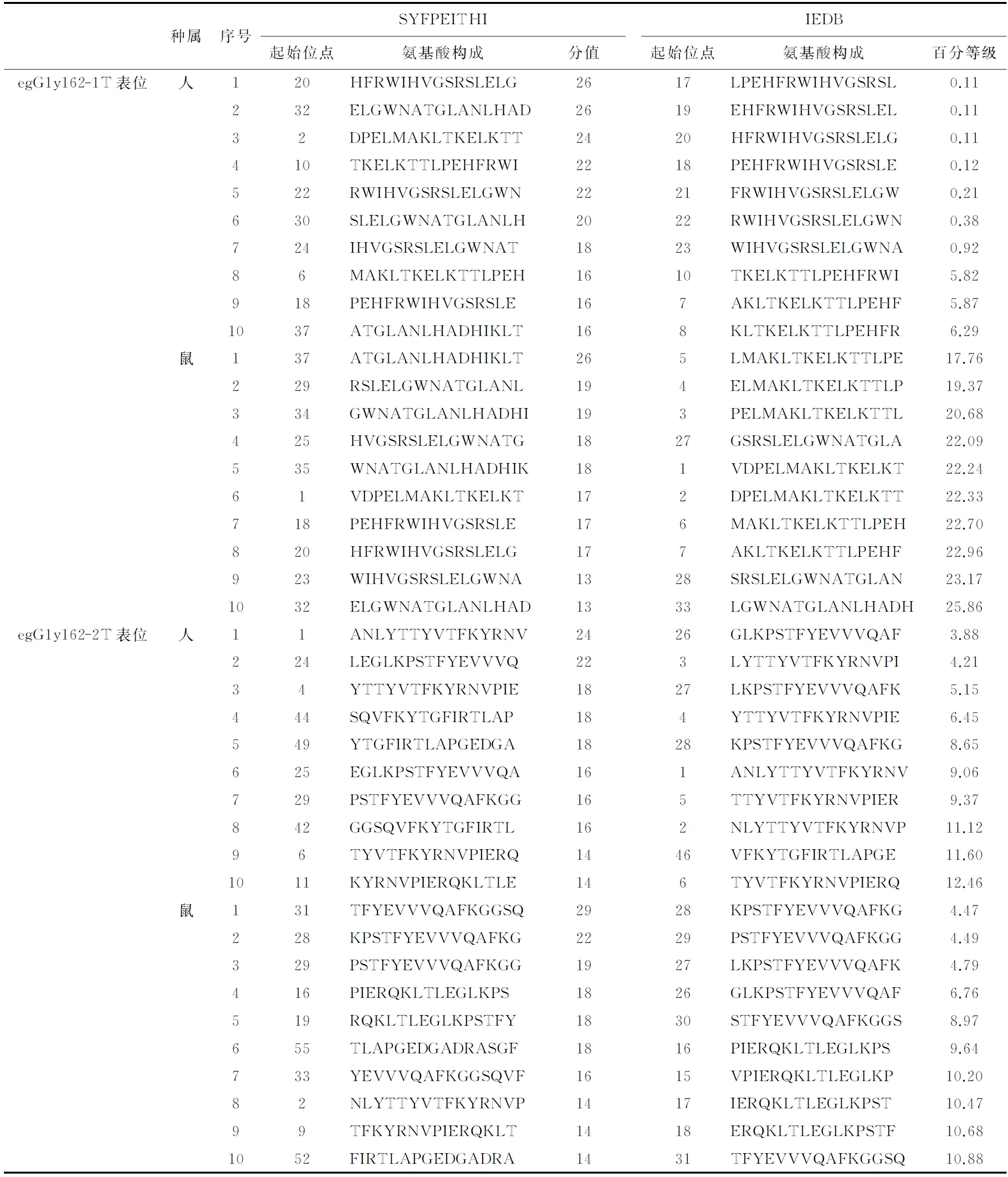
表3 SYFPEITHI、IEDB预测的egG1y162-1、egG1y162-2 T细胞表位
2.6egG1y162-1和egG1y162-2的B细胞抗原表位运用ABCpred、BCPred、BepiPred分析序列,结果见表4。
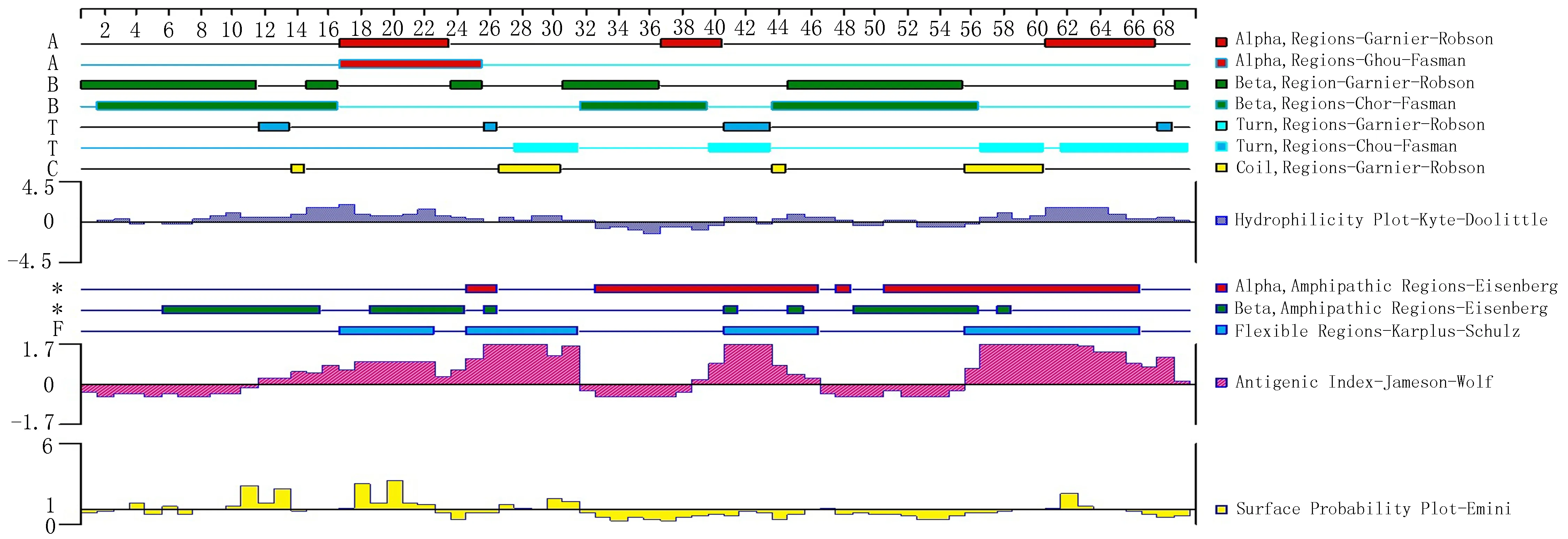
IEDB分析egG1y162-1和egG1y162-2结果,转角区域指数分别见图7-1、图7-2,亲水指数分别见图8-1、图8-2,骨架柔韧性分别见图9-1、图9-2,线性表位分别见图10-1、图10-2,表面可及性分别见图11-1、图11-2,抗原指数分别见图12-1、图12-2。图中分值(Score)在红线水平以上的黄色区域为易形成表位的区域,曲线越高表示相应指数越高。

表4 egG1y162-1、egG1y162-2的B细胞抗原表位预测
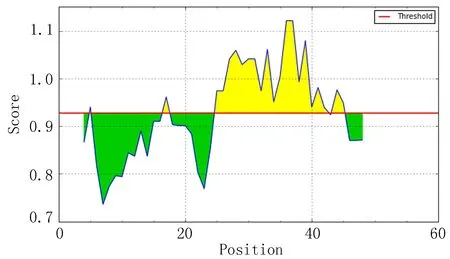
图7-1 egG1y162-1转角区域指数

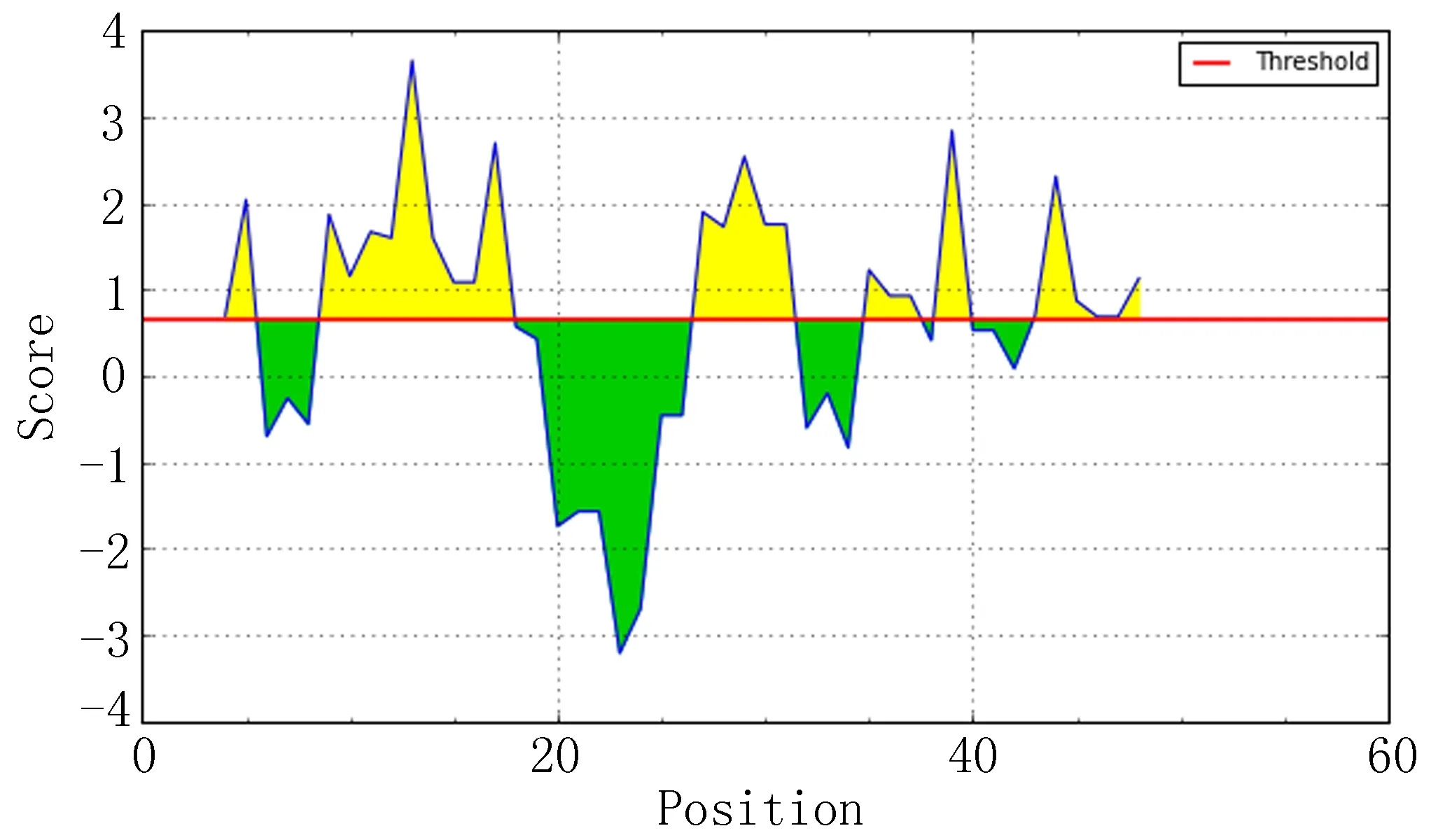
图8-1 egG1y162-1 亲水指数

图8-2 egG1y162-2亲水指数

图9-1 egG1y162-1 骨架柔韧性

图9-2 egG1y162-2 骨架柔韧性
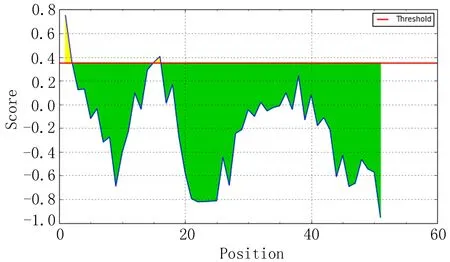
图10-1 egG1y162-1 线性表位
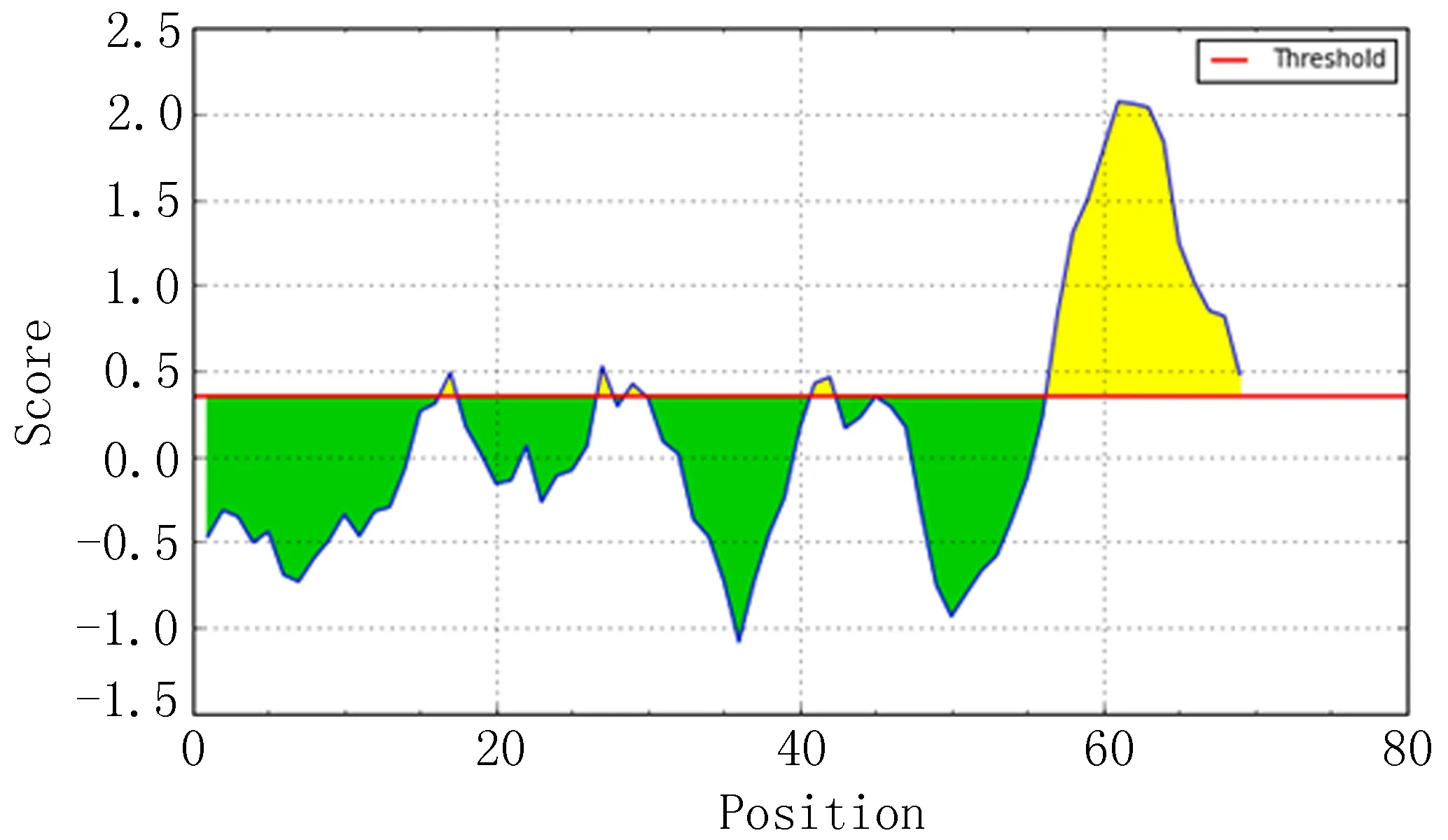
图10-2 egG1y162-2 线性表位
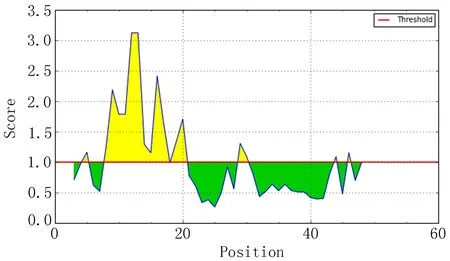
图11-1 egG1y162-1 表面可及性
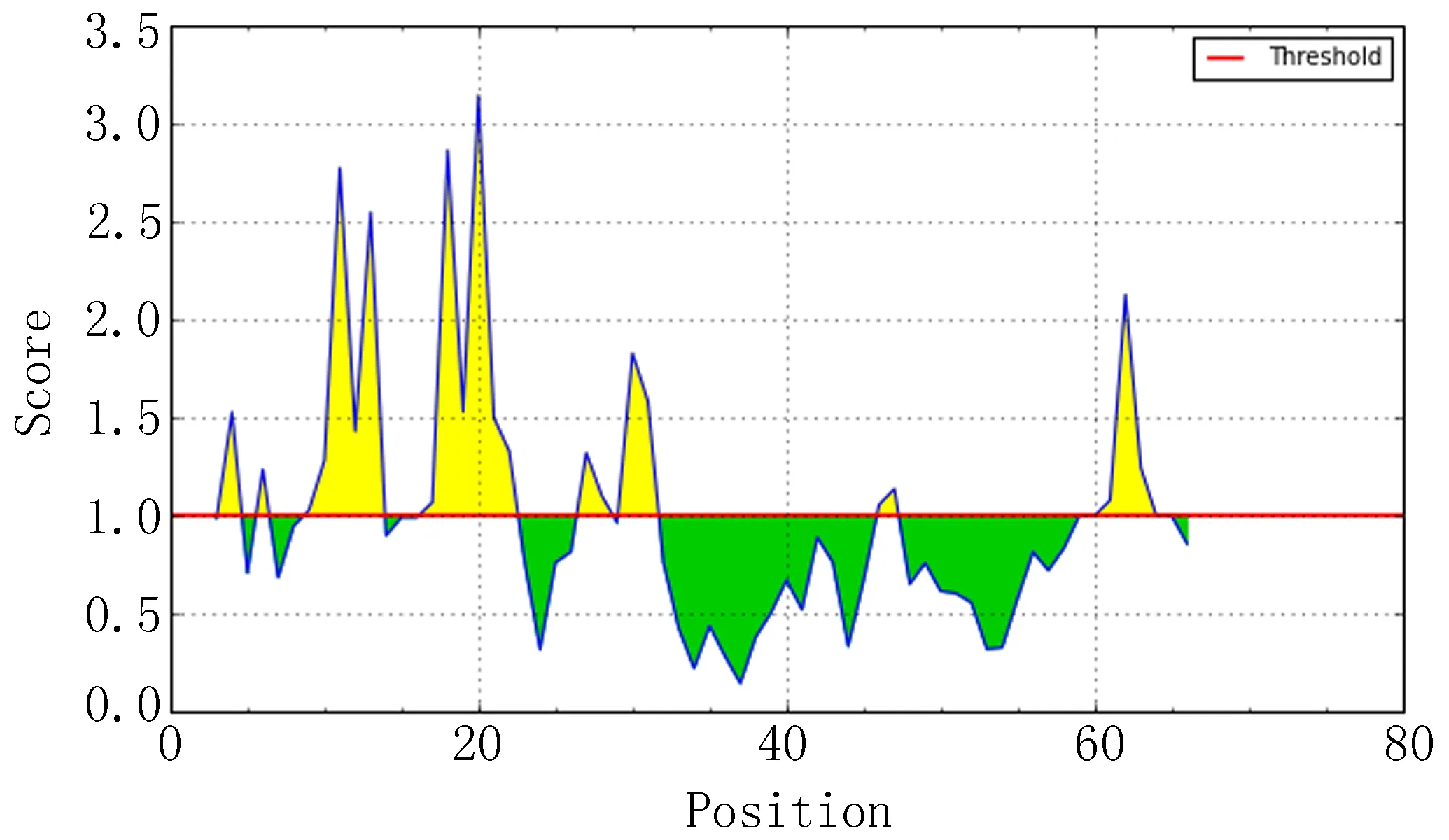
图11-2 egG1y162-2 表面可及性
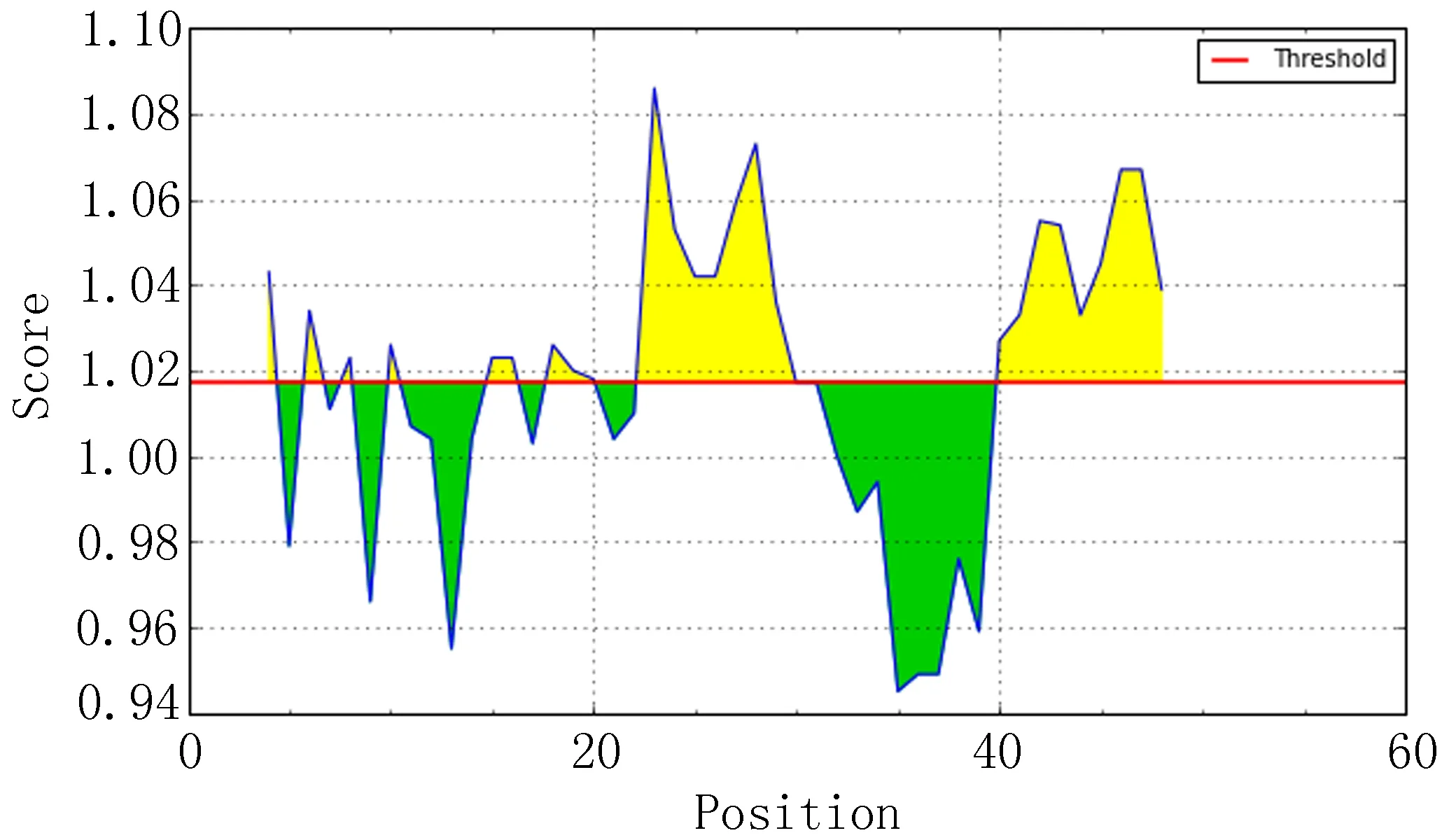
图12-1 egG1y162-1 抗原指数
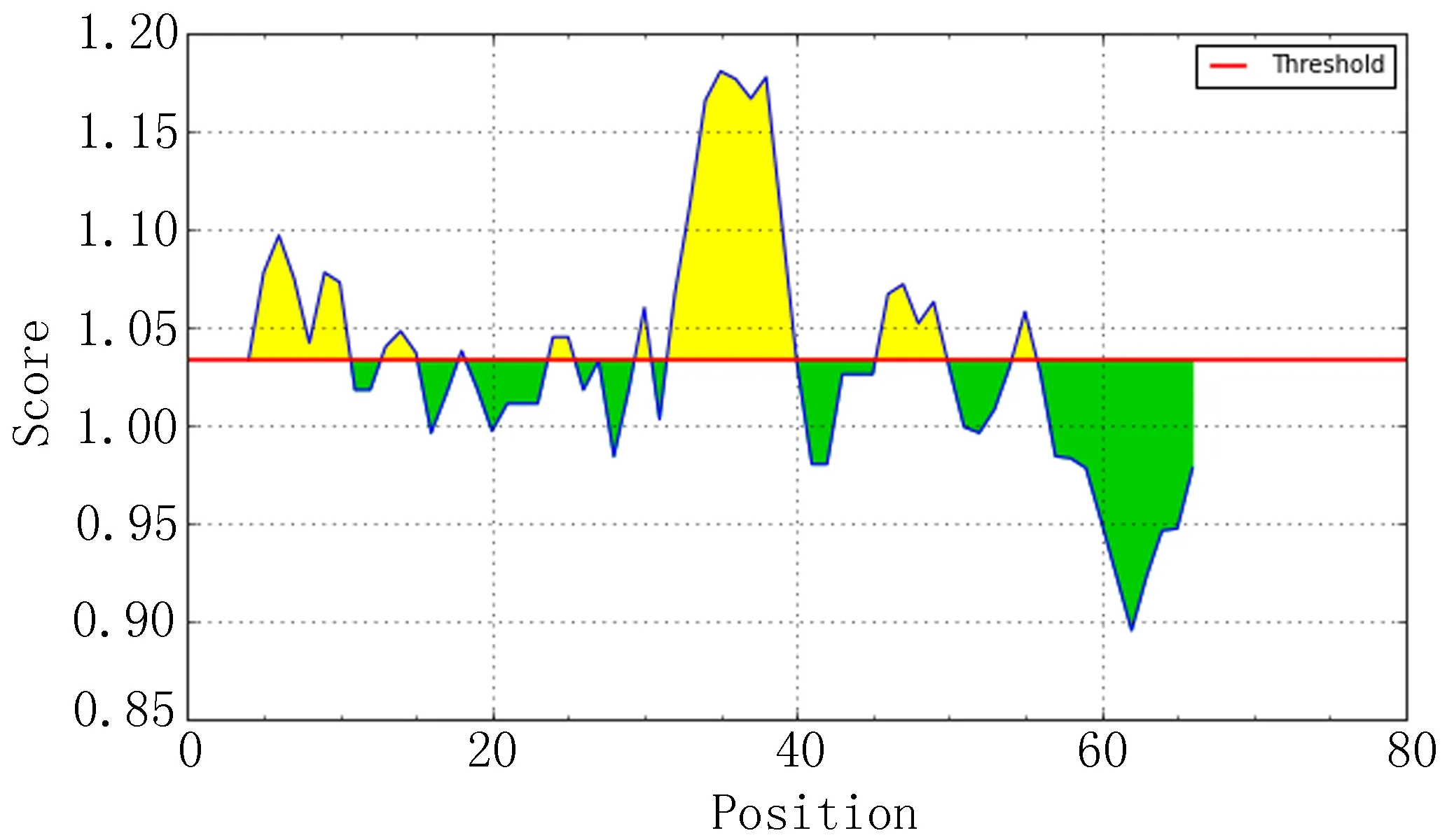
图12-2 egG1y162-2 抗原指数
ABCpred、BCPred、BepiPred分析结果显示,egG1y162-1、egG1y162-2分别有4个、9个指数较高的区段。结合IEDB各项结果,考虑egG1y162-1的B细胞抗原表位可能在15~16位氨基酸残基附近,可能的B细胞抗原表位为9~28位氨基酸残基(LTKELKTTLPEHFRWIHVGS);egG1y162-2的B细胞抗原表位可能在27、29、41~42位氨基酸残基附近,可能的B细胞抗原表位为25~39位氨基酸残基(EGLKPSTFYEVVVQAFKGGS)、41~60位氨基酸残基(KGGSQVFKYTGFIRTLAPGE)。
3 讨论
生物信息学分析技术是近几年的研究热点,科研工作者们使用多种分析软件进行预测和比对,将研究工作的重点从蛋白质一级结构的分析转为深入的预测和计算蛋白质的二级、三级结构。Zhang等[5-6]经过综合感染包虫病的人和犬血清的Western-blot反应结果,证明egG1y162-2的免疫反应远远强于egG1y162-1,前者的反应条带非常清晰,也证明了最初的设想,在含有T-B联合表位的三个区域中,egG1y162-2 上集中了两个经过预测的优势T-B联合抗原表位,具有比较强的免疫优势功能。本研究,通过多种生物信息学方法,对egG1y162-1和egG1y162-2蛋白质进行分析和预测。二者结果进行比对,可以发现,egG1y162-2在稳定性、亲水性等方面均优于egG1y162-1。运用ABCpred、BCPred、BepiPred分析预测B细胞抗原表位,结果显示egG1y162-2的优势B细胞表位多于egG1y162-1,再结合IEDB软件对蛋白质转角区域指数、表面可及性、骨架柔韧性指数、抗原性指数和亲水性指数进行分析(图7、8、9、10、11、12,1为egG1y162-1的结果,2为egG1y162-2的结果)。亲水性指数越高暴露于表面的几率越大,成为抗原表位的可能性越大。表面可及性越大,蛋白质抗原中氨基酸残基被溶剂分子接触的可能性就越大。而蛋白质骨架柔韧性越高,发生扭曲折叠的几率就越大。抗原性好的肽段,可能作为抗原表位[12]。综合各项结果,选取egG1y162-1的9~28位氨基酸(LTKELKTTLPEHFRWIHVGS)为egG1y162-1的优势B细胞表位,选取egG1y162-2的25~39位氨基酸(EGLKPSTFYEVVVQAFKGGS)、41~60位氨基酸(KGGSQVFKYTGFIRTLAPGE)为egG1y162-2的优势B细胞表位。运用SYFPEITHI、IEDB在线软件分析预测人类与鼠egG1y162-1、egG1y162-2的T细胞抗原表位,对SYFPEITHI分值最高的(分值越高,表示该序列成为优势表位的可能性越高)、IEDB百分等级最低(百分等级越低,表示该序列成为优势表位的可能性越高)的各选取10个结果进行比对,结合二级结构等结果,排除不易形成表位的结构,预测egG1y162-1上人的T表位为22~36位氨基酸(RWIHVGSRSLELGWN),鼠的T表位为29~43位氨基酸(RSLELGWNATGLANL);egG1y162-2上人的T表位为26~41位氨基酸(GLKPSTFYEVVVQAF)、46~60位氨基酸(VFKYTGFIRTLAPGE),鼠的T表位为16~30位氨基酸(PIERQKLTLEGLKPS)、31~45位氨基酸(TFYEVVVQAFKGGSQ)。人与鼠两者对比,egG1y162-1上29~36位氨基酸(RSLELGWN)区域可能存在人鼠共同T细胞抗原表位;egG1y162-2上26~41位氨基酸(GLKPSTFYEVVVQAFK)区域可能存在人鼠共同T细胞抗原表位。研究人鼠共同T细胞抗原表位,有助于在利用鼠做egG1y162疫苗试验时,验证相关疫苗在人体内产生保护免疫的可行性。
总之,egG1y162-1、egG1y162-2作为良好的疫苗的候选分子,均具有良好的抗原性和免疫原性,但egG1y162-2在各方面指标均优于egG1y162-1,EgG1Y162中较强特异性的优势抗原表位可能分布在EgG1Y162-2片段中。通过对egG1y162-1、egG1y162-2蛋白理化性质、二级结构、T表位及B表位的分析和预测,为精确地定位EgG1Y162抗原表位的氨基酸残基,构建高效的多表位疫苗奠定了基础。
