细粒棘球绦虫EgG1Y162-1/2重组蛋白诱导小鼠免疫应答特点的比较
2019-01-22李玉娇王红英张峰波庞楠楠丁剑冰
李玉娇, 王红英, 张峰波, 刘 斌, 杨 妍, 沙 桐, 庞楠楠, 丁剑冰,3
(新疆医科大学1第一附属医院, 乌鲁木齐 830054; 2基础医学院, 3省部共建中亚高发病成因与防治国家重点实验室, 乌鲁木齐 830011)
细粒棘球绦虫(Echinococcosis granulosus,Eg)慢性感染会造成宿主肝脏进行性的损害,该寄生虫以粪-口途径为主感染宿主[1-2],该病的主要传染源是犬类和狐狸等野生动物[3-4]。疫苗是预防包虫病最经济又有效的方式,保护性抗原的寻找成为研究的热点[5]。曹春宝等[6]首次克隆并扩增存在于细粒棘球蚴中的新基因EgG1Y162,该抗原基因已送登基因库(Genebank:AB462014)。经过蛋白免疫印迹实验显示,EgG1Y162重组抗原是一类有效的针对包虫的终末宿主-犬的疫苗。本实验室筛选的这一新的保护性抗原EgG1Y162,有自主使用权。马秀敏等[7]用BCG结合EgG1Y162进行重组构建也发现该疫苗具有比较好的免疫原性,能够激发机体的免疫反应。ZHANG等[8]运用生信学的方法对EgG1Y162抗原进行T-B联合表位的预测,定位了优势T-B联合表位的位置,根据其位置将该基因片段重组构建为EgG1Y162-1和EgG1Y162-2,本研究旨在进一步验证和对比这两段基因构建的重组蛋白的免疫应答的反应,为表位疫苗的研究奠定基础。
1 实验对象与方法
1.1实验对象
1.1.1 实验动物及包虫包囊 6~8周龄雌性SPF级的BALB/C小鼠,质量18~22 g,购自于新疆医科大学第一附属医院动物实验中心。包虫病患者的细粒棘球蚴包囊由新疆医科大学第一附属医院肝胆包虫外科提供。
1.1.2 仪器设备和相关试剂 酶标仪(美国BIO-RAD公司),流式细胞仪(美国BD公司),费氏完全佐剂(FCA)、费氏不完全佐剂(FIA)和刀豆蛋白A(ConA)(美国SIGMA公司),RPMI-1640(美国GIBCOBRL公司),FITC试剂盒(KGA108)(美国BD公司),pET-EgG1Y162-1和pET-EgG1Y162-2重组蛋白(本室制备并冻存,在-80℃保存备用)。
1.2方法
1.2.1 实验动物模型的建立 将实验小鼠60只随机平均分为5组,EgG1Y162-1组、EgG1Y162-2组、GST对照组、佐剂组和正常对照组,这5组小鼠分别注射pET32a-EgG1Y162-1重组蛋白+佐剂、pET32a-EgG1Y162-2重组蛋白+佐剂、谷胱甘肽巯基转移酶(GSTs)+佐剂、PBS+佐剂和生理盐水。注射小鼠的疫苗初始剂量均为100 μL(其中蛋白含量为50 μg),与佐剂1∶1混合后进行注射,在免疫的第1次用费氏完全佐剂(0周),后3次用费氏不完全佐剂(2、4、6周),生理盐水组直接注射即可。最后一次免疫后的2周对小鼠进行感染攻击,腹腔内注射活原头蚴数量约为2 000只的100 μL原头蚴液。
1.2.2 收集检测标本 四次免疫前后均通过小鼠眼内眦采血的方式采集血液100~150 μL,将离心后的血清20~25 μL冻存于-20℃冰箱内。原头蚴感染攻击小鼠后的第20周剖杀小鼠,摘眼球大量取血,并对小鼠内脏和腹腔内的囊性病灶进行称重并保存。
1.2.3 检测抗体滴度 用酶联免疫吸附试验(ELISA法)检测EgG1Y162-1组和EgG1Y162-2组小鼠抗体滴度的动态变化水平。用EgG1Y162-1和EgG1Y162-2重组蛋白分别包被96孔板在4℃条件下过夜。第2天用洗板液(PBS-Tween20)洗板3次,用样本稀释液将采集到的免疫后小鼠血清按照1∶100~1∶20 480的稀释梯度进行逐一稀释,每个标本设两个复孔,同时再单独设1个空白对照孔,1个阴性对照孔和1个阳性兔血清对照孔。该板在37℃条件下温育1 h,用洗板液洗板3次。用辣根过氧化物酶(HRP)羊抗小鼠IgG(浓度为1∶3 000)为二抗对96孔板进行37℃条件下孵育1 h,洗板3次。加显色液10 min后终止反应,用酶标仪(OD490 nm)测定各孔的吸光度值。
1.2.4 鉴定脾细胞亚群 无菌条件下取小鼠的脾脏研磨均匀,用RPMI-1640培养液调整为5×107/L浓度的悬液分装,EgG1Y162-1组、EgG1Y162-2、GST对照组、佐剂组和正常对照组五组各设置2个平行管,分别加入1 μL大鼠抗小鼠CD3、CD4单克隆抗体和大鼠抗小鼠CD3、CD8单克隆抗体,4℃避光孵育30 min,洗涤细胞3次后,用流式细胞仪检测CD4+T、CD8+T细胞亚群的百分比。
1.2.5 检测淋巴细胞增殖 无菌条件下制脾细胞悬液,将已调整好浓度的悬液加入96孔细胞培养板,将EgG1Y162-1组、EgG1Y162-2组、GST对照组、佐剂组和正常对照组5组细胞分别设置4个复孔,复孔中分别加入ConA刺激液和无刺激原液,pET32a-EgG1Y162-1和pET32a-EgG1Y162-2。ConA刺激液浓度为5 μg/mL,EgG1Y162-1、EgG1Y162-2的刺激浓度均为10 μg/mL。加样后将该板置于37℃ 5% CO2的条件下培养72 h,距离培养结束4 h前,每孔加入10 μL MTT(5 mg/mL),培养结束后在1 000 r/min条件下离心10 min,弃去上清,每孔分别加入100 μL二甲基亚砜(DMSO)置于低速振荡的摇床上,室温条件下摇10 min,待结晶物充分溶解后用酶标仪(OD570 nm)测定各孔的吸光度。
1.2.6 检测小鼠脾细胞凋亡率 取制备好浓度的脾细胞悬液加入96孔细胞培养板,分别设置为EgG1Y162-1组、EgG1Y162-2组、GST对照组、佐剂组和空白对照组,这5组各设置两个复孔分别加入浓度为10 μg/mL的ConA和无刺激的原液,在37℃,5%CO2的条件下培养20~24 h后收集脾细胞悬液,用流式细胞仪分析脾细胞凋亡率。
1.2.7 小鼠囊重抑制率的测定 在对小鼠感染攻击的20周后剖杀小鼠,分离5组小鼠腹腔和肝脏内的细粒棘球蚴囊性灶并进行称重,计算每组相应的囊重抑制率。免疫保护力计算公式:囊重抑制率=1-实验组平均包囊湿重/对照组平均包囊湿重×100%。

2 结果
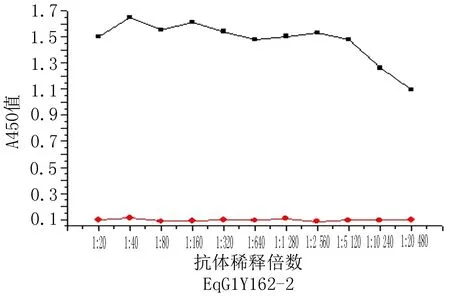
2.1小鼠抗体滴度动态变化的检测结果EgG1Y162-1组和EgG1Y162-2组血清抗体效价均逐步提高,在初次免疫后的第10周,EgG1Y162-1组的血清抗体效价值达到1∶5 120时开始下降,EgG1Y162-2组血清抗体滴度则达到1∶20 480开始下降。经过酶标仪对OD值的测定结果表明,GST对照组、佐剂组和正常对照组的OD值在同一滴度差异无统计学意义(P>0.05),但EgG1Y162-1组与佐剂组、GST对照组及正常对照组在1∶100~1∶5 120抗体稀释倍数上的差异有统计学意义(P<0.05),EgG1Y162-2组与佐剂组、GST对照组及正常对照组在1∶100~1∶20 480抗体稀释倍数上的差异有统计学意义(P<0.05)(图1)。

2.2CD4+T细胞亚群的动态变化检测结果显示,EgG1Y162-1组、EgG1Y162-2组在免疫后均有CD4+T细胞不同程度的升高,明显观察到EgG1Y162-2组在免疫2周后持续进行性的增高,到第6周达到最高水平,而EgG1Y162-1组也在免疫后的第2周开始逐渐增高,并于第6周时达到最高水平,且CD4+T细胞亚群比例明显低于EgG1Y162-2组。在免疫第8周后的原头蚴攻击感染之后,CD4+T细胞亚群随着时间的延长开始逐步降低。GST对照组、佐剂组也在免疫后2周开始升高,但CD4+T细胞亚群变化幅度很小,而正常对照组基本没有变化。统计学分析显示,经过免疫和包虫感染攻击,EgG1Y162-1/2组与GST对照组、佐剂组与正常对照组比较差异有统计学意义(P<0.05),GST对照组、佐剂组和正常对照组比较差异无统计学意义(P>0.05)(图2)。
2.3CD8+T细胞亚群的动态变化经流式细胞仪检测EgG1Y162-1组、EgG1Y162-2组在免疫后均有CD8+T细胞的改变,EgG1Y162-2组在蛋白免疫2周后出现持续进行性增高,到第8周时达到最高水平,而EgG1Y162-1组也在免疫后的第2周开始逐渐增高,并于第6周时达到最高水平,与CD4+T细胞变化规律相似:EgG1Y162-2组的CD8+T细胞亚群数量也明显增高。在免疫第8周后的原头蚴攻击感染后,CD8+T细胞亚群随着时间的增长开始逐步降低。GST对照组、佐剂组也在免疫后2周开始升高,但CD8+T细胞亚群比例波动较小,正常对照组基本数值没变化。统计学分析显示,经过蛋白免疫和原头蚴的感染攻击,EgG1Y162-1/2组与GST对照组、佐剂组比较有统计学意义(P<0.05),GST对照组、佐剂组和生理盐水对照组差异无统计学意义(P>0.05)(图3)。
2.4脾细胞CD4+T/CD8+T细胞亚群比值的动态变化EgG1Y162-1组的CD4+T/CD8+T细胞比值在免疫后2周时开始升高,第10周达到峰值后降低。EgG1Y162-2组的CD4+T/CD8+T细胞比值也在免疫后2周时开始升高,第10周达到峰值后降低,但比值明显高于EgG1Y162-1组。CD4+T/CD8+T细胞亚群比值在2周时逐步升高,第4周达到峰值。统计学分析结果显示,EgG1Y162-1/2组与GST对照组、佐剂组和正常对照组比较均无统计学意义(P>0.05)(图4)。


2.5MTT法检测小鼠脾淋巴细胞增殖情况刀豆蛋白ConA刺激5组小鼠脾淋巴细胞后,与无刺激物刺激相比发生了显著增殖,前期分为5组的小鼠脾淋巴细胞均在刀豆蛋白ConA的刺激下产生增殖能力。用EgG1Y162-1和EgG1Y162-2重组蛋白抗原刺激各组小鼠脾淋巴细胞后,EgG1Y162-1组和EgG1Y162-2组与GST对照组、佐剂组和正常对照组的差异性具有统计学意义(P<0.05),而GST组、佐剂组和正常对照组之间的差异性无统计学意义(P>0.05),提示EgG1Y162-1和EgG1Y162-2免疫的小鼠脾淋巴细胞在体外能被该抗原特异性刺激增生,诱导细胞免疫的产生(表1)。
2.6小鼠脾细胞凋亡率结果EgG1Y162-1组和EgG1Y162-2组小鼠脾细胞原液组和ConA刺激组脾细胞凋亡率均明显低于GST对照组、佐剂组和正常对照组,差异有显著的统计学意义(P<0.01),GST组和佐剂组的脾细胞凋亡率也低于正常对照组,差异有显著统计学意义(P<0.01),且每组中ConA刺激组脾细胞凋亡率都对应高于同组脾细胞原液凋亡率(P<0.01)(表2)。

表1 小鼠脾淋巴细胞增殖试验结果(OD490 nm, ±s)
注:与对照组比较,*P<0.05。

表2 EgG1Y162-1/2重组蛋白免疫小鼠后脾细胞凋亡率(%, ±s)
注:与对照组比较,*P<0.01。
2.7疫苗对小鼠的免疫保护作用经过对剖杀5组小鼠后体内的细粒棘球蚴包囊进行称重后,计算的囊重抑制率显示EgG1Y162-1组与EgG1Y162-2组小鼠囊重抑制率分别为58.10%和64.10%,与正常对照组相比,差异有统计学意义(P<0.05)。GST组与佐剂组小鼠囊重抑制率为7.54%和8.16%,和正常对照组相比,差异无统计学意义(P>0.05)(表3)。

表3 免疫小鼠的原头蚴攻击实验减囊率比较
注: 与对照组比较,*P<0.05。
3 讨论
新疆是地处偏远的畜牧业大省,包虫病高发对地区经济和牧民的生活都造成了重大的影响[9]。本课题组[10]在前期克隆和扩增EgG1Y162基因时,就对EgG1Y162重组蛋白进行生物信息学分析,发现该抗原上分布有优势的线性T细胞表位和构象性表位B细胞表位[11-12]。理论上认为含表位丰富的抗原具有较强的免疫原性,本研究旨在验证生物信息学预测的优势表位区域所在的抗原是否在免疫应答中也具有更强的免疫反应。
根据Zhang等[8]的研究,EgG1Y162重组蛋白具有优势的T-B联合表位位于6~19、64~82,106~119三段氨基酸位点区域,根据该预测结果将EgG1Y162基因截短为2段,分别命名EgG1Y162-1和EgG1Y162-2,其中EgG1Y162-1具有1个T-B联合优势表位,即6~19氨基酸片段。而EgG1Y162-2上有2个T-B联合优势表位64~82、106~119。表位是位于抗原上的柔性氨基酸片段,正是这些片段的存在,能够高效的和抗体结合,激活T细胞的免疫应答反应,诱导机体的免疫反应。本研究在免疫小鼠的过程中发现EgG1Y162-2诱导小鼠体内产生更高的抗体效价,说明机体在抗原的刺激下产生了更强的免疫应答反应。本研究在用流式细胞仪检测小鼠CD4+T和CD8+T细胞亚群的百分比中发现,EgG1Y162-2的T辅助细胞/T抑制细胞的比值明显高于EgG1Y162-1,说明T辅助细胞的活性在该抗原的刺激下增强了,进一步的MTT实验的原理是通过脾淋巴细胞增殖能力的强弱反映机体免疫应答的强弱[13]。为了解这两段重组蛋白疫苗对机体细胞免疫调节的作用[14-15],本研究开展了该项实验,检测结果显示EgG1Y162-1/2抗原都能特异刺激脾淋巴细胞增殖,说明这两段重组蛋白抗原均能直接被免疫细胞识别并引起免疫应答,但通过统计数据发现EgG1Y162-2比EgG1Y162-1具有更强的刺激脾淋巴细胞增殖的能力。脾细胞凋亡率实验中EgG1Y162-2减少了脾细胞凋亡的产生,这一系列的实验均证明EgG1Y162-2这个包含了2个预测后的T-B细胞优势表位的重组蛋白激发小鼠产生了较强的免疫应答,在激活机体产生免疫反应的过程中,EgG1Y162-2具有更优势的免疫作用。本实验为了进一步验证抗原的免疫保护作用,将免疫后的小鼠进行Eg的感染,在最终的囊重抑制率计算中发现2组有差别,EgG1Y162-2的囊重抑制率要高于EgG1Y162-1,这个结果与本研究最初的预测结果相符。说明该抗原进入小鼠体内后高效地与抗体结合,诱导了较强的免疫应答,在后期遇到大量的包虫感染后,能够及时的产生免疫保护作用,对Eg包囊的寄生和进行性发展起到了抑制作用。
生物信息学的预测是近年来的热门方向[16-17],研究者们一直采用各种分析方法来证明结果的可靠性,本实验基于前期生物信息学分析的基础上对其进行了相关的验证[18-20],结果表明符合生物信息学预测的结果。在今后的科研工作中,合理地运用生物信息学的分析不仅能节约大量的实验经费,还能更加便捷准确地筛选出所需的多肽,让研究者们把更多的时间和精力用在后期对表位肽深入的医学研究中,进一步明确免疫应答特异性和免疫保护作用。本研究结合了生物信息学的分析,不仅缩短了寻找高效保护性的疫苗抗原的时间,还提高了确定候选分子的准确度,为进一步优质疫苗的研制奠定了基础。
