富血小板纤维蛋白对人牙髓干细胞增殖、凋亡及碱性磷酸酶活性的影响
2019-01-18项海东田松波陈惠珍
项海东,田松波,陈惠珍
(河北医科大学第二医院 口腔内科,河北 石家庄 050000)
牙髓干细胞(dental pulp stem cells, DPSCs)来自于成年机体的牙髓组织,是具有多向分化潜能和自我更新的未分化细胞。正常情况下,DPSCs处于静息状态,维持牙髓中细胞的功能及新旧交替的稳态,当牙髓中的成牙本质细胞受到损伤后,DPSCs可参与牙髓的修复与重建。因此,DPSCs被认为是影响牙髓牙本质复合体形成的理想种子细胞[1-2]。目前已发现多种在体内及体外影响DPSCs增殖及分化的因素。富血小板纤维蛋白(platelet-rich fibrin, PRF)是新一代的血小板浓缩制品,富含血管内皮生长因子、血小板衍生生长因子、转化生长因子等多种生长因子,这些因子可构成强大的组织修复功能调节系统,目前已被应用于基础细胞的研究[3-4]。但PRF对DPSCs的影响及机制尚不清楚。因此,本研究旨在探讨PRF对DPSCs的增殖、分化、凋亡的影响及机制,以期为牙髓再生带来新的契机。
1 资料与方法
1.1 主要试剂和仪器
DMEM培养基、胰蛋白酶、胎牛血清均购自美国Gibco公司,磷酸盐缓冲溶液(PBS)、青链霉素购自美国Sigma公司,二喹啉甲酸(bicinchoninic acid,BCA)试剂盒、细胞计数试剂盒(cell counting Kit-8,CCK8)、膜联蛋白V(Annexin V)-异硫/碘化丙锭(propidium iodide, PI)凋亡试剂盒均购自中国碧云天生物技术研究所,活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved cysteinyl aspartate specific proteinase 3, Cleaved Caspase-3)、p38、p-p38单克隆抗体及辣根过氧化物标记的二抗均购自美国abcam公司,实时定量聚合酶链反应(RT-PCR)试剂盒、逆转录试剂盒购自日本TaKaRa公司,Trizol购自美国Invitrogen公司。RT-PCR仪购自美国Applied Biosystems公司,CO2细胞培养箱购自美国SIM公司,倒置显微镜购自日本Olympus公司,酶标仪、电泳凝胶图像分析系统、聚丙烯酰胺凝胶电泳仪均购自美国Bio-Rad公司。
1.2 人牙髓干细胞(hDPSCs)的分离培养
收集河北医科大学第二医院口腔科志愿者(16~25岁)阻生第3磨牙,即刻放入预冷及加入青链霉素双抗的α-MEM培养基中培养保存。无菌条件下取出牙髓组织,用0.01 mol/L的PBS清洗2次,小剪刀将牙髓组织剪成1~2 mm的小组织块,按照1∶1比例加入0.4%的分散酶和0.3%的Ⅰ型胶原酶,37℃消化1 h,轻轻吹打离散单细胞团块,过70 μm的细胞筛网,1 000 r/min离心5 min,0.01 mol/L的PBS清洗1遍。细胞沉淀用高糖DMEM培养基(含20%的胎牛血清)重悬,以1×105个/ml密度接种于细胞培养瓶中,置于37℃,5% CO2,95%饱和湿度的培养箱中培养。每3天换液1次,细胞生长密度达到80%~90%时,用2.5 g/L的胰蛋白酶消化后传代。收集生长至对数期的第2代hDPSCs进行纯化后再用于后续的实验研究。
1.3 PRF的制备
血液来自河北医科大学第二医院口腔科10例健康的志愿者,平均26岁(22~28岁),均签署知情同意书。无菌条件下每个志愿者抽取5 ml静脉血于真空管中,3 000 r/min离心10 min,静置数分钟后,弃去上清,收集中间层(中间层为PRF),将PRF凝胶与试管底部的红细胞分离出来,所获得的PRF膜用来制备渗出液。将PRF膜放置在预先盛有2 ml/孔的DMEM培养基的6孔板中,1孔/板,培养板置于孵育箱中继续孵育,4℃放置7 d后收集6孔板中的培养液,3 000 r/min离心15 min以沉淀红血细胞,然后使用0.22 μm的无菌滤器过滤除菌。将收集的PRF浸出液分装,置于-80℃冰箱冷冻保存备用。
1.4 细胞增殖检测
hDPSCs随机分为对照组及实验组。将第3代hDPSCs以1×104个/孔接种于6孔细胞培养板中,37℃,5% CO2,95%饱和湿度的培养箱中培养。培养第1、3、5及7天时,每孔细胞中加入10 μl的CCK-8溶液,置于37℃,5% CO2培养箱孵育2 h,酶标仪在490 nm波长处测定并记录各组的光密度(OD)值。计算细胞存活率,细胞存活率=(实验组A/对照组A)×100%。
1.5 碱性磷酸酶(ALP)活性检测
hDPSCs随机分为对照组及实验组。每组设置第 0、3、7、14天4个时间点。以2×104个/ml的密度将生长至对数期的第4代hDPSCs的单细胞悬液接种于6孔细胞培养板中,置于37℃,5% CO2培养箱中培养至相应时间后,用Trizol法提取细胞中的总RNA,以逆转录试剂盒将总RNA逆转录为cDNA,以GAPDH作为内参,RT-PCR检测ALP的mRNA表达。ALP引物序列:正向:5'-GGCTGGA GATGGACAAGTTC-3',反向:5'-CTCGTTTCCCTGAGT CGTGT-3';GAPDH引物序列:正向:5'-AAGAGTGGG TTTAAGTGGAAGGCT-3',反向:5'-GAAGATGGTGAT GGGATTTC-3'。PCR反应参数:A,预变性 95℃10 min;B,变性95℃ 10 s;退火60℃ 15 s,延伸72℃ 20 s,共40个循环;C,72℃ 15 min。4℃终止反应。每个样品设置3个重复,取均值采用2-△△Ct法对数据进行相对定量分析。
1.6 细胞凋亡检测
收集按照上述分组培养第7天的细胞,预冷的PBS及结合缓冲液各洗涤细胞1次后,离心弃上清,加入400 μl的结合缓冲液重悬细胞,细胞沉淀加入5 μl的PI和Annexin-V-FITC,充分混匀后置于室温下避光孵育10~15 min,离心沉淀细胞,缓冲液洗涤细胞1次,流式细胞仪检测细胞凋亡情况。
1.7 Western blotting检 测 Cleaved Caspase-3、p38、p-p38蛋白表达
收集按照上述分组培养第7天的细胞,按照细胞蛋白提取试剂盒提取细胞中的蛋白,BCA试剂盒检测提取的蛋白质量。将蛋白样品与上样缓冲液等量混匀后置于100℃变性10 min,依次进行聚丙烯酰氨凝胶电泳(SDS-PAGE)分离、转膜、封闭、一抗孵育Cleaved Caspase-3、p38、p-p38 1∶400稀释,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH),1∶1 000稀释、二抗孵育辣根过氧化物酶标记的羊抗鼠IgG,1∶1 000稀释,37℃孵育1 h,洗膜3次,ECL发光剂显影,自动凝胶成像系统采集图像。以GAPDH作为内参,分析Cleaved Caspase-3、p38、p-p38的蛋白表达水平。
1.8 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验,两组多时间点的比较采用重复测量设计的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 PFR对hDPSCs增殖的影响
对照组在第0、1、3、5及7天的OD值分别为(0.18±0.04)、(0.25±0.06)、(0.36±0.07)、(0.48±0.08)、(0.63±0.09),实验组在第 0、1、3、5 及 7 天的 OD 值分别为(0.20±0.05)、(0.28±0.07)、(0.59±0.08)、(0.73±0.09)、(0.90±0.08)。对照组与PRF组第0、1、3、5及7天的OD值比较,采用重复测量设计的方差分析,结果:①不同时间点的OD值有差异(F=13.243,P=0.000);②对照组与PRF组OD值有差异(F=17.276,P=0.000);③对照组与PRF组OD值变化趋势有差异(F=19.417,P=0.000)。见图1。

图1 PFR对hDPSCs增殖的影响 (±s)
2.2 PFR对hDPSCs矿化相关基因ALP表达的影响
对照组在第0、3、7及14天ALP mRNA表达分别为(0.883±0.112)、(1.231±0.163)、(1.624±0.152)、(1.913±0.164),实验组分别为(0.925±0.144)、(1.284±0.192)、(2.422±0.321)、(2.695±0.371),两组第 0、3、7及14天ALP mRNA表达比较,采用重复测量设计的方差分析,结果:①不同时间点间ALP mRNA表达有差异(F=17.191,P=0.000);②两组ALP mRNA表达有差异(F=19.841,P=0.000);③两组ALP mRNA表达变化趋势有差异(F=18.358,P=0.000)。见图2。

图2 PFR对hDPSCs的ALP mRNA表达的影响 (±s)
2.3 PFR对hDPSCs凋亡的影响
实验组细胞的凋亡率(4.18±0.67)%较对照组(13.21±1.02)% 下降(t=12.816,P=0.000)。见图 3。

图3 PFR对hDPSCs凋亡的影响
2.4 PFR对Cleaved Caspase-3、p38、p-p38蛋白表达的影响
对照组Cleaved Caspase-3、p38、p-p38的蛋白表达分别为(0.162±0.023)、(0.668±0.046)、(0.041±0.016),实验组Cleaved Caspase-3、p38、p-p38的蛋白表达分别为(0.063±0.016)、(0.681±0.051)、(0.174±0.019),实验组Cleaved Caspase-3蛋白表达较对照组下调(t=0.120,P=0.004)、p-p38蛋白表达上调(t=9.274,P=0.001),p38蛋白在两组间比较差异无统计学意义(t=0.328,P=0.760)。见图 4。

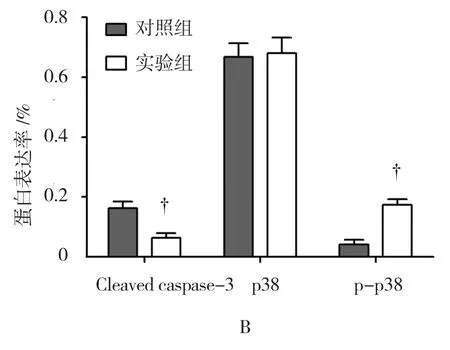
图4 PFR对Cleaved Caspase-3、p38、p-p38蛋白表达的影响
3 讨论
近些年来,利用干细胞治疗已成为再生医学研究的热点[5]。干细胞可分为成体干细胞和胚胎干细胞。DPSCs是成体干细胞的一员,可分化为脂肪干细胞和神经干细胞,也可形成牙本质牙髓细胞。牙本质牙髓细胞是未来牙形成的第一步,这也说明DPSCs在活髓的保存及治疗中有临床应用价值及潜在的优势[5]。PRF是继富血小板血浆(platelet rich plasma, PRP)后的新一代血小板浓缩制品,富含纤维蛋白原、多种生长因子及高浓度的血小板,可诱导内皮细胞、成骨细胞等的增殖、分化等过程[6]。研究显示,PRF可在体外促进牙槽骨成骨细胞的增殖及分化,可以不同的方式促进犬DPSCs的增殖及分化[7-8]。ALP是一种磷酸单酯水解酶,是成骨细胞成熟的早期标志物之一,参与骨的形成及代谢过程,其活性的增强是DPSCs向成牙本质细胞分化的早期标志[9]。本研究结果显示,PRF可促进DPSCs的增殖和分化。
细胞凋亡过程受到Caspase家族的调控,Caspase-3是Caspase家族的一员,是细胞凋亡通路中关键性的活化酶,处在Caspase级联反应的下游,其激活可导致细胞的凋亡[10]。研究显示,Caspase-3的激活可引起DPSCs的凋亡[11]。本研究结果显示,PRF可抑制DPSCs的凋亡及下调Cleaved Caspase-3蛋白表达。
丝裂原活性蛋白激酶(mitogen-activated protein kinases, MAPKs)属于丝蛋白/苏氨酸激酶,参与细胞的增殖及死亡、基因表达调控等过程,在多种信号的传递过程中有重要作用[12]。p38 MAPK信号通路是MAPK信号通路家族中重要一员,参与牙髓干细胞向成牙本质细胞分化等过程[13]。研究显示,阿司匹林可通过抑制p38 MAPK信号通路抑制DPSCs的增殖及分化[14]。p38 MAPK信号通路抑制剂可抑制ALP的活性和成牙本质样细胞的分化,在初期牙本质及第3期反应性牙本质形成过程中,可发现p38 MAPK信号通路的激活[15]。本研究结果显示,PRF可上调p-p38蛋白的表达。
综上所述,PRF可通过激活p38信号通路促进hDPSCs的增殖,上调ALP mRNA表达,抑制其凋亡。该研究为牙髓损伤修复及再生带来了新的思路。
