肝癌中骨形态发生蛋白7表达及其与生存相关性分析*
2019-01-18李锴宋燕州李伟
李锴,宋燕州,李伟
(江苏省连云港市第一人民医院 普通外科,江苏 连云港 222000)
世界范围内的肝细胞肝癌发生率逐年增加,已经成为肿瘤死亡的第3位[1]。大多数肝癌患者的预后非常差,每年新诊断患者数接近每年死亡的数量[2]。这一可怕局面源于缺乏早期诊断、大多数可发展为肝癌的肝硬化恶化以及肝癌化疗的高耐药性[3]。转化生长因子(transforming growth factor, TGF)在肝纤维化及肝硬化中起到重要作用,作为超家族成员中最大的一族,骨形态发生蛋白(bone morphogenetic protein, BMP)具有抗纤维化作用,在细胞的增殖、分化及凋亡中扮演着重要的角色。既往已经在体外经过分子、细胞水平验证BMP-7在肝癌相关细胞中发挥促生成作用[4-5],但BMP-7在肝癌组织中的表达及其与患者预后的关系尚未见诸报导,本研究旨在揭示BMP-7在不同肝脏组织中的表达,并探究其与肝癌患者预后的关系,为进一步研究肝癌发生、发展的分子生物学机制打下基础。
1 资料与方法
1.1 试剂与仪器
兔抗人多克隆BMP-7抗体(美国Proteintech公司),DAB显色试剂盒、磷酸盐缓冲生理盐水(PBS)、即用型免疫组织化学EliVision plus试剂盒(武汉博士德生物工程有限公司),SYBR PCR试剂盒(日本TaKaRa生物工程公司)。UV分光光度计(上海精密仪器仪表有限公司)。
1.2 方法
1.2.1 实验资料 于连云港市第一人民医院生物标本库中取得2010年1月—2013年12月间手术切除的肝癌组织85例及20例癌旁组织标本(距肿瘤边缘1 cm),以肝血管瘤及肝脏外伤患者14例手术标本作为良性对照。上述组织术后均经病理检测证实其诊断。
1.2.2 免疫组织化学检测 按说明书基本操作流程操作,BMP-7一抗加入PBS稀释浓度为1∶200,BMP-7二抗用PBS稀释为1∶6。
1.2.3 肝脏组织总RNA的提取、RNA逆转录、实时逆转录聚合酶链反应 依据说明书逐步提取肝脏组织总RNA,通过UV分光光度计检测在260和280 nm波长处的吸光度后置入-80℃冰箱冷冻保存。根据逆转录试剂盒说明书,将1 μg RNA逆转录为cDNA(20 μl逆转录反应体系)。实时逆转录聚合酶链反应(real-time reverse transcription-polymerase chain reaction, real-time RT-PCR),以β-actin作为内参,25 μl反应体系(包括逆转录产物1 μl,2×PCR反应mix 12.5 μl,正向引物 1 μl,反向引物 1 μl,dH2O 9.5 μl),反应条件 :95℃预变性5 min,95℃变性10 s,60℃退火及延伸30 s,共持续35个循环。
1.3 肝癌组织、癌旁组织及非癌肝脏组织BMP-7免疫组织化学检测
对应生物标本库中所取患者信息,选取相应肝癌组织石蜡标本、癌旁组织石蜡标本及非癌肝脏组织石蜡标本,上述组织术后均经病理检测证实其诊断。对肝癌组织、癌旁组织及非癌肝脏组织BMP-7进行免疫组织化学检测,石蜡切片脱蜡、水化、微波抗原修复,3%过氧化氢除去内源性过氧化物酶,BMP-7免疫组织化学检测按试剂盒说明书进行,DAB染色,苏木素复染,梯度乙醇一二甲苯脱水,封片。显微镜下观察,胞核内出现棕黄色颗粒者为免疫组织化学染色BMP-7阳性细胞。
1.4 结果判定标准
按细胞胞核内出现棕黄色颗粒为阳性信号,每张切片光学显微镜下查看5个随机的视野(400倍),再用随机的方法选择200个细胞,计算BMP-7表现阳性的百分比,取均值;BMP-7阳性细胞≥10%判定为组织BMP-7阳性。
1.5 统计学方法
数据分析采用SPSS 18.0统计软件,计数资料采用例表示,采用χ2检验,计量资料以均数±标准差(±s)表示,采用单因素方差分析,两两比较采用SNK-q检验,应用Kaplan-Meier生存法统计绘制BMP-7阳性表达与阴性表达患者生存曲线,Logrank检验比较BMP-7表达对肝癌患者远期生存率的影响,P<0.05为差异有统计学意义。
2 结果
2.1 BMP-7在肝癌组织、癌旁组织、非癌肝脏组织中的表达
肝癌组织中BMP-7阳性率为77.6%,癌旁组织中BMP-7阳性率为55.0%,非癌肝脏组织BMP-7阳性率为35.7%,BMP-7在3种组织中表达的阳性率比较,差异有统计学意义(χ2=12.035,P=0.002)(见表1)。肝癌组织中BMP-7表达高于癌旁组织及非癌肝脏组织,且阳性率从非癌肝脏组织、癌旁组织到肝癌组织呈现递减现象。
肝癌组织、癌旁组织及非癌肝脏组织BMP-7的表达见图1。肝癌组织阳性表达细胞数为(173.6±20.4)个,癌旁组织(65.4±36.9),非癌肝脏组织(29.4±7.8)个,经单因素方差分析,差异有统计学意义(F=365.016,P=0.000),各组BMP-7表达的水平有差异;与肝癌组织比较,癌旁组织及非癌肝脏组织中可见BMP-7阳性表达细胞数较少,进一步两两比较显示,与癌旁组织比较,肝癌组织中BMP-7阳性表达细胞数增多(q=26.714,P=0.042);与非癌肝脏组织比较,肝癌组织中BMP-7阳性表达细胞数增多(q=30.677,P=0.021)。BMP-7在肝癌组织、癌旁组织、非癌肝脏组织中的表达分别为(2.213±0.210)、(1.126±0.182)及(0.786±0.319),经单因素方差分析,差异有统计学意义(F=392.607,P=0.000),各组BMP-7的表达水平有差异;进一步两两比较显示,肝癌组织中BMP-7相对表达量较癌旁组织增高(q=3.361,P=0.019);肝癌组织中BMP-7相对表达量较非癌肝脏组织增高(q=2.805,P=0.032)(见图 2)。
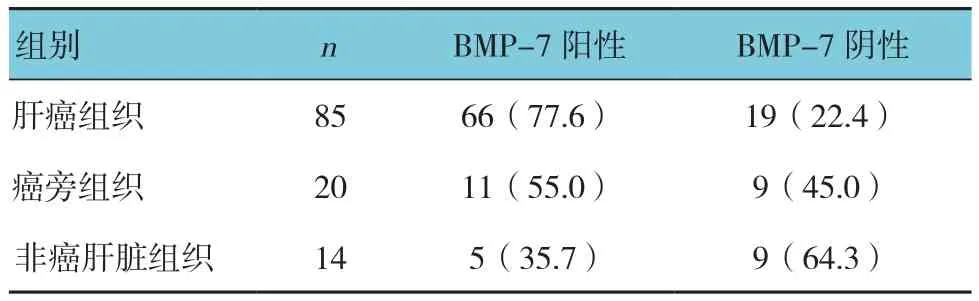
表1 BMP-7在肝癌组织、癌旁组织及非癌肝脏组织中的表达情况 例(%)

图1 BMP-7在不同组织中的表达 (免疫组织化学法×400)
2.2 BMP-7与肝癌患者临床病理特征的关系
与BMP-7阴性组织比较,BMP-7阳性组织的肿瘤直径、分化程度及2年生存率的比例降低,差异有统计学意义(P<0.05);组织分型上,低、未分化组织BMP-7阳性表达较中、高分化组织高,差异有统计学意义(P<0.05)。性别、年龄及术后肿瘤是否复发的BMP-7表达差异无统计学意义(P>0.05)。见表2。
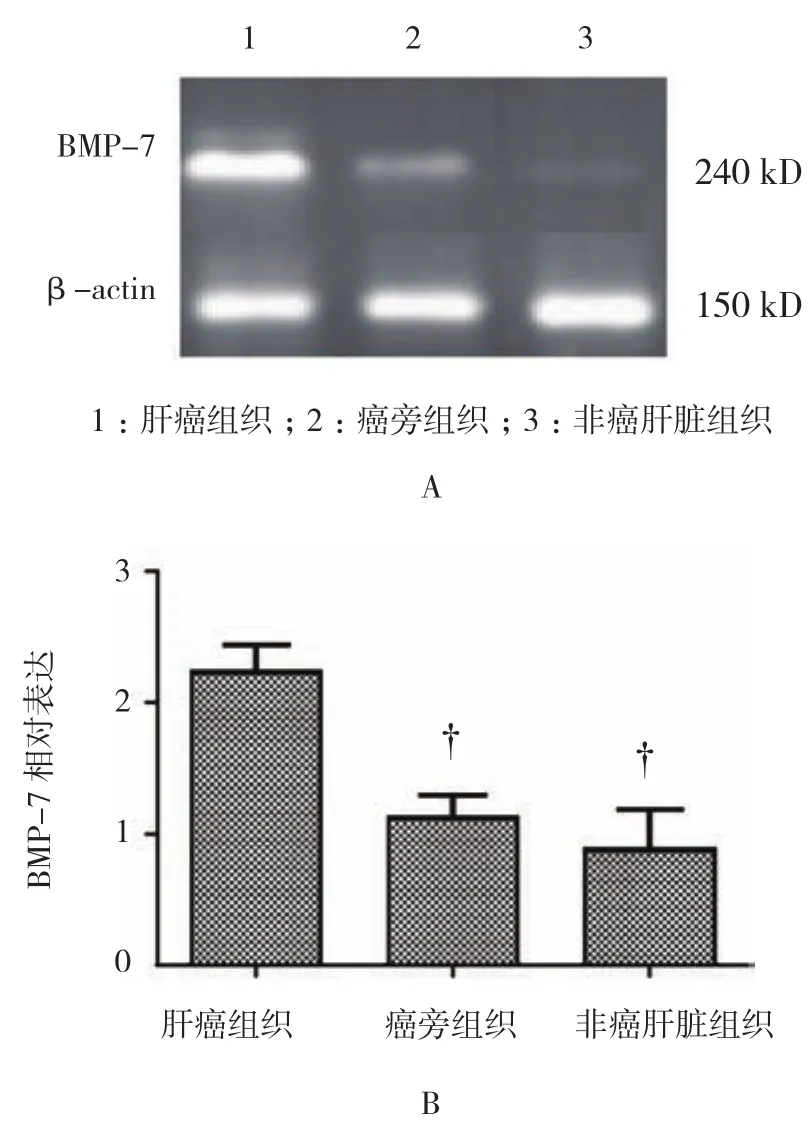
图2 BMP-7在肝癌组织、癌旁组织、非癌肝脏组织中的表达
2.3 BMP-7在肝癌的表达与患者预后生存之间的关系
与BMP-7阴性表达患者比较,BMP-7阳性表达患者的总生存率降低(χ2=8.132,P=0.004)。见图3。
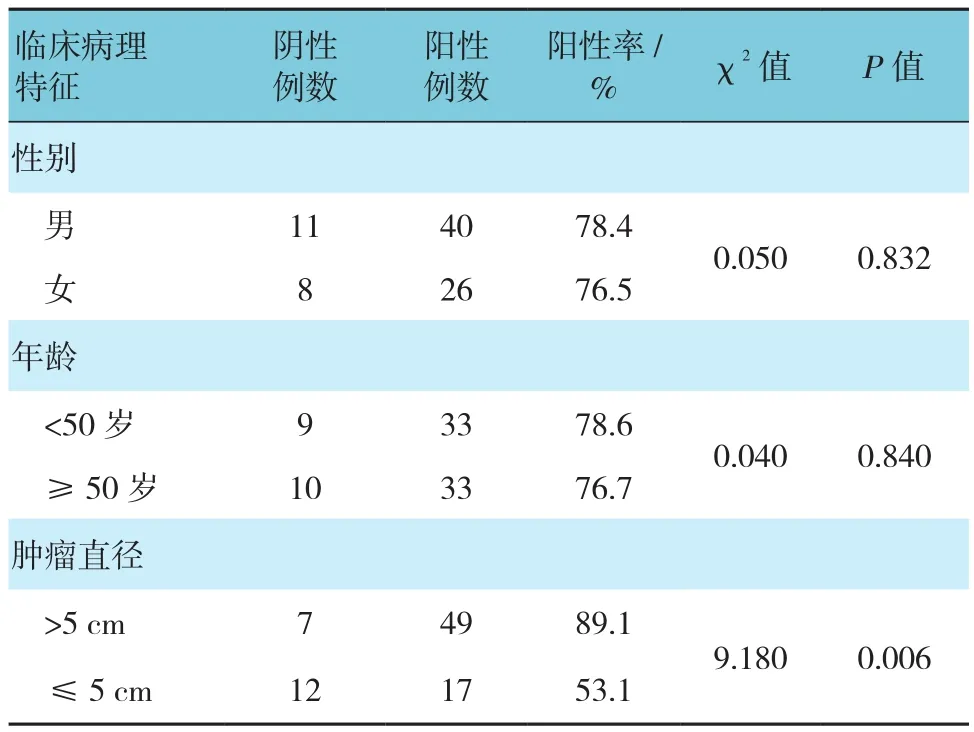
表2 BMP-7表达与肝癌临床病理特征之间的关系
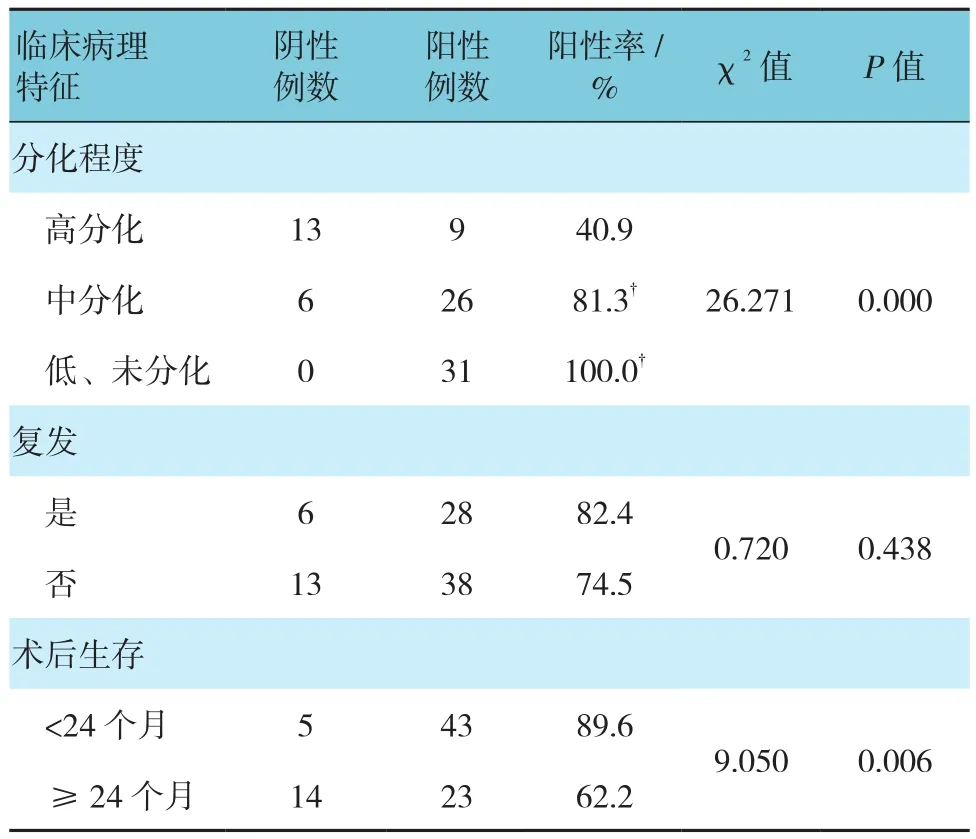
续表2
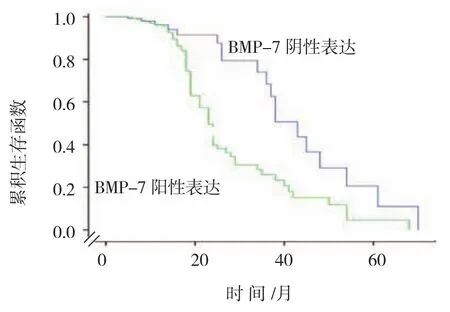
图3 BMP-7阳性及阴性表达肝癌患者术后生存曲线图
3 讨论
作为TGF家族之一,BMP-7从人类血小板中第一次分离出来,同时发现它可以减少创伤的愈合时间[6],继而在乳腺癌、胃癌、肾癌、结直肠癌等许多肿瘤组织中均发现高表达的BMP-7[7-8]。许多相关研究指出,TGF-β作为转化生长因子超家族可以通过相关信号通路,在调控细胞生长、影响细胞发育、控制细胞分化等过程中发挥作用,BMP-7可以使前炎症细胞因子水平下降;也可以促进基质金属蛋白酶的生成,以上等研究进一步表明BMP-7可以使细胞的纤维化过程发生逆转。
通过下调前炎症因子及诱导基质金属蛋白酶等进而逆转组织细胞的纤维化[9]。BMP-7通过拮抗TGF-β/Smads信号通路在肝脏组织细胞的慢性纤维化过程中发挥重要的调节作用[10-11]。TGF-β可减弱上皮细胞的分裂增殖,以上也可以发生在免疫细胞中,抑制增殖的过程可以促进上皮间质转化的发生,进而促进肝脏细胞的可塑性变化、诱导产生肝癌细胞[12]。BMP-7可以阻抑TGF-β,BMP-7在细胞中表达水平的异常可能抑制肝癌细胞的分裂增殖,同时减弱肝癌细胞的相关功能。
本研究结果表明,BMP-7与肝癌的发生、发展关系密切,其在肝癌组织中的表达远高于癌旁组织、非癌肝脏组织,阳性表达BMP-7的肝癌患者其表达水平与肿瘤大小、分化程度密切相关,且其预后较阴性表达者差,需进一步深入的机制研究。抑制BMP-7的表达或可改善肝癌患者的术后生存状况,检测BMP-7的表达或可成为肝癌患者预后的预测指标之一。
