香椿叶提取物对脂代谢异常大鼠视网膜损伤的保护机制研究*
2019-01-18张园园于利
张园园,于利
(1.锦州医科大学研究生学院,辽宁 锦州 121001;2.锦州医科大学基础医学院生理教研室,辽宁 锦州 121001)
老年性黄斑变性(senile macular degeneration,SMD)是世界范围内不可逆性致盲眼病,其发病机制复杂,多种因素参与其发生、发展过程;肥胖、高脂血症患者视网膜变性发病概率增加[1]。超重和肥胖可引起机体生理功能的改变,如高氧化应激水平,炎症发生的风险因子,血脂代谢的失衡,而这些都参与SMD的发病[2]。血脂异常可使视网膜色素上皮细胞损害,Bruch膜脂质的沉积并破坏其完整性,并导致脉络膜毛细血管内皮细胞的病理改变[3]。而视网膜Brucn膜脂质沉积又可引起视网膜色素上皮细胞及感光细胞损伤,使其功能下降,最终引起视力不可逆损伤[4]。
香椿叶是我国著名的食用药用植物,富含多种活性物质,具有很高的药用价值。香椿叶提取物(toona sinensis leaf extract, TSLE)主要成分是具有抗癌、抗氧化应激等多种生物活性功能的没食子酸[5-7],并且其对机体很多组织具有抗炎及调节脂代谢等功能[8-9]。本实验在高脂血症大鼠视网膜损伤的基础上,观察TSLE对脂代谢异常引起的视网膜损伤是否有保护作用,并探讨其可能的作用机制。
1 材料与方法
1.1 实验动物
1.1.1 模型的复制 24只雄性SD大鼠,鼠龄12周,体重(300±20)g,购自锦州医科大学动物中心。所有大鼠自由饮食水,昼夜交替12 h,模型组(16只)胃饲高脂饲料(玉米面30%、胆固醇10%、猪油60%、10 ml/kg),正常组(N组,8只)给予等量生理盐水。实验期间每3天称重,观察各组大鼠体重增长趋势。8周后检测血脂水平,确定模型是否复制成功。
1.1.2 药物处理 模型复制成功后,模型组随机分为高脂饮食组(HF组)和高脂饮食+香椿叶提取物组(HF+TSLE组),每组8只。HF+TSLE组给予香椿叶提取物(1 g/kg)水溶液灌胃,HF组给予等量生理盐水,4周后对所有大鼠进行闪光视网膜电图(flash electroretinogram, FERG)检测,血脂及肝指数的检测。各组动物取眼进行石蜡包埋苏木精-伊红染色,免疫组织化学和Western blotting检测视网膜组织中蛋白的表达水平。
1.2 实验试剂及仪器
复方托吡卡胺滴眼液(长春迪瑞制药有限公司),抗兔一抗 IL-6、TNF-α、NF-κB p65、Caspase-3(美国Cell Signaling Technology公司),抗兔二抗(美国Thermo公司),电生理检测设备(重庆艾尔曦公司),自动脱水机(德国莱卡公司),多聚甲醛(北京化学试剂公司),DAB显色剂(丹麦Dako Cytomation公司),光学显微镜(日本Olympus公司),蛋白电泳仪(美国BIO-RAD公司)。
1.3 实验方法
1.3.1 血清血脂及肝脏指数的检测 各组大鼠禁食水12 h,1%戊巴比妥钠(0.5ml/kg)麻醉后心脏取血,检测血清TC、TG、LDL-C、HDL-C的含量;并取肝脏,磷酸盐缓冲液(PBS)清洗,称肝湿重,计算肝脏指数。
1.3.2 眼视觉电生理检查 各组大鼠FERG检查前暗适应12 h,1%戊巴比妥钠腹腔注射麻醉,复方托吡卡胺滴眼液充分散瞳,暗室内安放电极,记录电极置于双眼角膜上,羟糖苷滴眼液(alcon laboratories, Inc)保持角膜滋润,参考电极刺入双耳皮下,接地电极刺入尾部,选择合适光源及频率刺激,记录a波、b波潜伏期及振幅的变化。
1.3.3 苏木精-伊红染色观察视网膜形态变化 麻醉后取各组大鼠左侧眼球,4%多聚甲醛中固定72 h。自动脱水机脱水,包埋,石蜡切片(厚5 μm),脱蜡,水化,苏木精染核,1%盐酸乙醇分化,伊红染细胞浆,梯度脱水,中性树脂封片,光镜下观察视网膜组织各层结构,并测量视网膜厚度。
1.3.4 免疫组织化学检测IL-6、TNF-α、NF-κB p65、Caspase-3的表达 选取合适石蜡切片,脱蜡至水,柠檬酸抗原修复液高温修复抗原,3% H2O2封闭内源性过氧化酶,1% Trition X-100/PBS破膜,3% BSA封闭,分别加入抗兔一抗IL-6、TNF-α、NF-κB p65、Caspase-3 4℃过夜,PBS清洗3次,37℃孵育二抗羊抗兔1h,DAB复染,苏木精染核,常规脱水封片。
1.3.5 Western blotting检测IL-6、TNF-a、NF-κB p65、Caspase-3的表达 视网膜组织加入适量含有蛋白酶抑制剂PMSF的裂解液,低温离心25min,取上清液,BCA法测定蛋白表达水平。取视网膜上清液、上样缓冲液和PBS混合煮沸使蛋白变性,SDSPAGE电泳分离目标蛋白,湿式电转移到聚偏二氟乙烯膜(PVDF)上,1% BSA室温封闭1h,一抗4℃摇床过夜孵育。次日,TBST洗膜3次,羊抗兔二抗室温孵育1h。TBST洗3次,孵育超敏发光液ECL,暗室显影。以β-actin作为内参进行校正,所有实验重复3次。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,通过Shapiro-Wilk检验确定为正态性分布,计量资料以均数±标准差(±s)表示,多组间的比较采用单因素方差分析,进一步的两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠体重及肝脏指数比较
N组、HF组及HF+TSLE组3组大鼠初始体重大致相同。高脂饮食喂饲后,HF组及HF+TSLE组大鼠体重增长较N组增加。8周后,检测血脂确定高脂血症模型成功后,开始TSLE治疗。治疗期间,HF+TSLE组大鼠体重与HF组比较,呈缓慢增长趋势,至治疗4周后,两组大鼠体重有差异。见图1。

图1 3组大鼠体重增长趋势
3组大鼠肝脏指数,N组(0.032±0.002)%,HF组(0.041±0.006)%,HF+TSLE组(0.034±0.015)%,3组比较,经单因素方差分析,差异有统计学意义(F=5.927,P=0.016);组间两两比较显示,HF组肝脏指数较N组增加(P<0.05),HF+TSLE组肝脏指数与N组比较差异无统计学意义(P>0.05);HF+TSLE组肝脏指数较HF组降低(P<0.05)。
2.2 3组大鼠血清生化指标比较
3组大鼠血清血脂水平比较,差异有统计学意义(P<0.05);HF组与N组比较,TC、TG、LDL-C含量增高,HDL-C含量降低(P<0.05);HF+TSLE组TG、LDL-C、TC、HDL-C含量差异无统计学意义(P>0.05);HF+TSLE组与HF组比较,TC、TG、LDL-C含量降低,HDL-C 含量增加(P<0.05)。见表 1。
2.3 视觉电生理检测结果
3组大鼠a波潜伏期比较,差异有统计学意义(P<0.05);其中,N组与HF组比较,HF组与HF+TSLE组比较,差异有统计学意义(P<0.05)。3组大鼠b波潜伏期、a波振幅和b波振幅比较,差异无统计学意义(P>0.05)。见表 2。
2.4 视网膜的组织形态学改变
N组视网膜各层组织排列紧密规则,HF组视网膜组织各层排列紊乱,细胞减少,尤其以外核层(ONL)和内核层(INL)减少显著,HF+TSLE组视网膜损伤状态较HF组改善。3组大鼠视网膜总厚度比较,差异有统计学意义(F=9.567,P=0.003)。进一步两两比较显示,N组和HF+TSLE组较HF组视网膜厚度均增加(P<0.05)。见图 2、3。
表1 3组大鼠血清血脂含量 (n =8,mmol/L,±s)

表1 3组大鼠血清血脂含量 (n =8,mmol/L,±s)
注:1)与N组比较,P <0.05;2)与HF组比较,P <0.05
组别 TG TC LDL-C HDL-C N 组 1.04±0.05 0.88±0.08 0.29±0.05 0.53±0.08 HF 组 1.51±0.391) 1.18±0.311) 0.39±0.061) 0.27±0.061)HF+TSLE 组 1.16±0.212) 0.80±0.052) 0.30±0.042) 0.45±0.062)F值 4.443 5.927 5.535 10.014 P值 0.036 0.016 0.020 0.001
表2 3组大鼠视网膜FERG a波、b波潜伏期及振幅比较 (n =8,±s)

表2 3组大鼠视网膜FERG a波、b波潜伏期及振幅比较 (n =8,±s)
注:1)与N组比较,P <0.05;2)与HF组比较,P <0.05
组别 a波潜伏期/ms b波潜伏期/ms a波振幅/μV b波振幅/μV N 组 14.17±2.19 40.42±5.49 37.3±16.38 129.13±40.06 HF组 19.71±1.361) 41.39±5.03 35.25±9.83 113.43±29.96 HF+TSLE组 16.17±1.802) 37.96±4.67 29.05±6.39 103.98±23.81 F值 18.053 1.392 0.839 1.893 P值 0.000 0.263 0.441 0.167
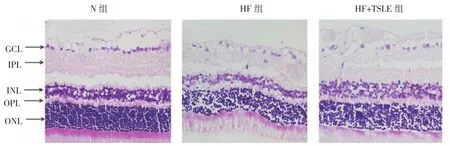
图2 各组大鼠视网膜形态变化 (HE×400)

图3 3组大鼠视网膜厚度比较 (n =8,±s)
2.5 视网膜组织IL-6、TNF-α、NF-κB p65、Caspase-3的表达
免疫组织化学结果显示,HF组IL-6、TNF-α、NF-κB p65、Caspase-3蛋白表达水平较N组增加,HF+TSLE组较HF组蛋白表达降低;Western blotting结果显示,3组IL-6、TNF-α、NF-κB p65、Caspase-3的表达,经单因素方差分析,差异有统计学意义(F=59.290、13.770、28.340 和 10.090,P=0.017、0.031、0.011和 0.010),HF 组 IL-6、TNF-α、NF-κB p65、Caspase-3蛋白相对表达量较N组增加(P<0.05);HF+TSLE组蛋白相对表达量较HF组减少(P<0.05)。见图 4~11。

图4 3组大鼠视网膜组织IL-6表达 (免疫组织化学×400)

图5 3组大鼠视网膜组织IL-6表达 (Western blotting检测)

图6 3组大鼠视网膜组织TNF-α表达 (免疫组织化学×400)

图7 3组大鼠视网膜组织TNF-α表达 (Western blotting检测)
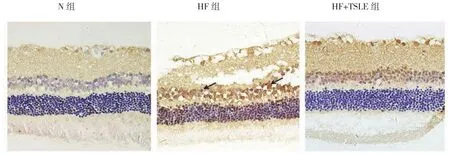
图8 3组大鼠视网膜组织NF-κB p65表达 (免疫组织化学×400)

图9 3组大鼠视网膜组织NF-κB p65表达 (Western blotting检测)

图10 3组大鼠视网膜组织Caspase-3表达 (免疫组织化学×400)

图11 3组大鼠视网膜组织Caspase-3表达 (Western blotting检测)
3 讨论
SMD是一种随年龄增长和慢性炎症刺激而发展的疾病,其发生和发展与黄斑区脂质和蛋白质混合物的沉积密切相关,沉积物的堆积最终导致视网膜细胞的功能缺失或凋亡。高脂血症时机体脂质的代谢功能受损,长期刺激,极易使视网膜组织遭受损失,大量中性脂质堆积在Bruch膜,该中性脂质的堆积最终形成玻璃膜疣,导致视力下降,造成不可逆的中心视力丧失[10]。目前,临床上的治疗已取得一定成效,但方法局限,因此,找到新的治疗方法十分重要。
香椿叶有着悠久的食用药用历史,其提取物没食子酸富含多种生物活性,相关研究发现[11],TSLE对4-羟基壬烯酸诱导的视网膜细胞毒性具有保护作用以及在H2O2诱导的APRE-19细胞损伤中能够抑制促炎因子的表达而发挥保护作用[12]。
3组大鼠在高脂饮食胃饲后,血清血脂水平增加,TSLE治疗后,血清血脂水平较HF组有所下降。视网膜光镜下HE染色显示高脂模型组大鼠视网膜变薄,各层排列紊乱,特别是外核层光感受器细胞排列紊乱,细胞凋亡,数量减少。而白霞等[13]也发现高脂引起视网膜超微结构的改变主要发生在外核层的感光细胞体外段视盘及视网膜神经纤维层。TSLE治疗后,视网膜各层组织排列较HF组大鼠视网膜排列相对规则,外核层细胞数量明显增加。TSLE对视网膜的保护作用还可通过FERG功能检测来评估。FERG主要反映视网膜感光细胞到双极细胞及无长突细胞的功能。a波反映视网膜外层光感受器细胞层的生物电活动,b波是对视网膜双极细胞电活动的反应,其变化能够评价视网膜内层的功能状态。机体长期代谢异常使视网膜组织内外屏障受损,进而使其转运物质及代谢水平下降,而视网膜组织的代谢水平对感光细胞维持正常视觉是必不可少的[14]。本研究高脂干预后,HF组大鼠a波潜伏期时间较N组延长,且a波振幅较N组也降低;b波潜伏期及振幅也发生改变,说明高脂对视网膜外层感光细胞层造成损伤,但对视网膜内层双极细胞的影响较小。TSLE治疗后,HF+TSLE组a波b波潜伏期时间较HF组明显缩短,视网膜光感受器功能得到显著提高,但a波和b波振幅在治疗后没有增加,可能与实验期间电生理检测时引起角膜损伤相关。
研究表明脂代谢异常引起体内脂质过氧化物增多,脂质积累,玻璃膜疣形成,进而引起眼底慢性炎症反应[15],炎症反应进一步使脂质融合累积。长期炎症因子的浸润促使视网膜内多种细胞释放炎症介质,造成视网膜损伤,最终使细胞凋亡,而一些炎症因子如IL-1、IL-6、IL-8和TNF-α等已经被证实可以加速SMD的进展[16]。本研究中高脂模型大鼠视网膜组织中炎症因子IL-6、TNF-α表达水平均升高,另外发现视网膜组织中NF-κB p65及Caspase-3的表达也增加。NF-κB是一种多效性的核转录因子,参与细胞生长、黏附、分化、炎症及凋亡反应,p65异源二聚体是其发挥生理功能的重要结构片段。NF-κB p65作为一种多向性调节蛋白,在细胞内介导多种炎症表达。IL6、TNF-α等炎症因子的释放、堆积诱导核因子NF-κB p65的激活,进而促进Caspase-3的表达增加,引起细胞凋亡。研究表明TSLE对多种组织有抗炎作用,其中包括TSLE对体内体外肺损伤具有抗炎作用[17];在NF-κB转基因小鼠实验中[18],TSLE通过调控NF-κB p65的表达抑制LPS诱导的炎症反应。另有相关动物实验表明[19],TSLE具有与非甾体抗炎药物相同的功能作用。本研究中,TSLE对高脂模型大鼠治疗后,视网膜组织中IL-6、TNF-α、NF-κB p65及Caspase-3的表达降低,提示TSLE对高脂大鼠视网膜损伤发挥保护作用可能是通过IL-6、TNF-α、NF-κB p65、Caspase-3信号途径。
总之,目前的研究结果表明,TSLE是一种潜在的有效预防由于脂代谢异常的食用药物,为SMD的预防或者治疗方法提供一个新的思路。然而TSLE发挥作用的具体机制是否是通过IL-6、TNF-α、NF-κB p65、Caspase-3信号途径仍需进一步深入研究。
