米氮平对抑郁症伴睡眠障碍患者抑郁症状、PSQI评分及睡眠结构的影响
2019-01-16刘燕朋周进涛连俊红
刘燕朋,周进涛,连俊红
0 引言
抑郁症是精神科常见的疾病,患者主要表现为持久性的心境低落,并伴有思维迟缓、意志活动减退、认知损害以及各种躯体症状,严重者可出现悲观厌世、妄想幻觉、甚至自杀倾向,严重威胁患者身心健康、工作、学习及社会交往质量。研究显示,在抑郁症的众多躯体合并症状中,睡眠障碍最为常见,其合并率高达90.0%以上,且多以此为首发症状就诊,同时也被作为抑郁症的临床诊断标准之一[1]。研究证实,睡眠障碍不仅可导致抑郁症患者生活质量降低,还是患者自杀倾向的独立危险因素,并可导致病情反复发作,直接影响着其病程及预后质量[2]。相关统计指出,随着现代社会生活和工作压力增加,生活节奏变快,抑郁症发病率呈直线式上升,已成为威胁身心健康的重要公共卫生问题,如何有效治疗抑郁症也成为较为棘手的问题。研究证实,抑郁症治疗不仅需有效控制抑郁症状,改善其睡眠质量也是提高疗效的关键,尤其对于抑郁症伴睡眠障碍患者[3]。抗焦虑药物是目前抑郁症伴睡眠障碍患者首选用药,其中西酞普兰是一种选择性5-羟色胺摄取抑制剂(SSRIs),具有强效抗抑郁作用,被广泛用于抑郁症的治疗,但研究显示,其单用改善睡眠质量效果欠佳[4]。米氮平是临床常用的抗抑郁药物,同时也是首个具有去甲肾上腺素(NE)促释放和5-HT再摄取抑制药,能同时改善患者抑郁症状和睡眠障碍[5]。但目前就两种药物联用治疗抑郁症伴睡眠障碍尚无文献报道,因此,本研究对此方面进行研究,现报道如下。
1 资料与方法
1.1 一般资料 选取我院2016年1月至2017年2月收治的90例抑郁症伴睡眠障碍患者。纳入标准[6]:①均符合中华医学会关于原发性抑郁症伴睡眠障碍诊断标准;②无合并严重的心脑血管、肝肾肺等器官组织疾病;③对本研究药物无过敏;④年龄20~55岁;⑤均自愿参加本研究并签署知情同意书。排除标准:①近2个月内接受SSRIs及其他抗抑郁、抗精神病或镇静催眠药物治疗者;②其他病因所致的抑郁或睡眠障碍者;③伴有严重自杀倾向或情感障碍者;④合并严重的血液系统、免疫系统、神经系统、内分泌系统或精神类疾病;⑤妊娠期或哺乳期妇女。采用随机数字法将其分为对照组和观察组,每组45例。对照组男21例,女24例,年龄21~52岁,平均年龄(35.72±8.40)岁,病程7个月~6年,平均病程(2.93±0.84)年,存在自杀倾向20例;观察组男22例,女23例,年龄20~55岁,平均年龄(35.87±8.51)岁,病程6个月~7年,平均病程(2.97±0.91)年,存在自杀倾向19例。两组患者在性别、年龄、病程及合并自杀倾向等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 方法 两组患者均口服草酸艾司西酞普兰片(四川科伦药业股份有限公司,批号:YBH13942008,10 mg)治疗,剂量:10 mg/次,1次/d,均于每晚睡前服用,同时根据患者症状程度进行增添剂量,每日最高剂量不得超过20 mg。观察组患者在此基础上,口服米氮平片(哈尔滨三联药业股份有限公司,批号:H20060702,30 mg)治疗,剂量:15 mg/次,1次/d,均于睡前服用,于治疗1周后增加至最大剂量30 mg/d。两组患者均连续治疗8周。
1.3 观察指标 ①比较两组患者的治疗总有效率;②比较两组患者治疗前后的蒙哥马利抑郁评定量表(MADRS)评分和匹兹堡睡眠质量指数量表(PSQI)评分;③比较两组患者治疗前后的实际睡眠时间、睡眠潜伏期、睡眠效率、觉醒时间、非快速眼球运动睡眠(NREM)中S1+S2时间和S3+S4时间及快速眼球运动睡眠(REM)等睡眠结构因子水平;④比较两组患者的口干、恶心、乏力、嗜睡及头晕等不良反应发生率。
1.4 疗效标准 根据治疗后患者抑郁和睡眠质量改善效果进行疗效评定[7],分为①治愈:经治疗后患者MADRS评分降低≥80.0%或MADRS评分<12分,睡眠恢复正常;②显效:经治疗后患者MADRS评分降低50.0%~80.0%,睡眠恢复至基本正常;③有效:经治疗后患者MADRS评分降低25.0%~50.0%,睡眠质量有所改善;④无效:经治疗后患者MADRS评分降低<25.0%,睡眠质量无改善或恶化。治疗总有效率=(治愈率+显效率+有效率)×100.0%。
采用MADRS评价患者抑郁症状,分为5个等级,包括缓解期(MADRS评分<12分)、轻度抑郁(MADRS评分12~22分)、中度抑郁(MADRS评分23~30分)、重度抑郁(MADRS评分31~35分)及极度抑郁(MADRS评分>35分)。采用PSQI评价患者睡眠质量,总分为21分,包括睡眠质量、睡眠障碍、入睡时间、睡眠时间、睡眠效率、安眠药物及日间功能障碍7个项目,总分越高提示睡眠障碍越重。
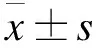
2 结果
2.1 两组患者的治疗总有效率比较 观察组患者的治疗总有效率为91.11%,对照组为73.33%,观察组明显高于对照组(χ2=4.86,P=0.02),见表1。
2.2 两组患者治疗前后的MADRS评分、PSQI评分比较 治疗前,两组患者的MADRS评分、PSQI评分比较差异无统计学意义(P>0.05);治疗后,观察组患者的MADRS评分、PSQI评分均明显低于对照组(P<0.01),见表2。
2.3 两组患者治疗前后的睡眠结构因子比较 治疗前,两组患者的实际睡眠时间、睡眠潜伏期、睡眠效率、觉醒时间、NREM中S1+S2时间和S3+S4时间及REM时间比较差异均无统计学意义(P>0.05);治疗后,观察组患者的实际睡眠时间、NREM中S3+S4时间、REM时间较对照组延长(P<0.01),睡眠效率高于对照组(P<0.01),睡眠潜伏期、觉醒时间、NREM中S1+S2时间较对照组缩短(P<0.01),见表3。
2.4 两组患者的不良反应发生率比较 观察组患者治疗期间共出现1例口干、1例恶心、1例头晕,未出现乏力、嗜睡病例,总不良反应发生率为6.67%;对照组患者治疗期间共出现2例口干、1例恶心、1例乏力、1例头晕,未出现嗜睡病例,总不良反应发生率为11.11%;两组患者的不良反应发生率比较差异无统计学意义(P>0.05)。
3 讨论
抑郁症是临床常见的精神类疾病,以精神状态低落为最直观表现,并伴有精神萎靡、负罪感、焦虑等精神症状,同时可引起认知功能障碍、乏力、食欲降低、睡眠障碍等躯体症状,对患者生活、工作、学习及社会交往构成极大影响,严重者甚至具有明显自杀倾向[8]。据世界卫生组织(WHO)统计显示,全球每年因抑郁症自杀患者达100万以上,预计到2020年抑郁症将成为继心脑血管疾病后的第二大疾病致死病因。睡眠障碍是抑郁症患者初期主要症状,以失眠、多梦、早醒为主要表现,且随着病情进展睡眠障碍可明显加重,导致患者白天疲乏、精神萎靡、意识模糊等现象,同时可增加意外事件风险,极大提高临床治疗难度[9]。研究证实,睡眠障碍与抑郁症关系密切,提高患者睡眠质量有助于抑郁症病情恢复,反之可加重其病情[10]。因此,目前抑郁症伴睡眠障碍患者多以标本兼治为治疗原则,采用以抗抑郁药物联合镇静睡眠药物模式,常可取得显著疗效。抑郁症引起睡眠障碍的机制迄今仍未明确,多数研究认为,单胺能神经递质等传递能力减弱与其发生密切相关,同时也有研究认为,其与大脑边缘系统多巴胺功能失衡和多巴胺受体减少有关。研究表明,经适宜剂量胆碱类药治疗后,抑郁症患者快速动眼睡眠潜伏期明显缩短,提示睡眠障碍发病机制与抑郁症相关性较高[11]。

表1 两组患者的治疗总有效率比较(例,%)
注:*与对照组比较,χ2=4.86,P=0.02
注:#与治疗前比较,P<0.05
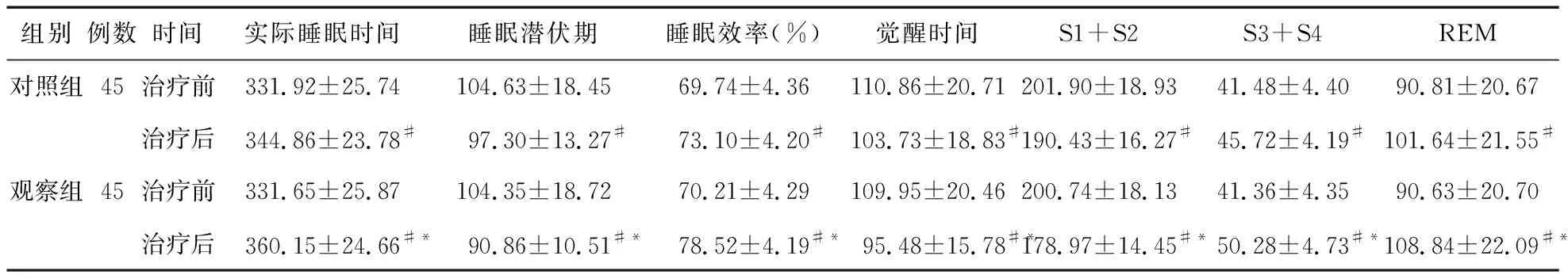
表3 两组患者治疗前后的睡眠结构因子比较(min)
注:*与对照组比较,P<0.05;#与治疗前比较,P<0.05
临床研究证实,抑郁症发病机制与中枢NE和5-HT以及相关受体功能降低密切相关。NE受体拮抗剂和SSRIs是抑郁症常用的两类抗抑郁药物,具有疗效高、不良反应少及耐受性高等优势,被广泛应用于临床[12]。西酞普兰是治疗抑郁症常用的SSRIs,通过抑制CNS神经元对5-HT再摄取作用,提高突触间隙内5-HT浓度,促进其发挥睡眠、饮食、体温及精神情感性疾病调节作用,增强中枢5-HT能神经功能,从而改善患者抑郁症状[13]。但研究发现,西酞普兰可增强5-HT2受体活性,能够导致患者睡眠结构改变,具有加重睡眠障碍风险,因此,对于伴睡眠障碍患者需联合催眠药物治疗[14]。米氮平作为一种新型的抗抑郁药物,具有NE能和5-HT再摄取抑制双重作用,能有效阻断突触前α2-肾上腺素能受体,促进NE释放和提高其活性,同时,NE神经元又可增强5-HT细胞体上α2肾上腺素能受体活性,从而增加大脑内5-HT含量[15]。且研究显示,其还能阻断5-HT2和5-HT3受体,能通过主观和客观两方面改善患者抑郁症状和睡眠障碍,促进患者抑郁及睡眠恢复,且能够避免加用催眠药物所产生的不良反应[16]。本研究联合两种药物治疗,结果显示,观察组患者的治疗总有效率明显高于对照组,同时治疗后的MADRS评分明显低于对照组,表明两种药物在改善抑郁症状方面具有协调作用。同时,本研究结果显示,观察组患者治疗后的PSQI评分明显低于对照组,睡眠效率高于对照组,实际睡眠时间、S3+S4时间及REM时间较对照组延长,睡眠潜伏期、觉醒时间及S1+S2时间较对照组缩短,证实米氮平能够有效改善患者睡眠质量和结构,与其促进NE神经传导密切相关,且两组患者均未出现明显不良反应,治疗安全性较高。
综上所述,米氮平对抑郁症伴睡眠障碍患者的疗效显著,能够明显改善患者抑郁症状,改善睡眠质量及纠正睡眠结构,且治疗安全性较高,值得临床推广。
