日粮中添加新型酿酒酵母培养物对樱桃谷鸭肌肉品质和肠道微生物的影响
2019-01-16李双全唐义梅郑文涌牛耀嵘吕常旭侯奇良晏向华马立保
石 敏,李双全,唐义梅,郑文涌,牛耀嵘,吕常旭,侯奇良,晏向华,马立保*
(1.华中农业大学动物科技学院,武汉 430070;2.湖北绿科乐华生物科技有限公司,湖北 黄冈 438000)
棉粕和菜籽粕等非常规蛋白质饲料因含有较多的游离棉酚、植酸、单宁及粗纤维等抗营养因子,不能被动物较好地消化、吸收和利用。微生物生物发酵是提高利用效率的有效手段之一,酿酒酵母常用于发酵非常规原料,以提高非常规原料的使用量和饲喂价值。酿酒酵母发酵在提高非常规原料利用价值的同时,还能产生大量的代谢产物(营养代谢物、酶类和未知营养因子等),而且酵母细胞富含氨基酸、维生素、矿物质和甘露寡糖等成分,能为微生物提供丰富的营养物质,改善肠道菌群组成,进而提高动物的生产性能和改善肌肉品质[1]。Gao等研究发现,日粮中添加酿酒酵母培养物2.5 g·kg-1可增加1~42日龄肉鸡的平均日增重,降低料重比[2]。路则庆等研究发现,大麦-高粱型日粮中添加酿酒酵母培养物0.8%能增加猪肉肌苷酸的含量,提升猪肉鲜味[3]。Price等研究报道,日粮中添加酿酒酵母培养物0.2%可增加沙门氏菌感染的断奶仔猪胃肠道中乳酸菌和拟杆菌的数量,改善微生物区系[4]。
本试验使用的新型酿酒酵母培养物是基于菜籽粕等杂粕在菌酶协同作用下,经固液结合深度发酵、低温干燥制成,富含还原型谷胱甘肽、原花青素、有机酸和酵母细胞壁多糖等多种活性物质。然而,杂粕的发酵效率较低,发酵后单位重量产生的可供肠道微生物吸收利用的代谢物的含量低于类似于“益康XP”等酿酒酵母培养物,因此,为达到与“益康XP”相同的应用效果,日粮中新型酿酒酵母培养物的添加量要提高,而且适度高剂量的添加也为利用非常规原料提供了可能性。使用发酵后的菜籽粕替代基础日粮中部分豆粕作为动物的蛋白质来源,可以降低配方成本,减少资源的浪费。本试验探究日粮中添加新型酿酒酵母培养物对樱桃谷鸭肌肉品质和肠道微生物的影响,为其在樱桃谷鸭日粮中地进一步推广和应用提供理论依据。
1 材料与方法
1.1 试验材料
新型酿酒酵母培养物底物(培养基)和新型酿酒酵母培养物由湖北绿科乐华生物科技有限公司提供。新型酿酒酵母培养物底物养分含量为:粗蛋白质51.4%、粗脂肪1.8%、粗纤维8.4%、粗灰分8.6%;新型酿酒酵母培养物养分含量为:粗蛋白质53.1%、粗脂肪1.7%、粗纤维10.1%、粗灰分8.4%、还原型谷胱甘肽的含量为0.30%,原花青素的含量为0.15%。
1.2 试验动物及试验设计
选取健康且体重相近的1日龄樱桃谷鸭396只,随机分为3组,每组6个重复,每个重复22只,试验期42 d。参考美国NRC(1994)樱桃谷鸭的营养需要量,分别设计1~21日龄和22~42日龄樱桃谷鸭的日粮配方,基础日粮组成及营养水平见表1。Ⅰ组为对照组,饲喂玉米-豆粕型基础日粮,Ⅱ、Ⅲ组分别在基础日粮中添加新型酿酒酵母培养物底物2.5%和新型酿酒酵母培养物2.5%。
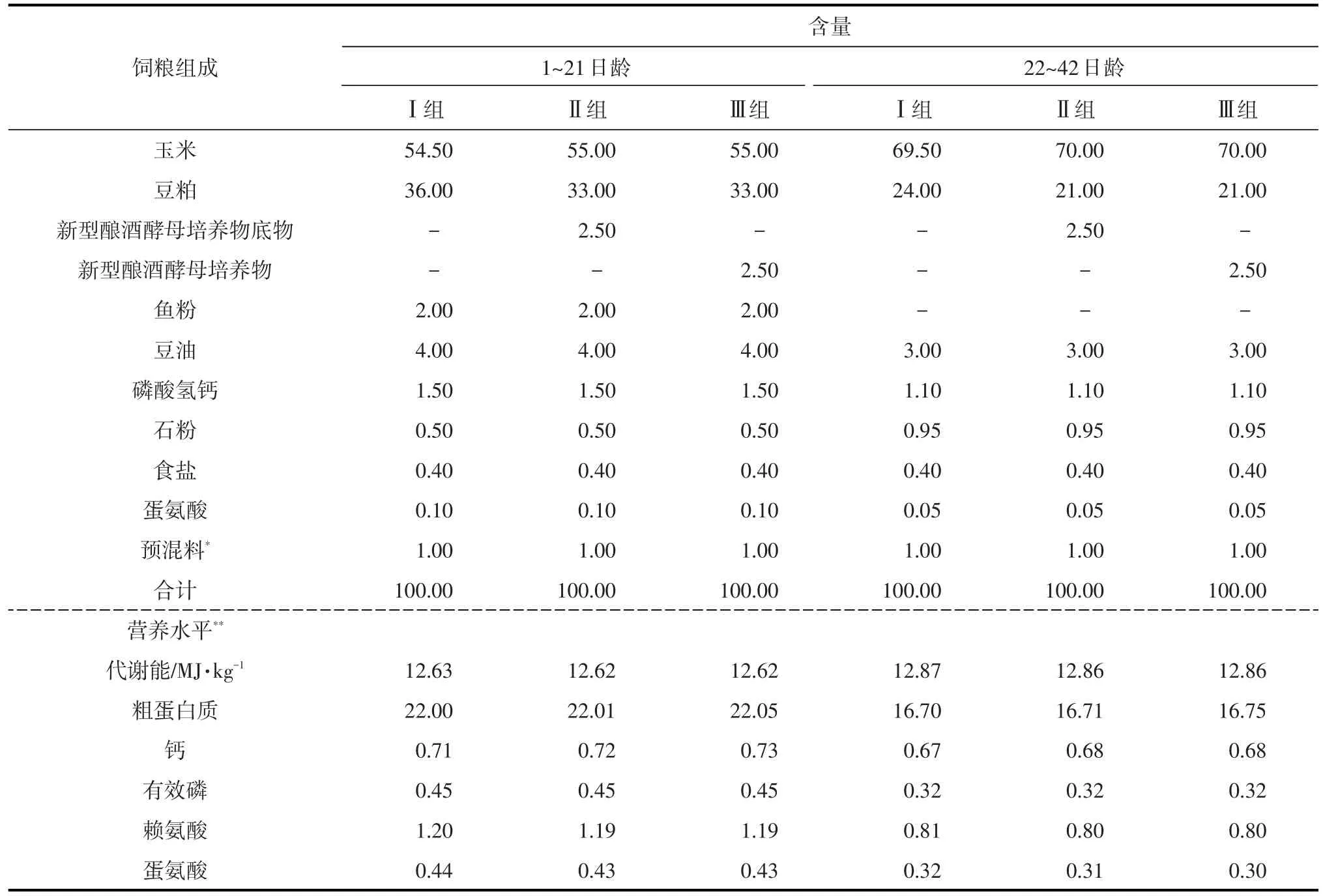
表1 基础日粮组成及营养水平 %DM
1.3 饲养管理
饲养试验开始前,鸭舍、水槽和料槽进行充分清洗并且严格消毒。樱桃谷鸭为舍内平养,自由采食和饮水,常规免疫,保证通风良好,温度适宜。舍内地面平铺垫料,雏鸭首次垫料厚度6~8 cm,以后逐渐递减。每天清理鸭舍,更换潮湿垫料,定期消毒。
1.4 检测指标及方法
1.4.1 肌肉品质指标
试验至第42天,每组每个重复随机取1只接近平均体重的樱桃谷鸭,颈部放血屠宰,立即解剖,分割胸肉和腿肉,自封袋分装,4℃保存备用。
常规营养成分:水分检测参照GB 5009.3-2016《食品安全国家标准食品中水分的测定》。粗蛋白质检测参照GB/T 9695.11-2008《肉与肉制品氮含量测定》。肌内脂肪检测采用三氯甲烷-甲醇法。取5.0 g鸭胸肉和鸭腿肉,搅碎后放入匀浆管,加入30 mL三氯甲烷-甲醇溶液(体积比2∶1,下同),低速匀浆后转入三角瓶,再加入50 mL三氯甲烷-甲醇溶液,静置1 h,过滤,加入0.2倍体积的生理盐水,3 000 r·min-1离心15 min,取下层液体,倒入50 mL烧杯中,沸水浴蒸干,经烘箱干燥后称重。烧杯蒸前重为m1,蒸后重为m2,肉重为m3,则肌内脂肪含量=(m2-m1)/m3×100%。
pH:屠宰后分别于宰后45 min和24 h检测肌肉的pH。将DELTA320型pH计的探针插入肌肉中,测定3个不同位置,取平均值。
滴水损失率:屠宰后取约10 g的肉样,天平称重得n1,将肉样放入滴水损失管内,置于试管架上,放入4℃冰箱,48 h后取出称重得n2,滴水损失率=(n1-n2)/n1×100%。
肉色:将肌肉切成厚度约为0.5 cm,半径约为2 cm的肉块,用miniscan-EZ型肉质测色仪检测肌肉的亮度、红度和黄度。每个样品测3次,取平均值为最终结果。
1.4.2 肠道微生物
试验至第42天,每组每个重复随机取1只接近平均体重的樱桃谷鸭,颈部放血屠宰,立即解剖,无菌操作,快速收集盲肠内容物于灭菌的冻存管中,液氮速冻,-80℃保存。
基因组总DNA提取和PCR扩增:Ⅰ、Ⅱ和Ⅲ组分别选取6、4和6个樱桃谷鸭的盲肠内容物样品参考文献进行盲肠内容物基因组总DNA提取,DS-11型超微量分光光度计和琼脂糖凝胶电泳(1%)检测DNA的浓度和纯度,-80℃保存[5]。对微生物基因组16S rDNA V3-V4区进行PCR扩增,引物序列为341F:ACTCCTACGGGAGGCAG和806R:GGACTACHVGGGTWTCTAAT。PCR扩增,Illumina Miseq测序和生物信息分析均由深圳华大基因科技服务有限公司协助完成。
生物信息分析:下机后先对数据进行处理,去除低质量、含有接头和带有N的序列,将reads拼接成tags,在97%相似度下通过USEARCH(V7.0.1090)软件将tags聚类,得到分类操作单元(OTUs)[6]。通过RDPclassifer(V2.2)将OTUs代表序列与数据库进行比对,置信度阈值为0.6,细菌数据库为Greengene[7]。基于样品OTUs的数目通过R软件(V3.1.1)绘制OTUs韦恩图,通过与数据库比对,对OTUs进行菌种注释绘制profiling柱状图。基于样品Alpha多样性指数,通过R软件绘制相应的稀释曲线图和箱形图。Beta多样性通过QIIME软件(V1.80)分析。样品组间差异的显著性通过Metastats分析。
1.5 统计分析
试验数据采用SPSS 20.0软件One Way ANOVA进行统计分析,并进行Duncan's多重比较,结果以“平均值±标准误”表示。
2 结果与分析
2.1 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肌肉品质的影响
2.1.1 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肌肉常规营养成分的影响
日粮中添加新型酿酒酵母培养物对樱桃谷鸭肌肉常规营养成分的影响见表2。
由表2可知,各组樱桃谷鸭水分和粗蛋白质的含量均差异不显著(P>0.05)。Ⅲ组樱桃谷鸭胸肌肌内脂肪的含量极显著高于Ⅰ和Ⅱ组(P<0.01),但腿肌肌内脂肪的含量组间差异不显著(P>0.05)。
2.1.2 日粮中添加新型酿酒酵母培养物对樱桃谷鸭常规肉品质指标的影响
日粮中添加新型酿酒酵母培养物对樱桃谷鸭常规肉品质指标的影响见表3。
由表3可知,各组樱桃谷鸭胸肌pH45min、pH24h、滴水损失率和肉色均差异不显著(P>0.05)。Ⅲ组樱桃谷鸭腿肌pH45min和pH24h均显著高于Ⅰ、Ⅱ组(P<0.05),滴水损失率较Ⅱ组有降低的趋势(P=0.06)。各组樱桃谷鸭腿肌肉色均差异不显著(P>0.05)。

表2 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肌肉常规营养成分的影响 %

表3 日粮中添加新型酿酒酵母培养物对樱桃谷鸭常规肉品质指标的影响
2.2 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物的影响
2.2.1 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物测序数据的影响
对16只樱桃谷鸭的盲肠内容物样品进行测序分析,共得到297792条有效序列。日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物测序数据的影响见图1。
由图1可知,随着测序序列数目的增加,Chao指数已趋于平坦,达到平台期,表明测序已基本覆盖樱桃谷鸭肠道微生物的所有物种。
2.2.2 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物OTUs数目的影响
日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物OTUs数目的影响见图2。
由图2可知,97%相似度下进行聚类,所有的序列共聚类成459个OTUs,其中,Ⅰ、Ⅱ、Ⅲ组樱桃谷鸭肠道微生物的核心OTUs为336个。
2.2.3 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物Alpha多样性的影响
Alpha多样性包括Chao指数、ACE指数、Shannon指数和Simpson指数等。Chao指数和ACE指数反映群落的丰富度,Shannon指数和Simpson指数反映群落的多样性。日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物Alpha多样性的影响见图3。
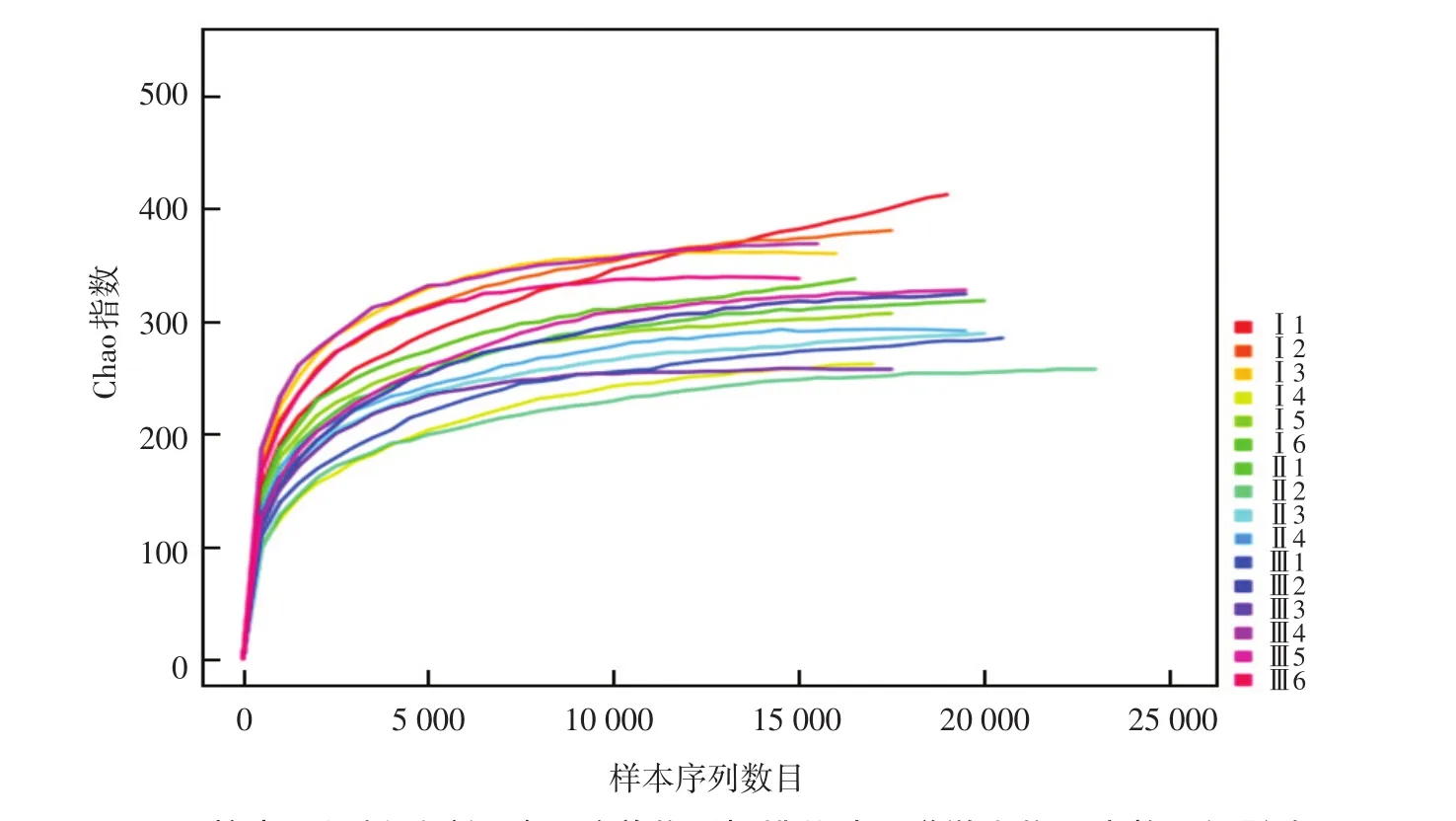
图1 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物测序数据的影响

图2 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物OTUs数目的影响

图3 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物Alpha多样性的影响
由图3可知,Ⅰ、Ⅱ、Ⅲ组樱桃谷鸭肠道微生物的Alpha多样性组间无显著差异(P>0.05),但Ⅱ组樱桃谷鸭肠道微生物的Chao指数(P=0.099)和ACE指数(P=0.050)较Ⅰ组均有降低的趋势。
2.2.4 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物Beta多样性的影响
Beta多样性用于区分样品组间物种多样性的差异,weighted UniFrac是考虑序列丰度和进化距离的一种衡量Beta多样性的重要指标。日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物Beta多样性的影响见图4。

图4 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物Beta多样性的影响
由图4可知,细菌主成分1(Principal compoent 1,PC1)、PC2和PC3的贡献率分别为38%、21%和13%。由图4可知,Ⅰ、Ⅱ、Ⅲ组樱桃谷鸭的肠道微生物区系能够比较明显地区分开。
2.2.5 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物群落组成的影响
日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物群落组成的影响见图5~7、表4。由图5可知,Ⅰ、Ⅱ、Ⅲ组樱桃谷鸭肠道细菌的优势菌门均为拟杆菌门、厚壁菌门、变形菌门和梭杆菌门。通过Metastats分析比较不同处理间樱桃谷鸭门水平上肠道微生物相对丰度的差异,由图6可知,Ⅱ组和Ⅲ组樱桃谷鸭肠道细菌中拟杆菌门的相对丰度极显著高于Ⅰ组(P<0.01),Ⅲ组樱桃谷鸭肠道细菌中放线菌门的相对丰度显著高于Ⅰ组(P<0.05),Ⅱ组樱桃谷鸭肠道细菌中变形菌门的相对丰度极显著低于Ⅰ组(P<0.01),但Ⅲ组樱桃谷鸭肠道细菌中变形菌门的相对丰度与Ⅰ组无显著差异(P>0.05)。

图5 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物门水平相对丰度的影响

图6 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道差异菌门水平相对丰度的影响
樱桃谷鸭属水平上肠道微生物的相对丰度:由图7可知,通过与数据库比对,Ⅰ、Ⅱ、Ⅲ组樱桃谷鸭的肠道细菌共注释到64个菌属,并且优势菌属均为拟杆菌属和梭杆菌属。表4结果显示,与Ⅰ组相比,Ⅲ组樱桃谷鸭肠道细菌中拟杆菌属的相对丰度显著增加(P<0.05),Erysipelatoclostridium的相对丰度显著减少(P<0.05);与Ⅱ组相比,Ⅲ组樱桃谷鸭肠道细菌中Oxalobacter的相对丰度极显著增加(P<0.01),Parabacteroides和Oscillibacter的相对丰度极显著减少(P<0.01),脱硫弧菌属、Hydrogenoanaerobacterium、Butyricimonas、嗜胆菌属和梭菌属的相对丰度显著增加(P<0.05)。

图7 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物属水平相对丰度的影响

表4 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道差异菌属水平相对丰度的影响 %
2.2.6 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物基因功能的影响
日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物基因功能的影响见图8。
由图8可知,Ⅱ组樱桃谷鸭肠道细菌脂质代谢基因功能的相对丰度显著高于Ⅰ、Ⅲ组(P<0.05),细胞运动基因功能的相对丰度极显著低于Ⅰ组(P<0.01),但与Ⅲ组差异不显著(P>0.05);Ⅲ组樱桃谷鸭肠道细菌核苷酸代谢基因功能的相对丰度极显著高于Ⅰ组(P<0.01),氨基酸代谢基因功能的相对丰度显著高于Ⅰ组(P<0.05),能量代谢基因功能的相对丰度较Ⅰ组有增加的趋势(P=0.073),而细胞运动基因功能的相对丰度较Ⅰ组有减少的趋势(P=0.085)。

图8 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物基因功能的影响
3 讨 论
3.1 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肌肉品质的影响
肌肉品质能体现肉用畜禽的经济价值。肌肉中水分含量越高,保水性越强,肌肉的嫩度和多汁性等性状越好[8]。蛋白质是肌肉中的主要养分,含量越高,肉品质越好。肌内脂肪是评定肉品质的关键因素之一,与肌肉的嫩度、多汁性和风味有着密切的联系[9]。于素红等研究报道,日粮中添加酵母培养物5.0和7.5 g·kg-1,肉鸡胸肌和腿肌粗蛋白质的含量无显著差异[9]。路则庆等研究报道,大麦-高粱型日粮中添加酵母培养物0.8%对肥育猪背最长肌水分和肌内脂肪的含量无影响[3]。本试验日粮中添加新型酿酒酵母培养物底物2.5%和新型酿酒酵母培养物2.5%对樱桃谷鸭胸肌和腿肌的水分和粗蛋白质的含量均无影响,而新型酿酒酵母培养物2.5%组樱桃谷鸭胸肌肌内脂肪的含量高于对照组和新型酿酒酵母培养物底物2.5%组。
新型酿酒酵母培养物中还原型谷胱甘肽的含量较高,由于含有半胱氨酸残基,还原型谷胱甘肽易与自由基结合,转化成氧化型谷胱甘肽,提高机体的抗氧化能力[10]。此外,代谢组数据显示,新型酿酒酵母培养物中原花青素的含量高于新型酿酒酵母培养物底物组,原花青素由于含有多个酚性羟基,可以竞争性地与自由基结合,抑制脂质氧化反应,从而保护机体免受氧化损伤[11]。新型酿酒酵母培养物2.5%组樱桃谷鸭胸肌肌内脂肪的含量高于对照组和新型酿酒酵母培养物底物2.5%组,原因可能是新型酿酒酵母培养物中还原型谷胱甘肽和原花青素的含量较高,能减少机体的氧化应激,抑制肌内脂肪的氧化,从而改善肌肉品质。
pH、滴水损失率和肉色是反映肉品质的重要指标。pH反映动物屠宰后肌糖原的降解速度。一定范围内,pH升高,肌肉系水力增强,嫩度越好[12]。滴水损失率是在外力(如加压、冷冻和储藏等)条件下,肌肉维持固有水分的能力[9]。肉色可通过亮度、红度和黄度进行鉴定,一般红度越大,亮度和黄度越小,肉品质越好。于素红等研究报道,日粮中添加酵母培养物5 g·kg-1可显著降低肉鸡胸肌和腿肌的滴水损失率,但对胸肌pH45min和pH24h无显著影响[9]。试验日粮中添加新型酿酒酵母培养物底物2.5%和新型酿酒酵母培养物2.5%对樱桃谷鸭胸肌pH45min、pH24h、滴水损失率和肉色均无影响,但2.5%新型酿酒酵母培养物组樱桃谷鸭腿肌pH45min和pH24h高于对照组和新型酿酒酵母培养物2.5%底物组,并且新型酿酒酵母培养物2.5%组樱桃谷鸭腿肌的滴水损失率较新型酿酒酵母培养物底物2.5%组有降低的趋势。新型酿酒酵母培养物中还原型谷胱甘肽的含量较高,抗氧化能力增强,进而提高细胞膜的屏障功能,减少水分外流,降低肌肉的滴水损失率,增强系水力[10]。抗氧化能力增强还会减少机体的氧化应激,从而减少促肾上腺皮质激素的含量,抑制糖酵解过程中各催化酶的活性,减少乳酸的产生,因此提高腿肌pH[13]。有研究表明,PPAR-δ是过氧化物酶体增殖物激活受体γ辅助活化因子1α(PGC-1α)的上游调控因子,能与其他的转录因子共同作用促进PGC-1α的表达,而PGC-1α可诱导Ⅰ型肌纤维特异基因的表达,增加Ⅰ型肌纤维的数量,抑制pH的下降,从而改善肌肉品质[14]。
3.2 日粮中添加新型酿酒酵母培养物对樱桃谷鸭肠道微生物的影响
Illumina MiSeq测序能够比较准确全面地分析肠道微生物的多样性,在微生物研究中应用越来越广泛[15]。本试验日粮中添加新型酿酒酵母培养物2.5%对樱桃谷鸭肠道细菌的Alpha多样性无影响,可能与新型酿酒酵母培养物的发酵菌株和发酵时间有关。Si等研究发现,日粮中添加酵母细胞壁Biolex MB40 0.2%,裸颈鸡肠道细菌的Alpha多样性无变化,而添加0.2%酵母细胞壁Leiber ExCel,裸颈鸡肠道细菌的Alpha多样性下降[16]。孙喆等研究发现,随着日粮中添加的酵母培养物发酵时间的延长,肉鸡肠道细菌的Alpha多样性呈现先降低后升高的趋势[17]。
Vasaï等通过16S rRNA焦磷酸测序检测绿头鸭和番鸭的盲肠微生物区系发现绿头鸭和番鸭在门水平上主要由厚壁菌门、拟杆菌门、放线菌门和变形菌门组成[18]。本试验对照组、新型酿酒酵母培养物底物2.5%组和新型酿酒酵母培养物2.5%组樱桃谷鸭肠道细菌的优势菌门为厚壁菌门、拟杆菌门、变形菌门和梭杆菌门,说明相同种属间肠道菌群组成存在一定的相似性。新型酿酒酵母培养物底物2.5%组和新型酿酒酵母培养物2.5%组樱桃谷鸭肠道细菌中拟杆菌门的相对丰度高于对照组,可能与酿酒酵母培养物底物和酿酒酵母培养物中粗纤维的含量较高有关。拟杆菌门是动物体内酵解碳水化合物的主要菌门,拟杆菌门的相对丰度增加,降解纤维素的能力可能增强,能为微生物提供更多的营养物质以促进其生长[19]。Upadrasta等研究发现,日粮中添加苹果酒酵母可增加断奶仔猪粪便中拟杆菌门的相对丰度,此结论与本文一致[20]。放线菌门的主要功能是产生抗生素,链霉素、红霉素和卡那霉素等均由放线菌门中的链霉菌产生。此外,具有营养、抑菌、免疫调节和抗癌等生理功能的双歧杆菌也隶属于放线菌门[21]。变形菌门在动物肠道中含量较丰富,且形态多样,但变形菌门中许多细菌如沙门氏菌、霍乱弧菌和幽门螺杆菌等均被证实是致病菌。变形菌门相对丰度的增加不仅会打乱微生物群落结构的平衡,还可能使机体患病的机率大幅提高[22]。新型酿酒酵母培养物底物2.5%组樱桃谷鸭肠道细菌中变形菌门的相对丰度极显著低于对照组,而新型酿酒酵母培养物2.5%组与对照组无显著差异。说明日粮中添加新型酿酒酵母培养物底物2.5%和新型酿酒酵母培养物2.5%通过增加拟杆菌门和放线菌门等有益菌的相对丰度抑制或稳定了变形菌门中病原菌相对丰度的增加,维持樱桃谷鸭肠道的健康。
在属水平上,2.5%新型酿酒酵母培养物组樱桃谷鸭肠道细菌中拟杆菌属的相对丰度高于对照组,Erysipelatoclostridium的相对丰度低于对照组。拟杆菌属的脆弱拟杆菌能激活Toll样受体,通过分泌一种微生物多糖A可抵制Helicobacter hepaticus诱导的结肠炎,增强机体免疫力[23-24]。Erysipelatoclostridium是一种条件性致病菌,日粮中添加新型酿酒酵母培养物2.5%可降低Erysipelatoclostridium的相对丰度,减小樱桃谷鸭患病的可能性[25]。日粮中添加新型酿酒酵母培养物能改善樱桃谷鸭的肠道菌群结构可能与新型酿酒酵母培养物细胞壁组成甘露寡糖和β-葡聚糖有关。
甘露寡糖可吸附在肠道表面,为病原菌提供特定的结合位点,竞争性地抑制病原菌在肠道表面的定植[26]。Mourao等研究发现,日粮中添加甘露寡糖可显著降低育肥兔盲肠大肠杆菌和肠球菌的数量,改善肠道微生物区系[27]。Wang等研究发现,β-葡聚糖能极显著增加人体粪便中拟杆菌属的相对丰度,并且普氏菌属的相对丰度有增加的趋势[28]。
此外,肠道菌群结构发生改变还可能与新型酿酒酵母培养物富含有机酸有关,肠道中的有益菌能在酸性环境(5.8~6.2)中较好地生存,而致病菌大多存在于pH≥7的中性或偏碱性环境中[29]。Ozduven等研究发现,日粮中添加有机酸可显著增加肉鸡盲肠乳酸菌的含量,降低大肠杆菌的含量,调节肠道菌群组成[30]。
PICRUSt分析弥补了16S rDNA测序只能检测微生物的组成,无法预知微生物功能的缺陷,目前已成为一种预测细菌和古细菌代谢功能的重要工具。本试验PICRUSt分析结果显示,新型酿酒酵母培养物2.5%组樱桃谷鸭肠道细菌核苷酸代谢基因功能高于对照组,氨基酸代谢基因功能高于对照组,能量代谢和细胞运动基因功能组间差异不明显。但新型酿酒酵母培养物2.5%组樱桃谷鸭肠道细菌能量代谢基因功能较对照组有增加的趋势,而细胞运动基因功能较对照组有减少的趋势。Fang等研究发现,细菌能量代谢、氨基酸代谢、核苷酸代谢和碳水化合物代谢等基因功能的相对丰度与肌内脂肪的含量呈正相关,而细胞运动和膜转运等基因功能的相对丰度与肌内脂肪的含量呈负相关[31]。因此,日粮中添加新型酿酒酵母培养物2.5%能增加樱桃谷鸭胸肌肌内脂肪的含量,可能与该组樱桃谷鸭肠道细菌核苷酸代谢、氨基酸代谢和能量代谢基因功能增强,细胞运动基因功能减弱有关。
4 结论
日粮中添加新型酿酒酵母培养物2.5%可提高樱桃谷鸭胸肌肌内脂肪的含量,提高腿肌pH45min和pH24h,改善肌肉品质。日粮中添加新型酿酒酵母培养物可能导致有利于改善肉品质的细菌基因功能相对丰度的变化,进而改善肌肉品质。
