酸菜水中细菌多样性研究
2019-01-16折米娜望诗琪赵慧君郭壮廖华张振东
折米娜,望诗琪,赵慧君,郭壮,2,廖华,张振东*
(1.湖北文理学院食品科学技术学院,鄂西北传统发酵食品研究所,湖北 襄阳 441053;2.恩施市公共检验检测中心,湖北 恩施 445000;3.恩施市农业局,湖北 恩施 445000)
酸菜,是一种流行于东北、四川、贵州和云南等地区的传统发酵食品[1],通常以白菜或青菜为主要原料,经微生物自然发酵而成。由于制作环境相对开放,因而酸菜中微生物种类较为丰富[2],且研究表明不同地区酸菜中乳酸菌的群系存在较大差异。东北地区自然发酵酸菜中的乳酸菌主要为植物乳杆菌(Lactobacillusplantarum)、短乳杆菌(Lactobacillusbrevis)、罗伊氏乳杆菌(Lactobacillusreuter)和米酒乳杆菌(Lactobacillussakei)[3],而云南地区自然发酵酸菜中的乳酸菌主要为植物乳杆菌(Lactobacilllusplantarum)、短乳杆菌(Lactobacillusbrevis)和肠膜明串珠菌(Leuconostocmesenteroides)[4],亦有报道指出四川泡菜中的优势菌群为植物乳杆菌(Lactobacillusplantarum)、肠膜明串珠菌(Leuconostocmesenteroides)、短乳杆菌(Lactobacillusbrevis)和耐乙醇片球菌(Pediococcusethanoliduran)[5]。作为秦巴山区生物多样性保育重要生态功能区,恩施土家族苗族自治州亦有制作和食用酸菜的习俗,然而目前关于该地区酸菜中微生物多样性的研究报道尚少。
分子生物学技术被广泛应用于微生物群落结构多样性的研究,其中Illumina Miseq第二代高通量测序技术是直接将样品的宏基因组扩增后进行测序,从而获得不同环境下对应微生物的群落结构,不仅可以检测到低丰度的微生物而且结果准确可靠[6]。聚合酶链式反应(polymerase chain reaction,PCR)结合变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)是一种能快速、准确和高效鉴定自然环境或人工环境中微生物的种类,进而反映微生物群落结构组成的分析技术[7]。Illumina Miseq技术和PCR-DGGE技术均可以克服传统纯培养微生物学手段耗时长和工作量大等缺点,二者被广泛应用于肠道微生物[8,9]、环境微生物[10,11]和食品微生物等领域[12,13]。
本研究以恩施土家族苗族自治州酸菜水为研究对象,采用Miseq高通量测序技术结合PCR-DGGE技术对细菌和乳酸菌多样性进行了解析,并利用传统微生物学手段对酸菜水中的乳酸菌进行了分离鉴定。通过本研究的开展,以期为恩施地区传统发酵蔬菜的产业化提供数据支撑,同时为后续发酵食品中乳酸菌的开发提供菌株支持。
1 材料与方法
1.1 材料与试剂
样品:采购于恩施市土桥坝菜市场。
试剂:三羟甲基氨基甲烷、乙酸、乙二胺四乙酸、聚丙烯酰胺、N,N-亚甲基二丙烯酰胺、葡萄糖、蛋白胨、牛肉膏、乙酸钠、酵母粉、柠檬酸二铵、磷酸氢二钾、七水合硫酸镁、一水合硫酸锰和吐温80:均为分析纯,国药集团化学试剂有限公司;D5625-01 DNA提取试剂盒:美国OMEGA公司;DNA Marker(FERMENTAS)和PCR清洁试剂盒(AXYGEN):京科博汇智生物科技发展有限公司;2PCR×mix:南京诺唯赞生物科技有限公司;rTaq、dNTPmix、pMD18-T vector:大连宝生物技术有限公司(TaKaRa),由武汉天一辉远生物科技有限公司合成;PCR引物合成和测序:由武汉天一辉远生物科技有限公司完成。
1.2 仪器与设备
Miseq PE300高通量测序平台 美国Illumina公司;R920机架式服务器 美国DELL公司;CT15RE冷冻离心机 日本HITACHI公司;Veriti 96-well thermal cycler PCR仪 美国AB 公司;NanoDrop 2000超微量分光光度计 美国Thermo Fisher公司;DCodeTMSystem 美国Bio Red公司;DYY-12电泳仪 北京六一仪器厂;FluorChem FC3 美国FluorChem公司;Bio-5000 plus扫描仪 上海中晶科技有限公司;DG250厌氧工作站 英国DWS公司。
1.3 试验方法
1.3.1 样品总DNA提取与检测
采用OMEGA D5625-01试剂盒提取3个酸菜水样品中的总DNA,提取成功后用0.8%琼脂糖凝胶进行电泳检测并测定其DNA的浓度。
1.3.2 样品细菌16S rRNA PCR扩增及Miseq高通量测序
扩增体系:4 μL 5×PCR缓冲液,2 μL 2.5 mmol/L dNTP Mix,0.8 μL 5 μmol/L正向引物,0.8 μL 5 μmol/L反向引物,0.4 μL 5 U/μL Taq酶,10 ng DNA模板,ddH2O补充至20 μL。其中引物为338F/806R。
扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,循环30次;72 ℃延伸10 min。PCR扩增产物用1.0%琼脂糖凝胶电泳检测合格后将浓度稀释至100 nmol/L,寄至上海美吉生物医药科技有限公司进行Miseq高通量测序。
1.3.3 序列拼接及质量控制
下机序列参照王玉荣等[14]和蔡宏宇等[15]的方法进行质控,同时使用QIIME(V1.7.0)分析平台进行生物信息学分析。使用PyNAST软件将所有的序列对齐后,采用两步UCLUST算法分别以100%和97%的相似度进行序列划分并建立分类操作单元(operational taxonomic units,OTU),从每个OTU中选取1条代表性序列,使用RDP(ribosomal database project)和Greengenes数据库对序列进行同源性比对,通过对数据的整理确定各样品种属分类学地位,进而对酸菜水中的Chao 1指数和Shannona指数等指标进行计算。将在3个样品中均存在的OTU定义为核心OTU。
1.3.4 基于PCR-DGGE技术酸菜水中乳酸杆菌多样性解析
将1.3.1中DNA浓度调整一致后作为模板进行PCR扩增。乳杆菌16S rDNA基因片段PCR扩增所用的引物为:正向引物为LacF-GC(5'-CGC CCG GGG CGC GCC CCG GGC GGC CCG GGG GCA CCG GGG GCT CCT ACG GGA GGC AGC AGT-3'),反向引物为LacR(5'-GTA TTA CCG CGG CTG CTG GCA C-3')。PCR扩增体系为2.5 μL 10×PCR Buffer(含Mg2+),2 μL dNTP(2.5 mol/L),0.5 μL正向引物(10 mmol/L),0.5 μL负向引物(10 mmol/L),0.5 μL rTaq(5 U/μL),1 μL DNA模板,ddH2O补充至25 μL。PCR反应条件为95 ℃ 4 min预变性,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环,最后在72 ℃延伸10 min。PCR扩增结束后,扩增产物用2%的琼脂使用变性剂线性梯度为35%~52%,浓度为8%的聚丙烯酰胺(40%丙烯酰胺/N,N-亚甲基二丙烯酰胺)对样品DNA的PCR产物进行变性梯度凝胶电泳。DGGE条件:点样量为10 μL,电泳液为0.5 TAE,电泳温度为60 ℃,电压与时间为120 V,80 min,然后80 V,13 h。电泳结束后,对DGGE胶进行硝酸银染色[16],使用扫描仪对凝胶电泳图进行观察拍照,并对优势条带进行切胶并回收。回收的条带用不含GC夹子的LacF和LacR引物进行扩增,扩增体系及条件与上述方法相同。将PCR扩增产物进行清洁纯化,并与PMD18-T载体连接后转化到大肠杆菌TOP10中,经单克隆鉴定为阳性后送往武汉天一辉远生物科技有限公司进行测序。
将测序结果除去两端载体的序列,然后使用BioEdit软件将序列进行拼接。拼接结果在NCBI BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中比对查询,找出相似度高的相似序列用MEGA 5.0软件制作系统发育树。
1.3.5 酸菜水中乳酸菌的分离与鉴定
将酸菜水样品进行倍比稀释(稀释度为10-5,10-6,10-7),涂布于含有1.5% CaCO3的MRS固体培养基上,置于厌氧工作站在37 ℃培养48 h。挑取有透明圈的菌落进行划线纯化,并进行革兰氏染色试验及菌株的保藏。用CTAB法提取各纯化菌株的DNA[17],使用通用引物27F(5'-AGA GTT TGA TCC TGG CTC AG-3')和1495R(5'-CTA CGG CTA CCT TGT TAC GA-3')进行16S rRNA扩增。
PCR扩增体系:2.5 μL 10×PCR Buffer(含Mg2+),2 μL dNTP(2.5 mol/L),0.5 μL 27 f(10 mmol/L),0.5 μL 1495 r(10 mmol/L),0.5 μL rTaq(5 U/μL),0.5 μL DNA模板,ddH2O补充至25 μL。
PCR扩增条件:95 ℃ 4 min预变性,95 ℃变性1 min,55 ℃ 1 min,72 ℃ 90 s,30个循环,72 ℃延伸10 min。PCR扩增结束后,取扩增产物2.5 μL用1%的琼脂糖凝胶电泳检测。检测合格后,将PCR扩增产物进行清洁纯化,并与PMD18-T载体连接转化到大肠杆菌TOP10中,经单克隆鉴定为阳性后送往武汉天一辉远生物科技有限公司进行测序。测序结果分析同1.3.5。
1.4 数据处理
通过Origin 8.5软件进行各项数据的统计并作图,热图由Matlab 2010b绘制,系统发育树由BioEdit软件和MEGA 5.0软件共同绘制。
2 结果与分析
2.1 序列丰富度和多样性分析
本研究首先将3个恩施地区酸菜水进行16S rRNA测序,其结果及各分类地位数量见表1。
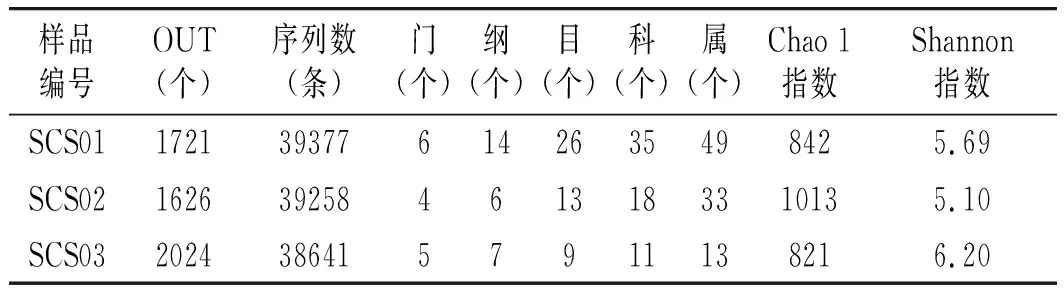
表1 样品16S rRNA测序情况及各分类地位数量
注:计算每个样品Chao 1和Shannon指数时,样品的测序量均为30510条序列。
本研究采集的3个酸菜水样品共产生了117276条16S rRNA序列。根据100%的相似性进行序列划分共得到60342条代表性序列,根据序列的97%相似性进行OTU划分后,共得到4473个OTU,每个样品平均1419个。由表1可知,SCS02样品具有最大的细菌物种丰度,其Chao 1指数为1013,而SCS03样品细菌多样性最高,其Shannon指数为6.20。
2.2 基于不同分类地位酸菜水样品核心细菌菌群相对含量分析
纳入本研究的序列被鉴定为7个门、15个纲、29个目、38个科和58个属,其中只有0.37%的序列不能鉴定到属水平。本研究的3个酸菜水样品中平均相对含量>1%的细菌门分别为硬壁菌门(Firmicutes)和变形菌门(Proteobacteria),其相对含量分别为97.78%和1.96%。值得一提的是,3个样品中隶属于硬壁菌门(Firmicutes)的细菌相对含量分别为98.10%,95.28%,99.95%。基于属水平3个酸菜水样品中优势细菌的相对含量见图1。
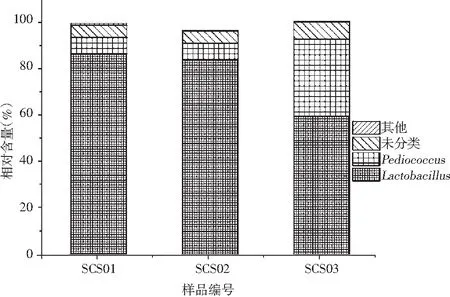
图1 酸菜水中优势细菌属相对含量的比较分析
由图1可知,优势细菌属分别为隶属于硬壁菌门(Firmicutes)的乳酸杆菌属(Lactobacillus)和片球菌属(Pediococcus),其平均相对含量分别为76.25%和15.80%。通过采用454焦磷酸测序技术,李欣蔚等对16 份东北传统自然发酵酸菜汁样品中的细菌多样性进行了解析,研究发现厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为其优势细菌门,而乳杆菌属(Lactobacillus)、假单胞菌(Pseudomonas)和明串珠菌属(Leuconostoc)为其优势菌属[18]。利用构建16S rRNA基因文库的方法,曹碧璇等对辽宁地区农家自然发酵酸菜液中的微生物多样性进行了研究,结果发现乳酸杆菌属(Lactobacillus)、片球菌属(Pediococcus)和枸橼酸杆菌属(Citrobacter)是酸菜发酵液中的优势菌[19]。利用Illumina高通量测序技术,佟婷婷对四川农家泡菜中的细菌多样性进行了研究,结果发现四川地区泡菜中的优势菌是乳杆菌属(Lactobacillus),且含量达到80%~85%[20]。利用PCR-DGGE技术,乌日娜对东北地区发酵酸菜中的微生物多样性进行解析时发现乳酸杆菌属(Lactobacillus)为其中的优势细菌属[21]。由此可见,虽然不同地区制作酸菜的工艺和原料不同,但是乳酸杆菌均为其优势细菌属。
本研究进一步统计了OTU在3个样品中出现的次数,结果发现出现1次和2次的OTU分别为3759个和530个,分别占OTU总数的84.04%和11.85%,所包含的序列数为8946条和25678条。同时核心OTU为184个,占OTU总数的4.11%,所包含的序列数为82437条,经分析发现在184个核心OTU之中有11个OTU的相对含量大于1%。本研究进一步对11个核心OTU在3个酸菜水样品中的相对含量进行了分析,结果见图2。
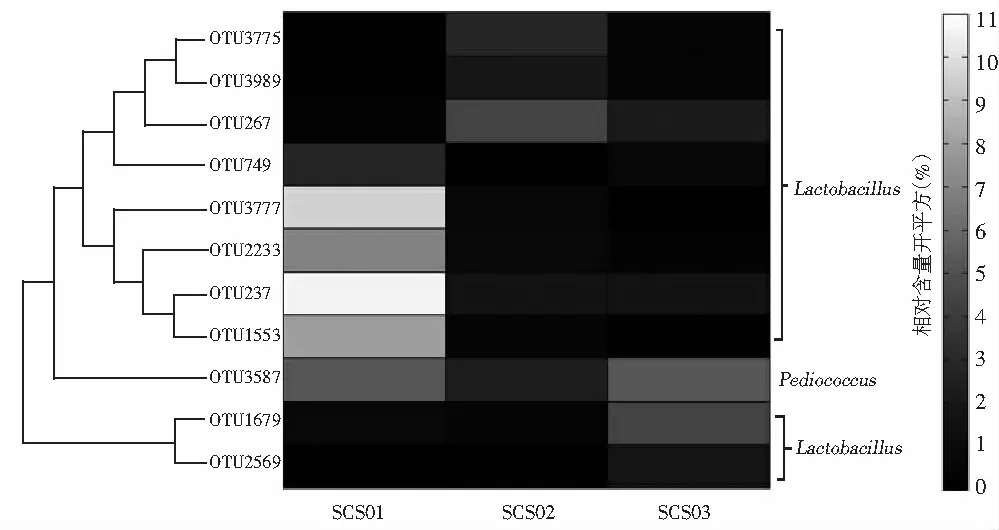
图2 平均相对含量大于1.0%的核心OTU在酸菜水样品中相对含量的热图
由图2可知,在11个核心OTU中,10个隶属于乳酸杆菌属(Lactobacillus),只有OTU3578隶属于片球菌属(Pediococcus),11个核心OTU的累计相对含量达47.68%。部分OTU在3个样品中的相对含量差异较大,其中OTU3578在SCS01和SCS02中的相对含量分别为5.24%和5.69%,而在SCS03中的相对含量为27.17%;OTU1679在SCS01和SCS02中的相对含量分别为0.77%和0.17%,而在SCS03中的相对含量为19.27%。
2.3 酸菜水中乳杆菌DGGE图谱及系统发育分析
在对酸菜水样品进行Miseq高通量测序后,本研究进一步使用PCR-DGGE技术对3个样品乳酸杆菌属的多样性进行了分析。由于不同样品乳酸杆菌的群落结构不同,在变性梯度凝胶电泳后会分离出数目不等的条带。分离出的条带数目越多,说明样品微生物多样性越丰富,同时各条带的亮度在一定程度上亦能说明微生物的丰度存在差异[22]。酸菜水中乳酸杆菌的PCR-DGGE电泳图见图3。
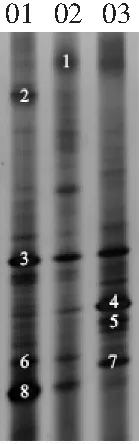
图3 酸菜水中乳酸杆菌PCR-DGGE电泳图
注:01,02,03分别为SCS01,SCS02,SCS03。
由图3可知,指纹图谱中共有8条条带较为明亮,其中条带3和条带4在所有样品中均存在,但亮度不一致;条带6和条带8存在于SCS01和SCS02中,亮度亦不一致;条带1仅存在于SCS02样品中,条带2仅存在于SCS01样品中,条带5和条带7仅存在于SCS03样品中。由此可见,不同酸菜样品间乳酸杆菌的多样性亦存在一定的差异。本研究进一步对各条带进行了序列分析,结果见表2。

表2 酸菜水中乳杆菌DGGE条带比对结果
由表2可知,8个特异性条带均属于乳酸杆菌属,且各条带序列与现有数据库中已知16S rDNA序列都具有较高的相似度。其中条带2,3,8为植物乳杆菌(Lactobacillusplantarum),条带4和条带5为发酵乳杆菌(Lactobacillusfermentum),条带1为面包乳杆菌(Lactobacilluspanis),条带6为短乳杆菌(Lactobacillusbrevis),条带7为Lactobacillusrennini。本研究进一步将鉴定结果与数据库中的模式菌进行了系统发育树的构建,结果见图4。
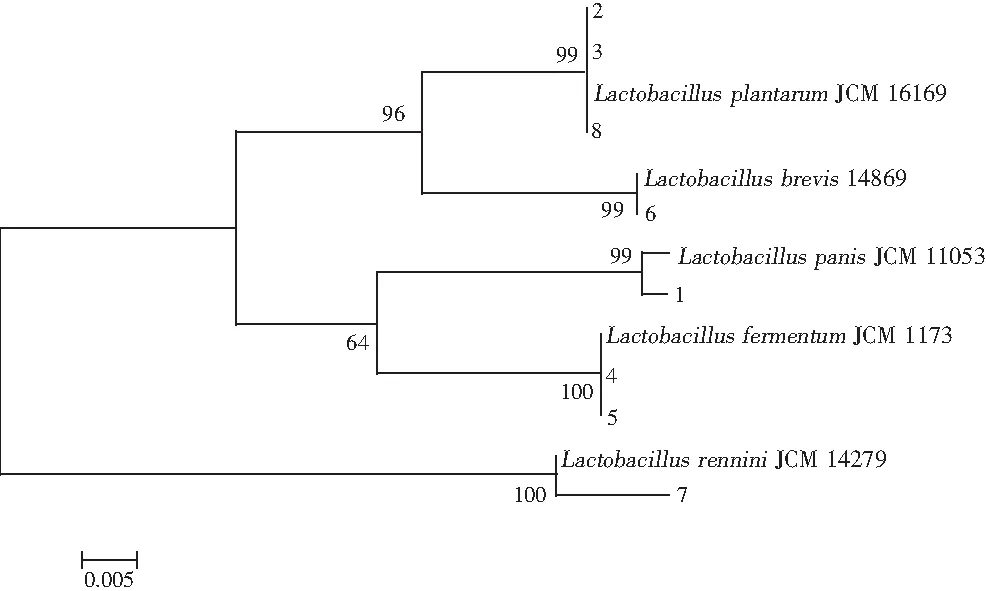
图4 系统发育树
由图4可知,系统发育树分为两大支,条带1,2,3,4,5,6,8均在同一分支上,这表明上述菌株的亲缘关系较近,而条带7在另一分支上,这可能是由于该菌株的进化关系较其他菌株较远导致的。武俊瑞等[23]利用PCR-DGGE技术对东北自然发酵酸菜中乳酸菌的多样性进行了分析,在5 份酸菜中共鉴定出9 株乳酸菌,其中优势乳酸菌是植物乳杆菌(Lactobacillusplantarum)和短乳杆菌(Lactobacillusbrevis),而周金明等[24]利用PCR-DGGE技术对不同发酵时期酸菜发酵液微生物菌群进行了研究,结果发现植物乳杆菌(Lactobacillusplantarum)和清酒乳杆菌(Lactobacillussakei)是酸菜发酵过程中的优势菌,其研究的结果与本研究相同。
2.4 酸菜水中乳酸菌分离鉴定结果
本研究进一步使用含有1.5% CaCO3的MRS培养基对3个酸菜水样品进行了乳酸菌的分离鉴定,测序比对结果见表3。
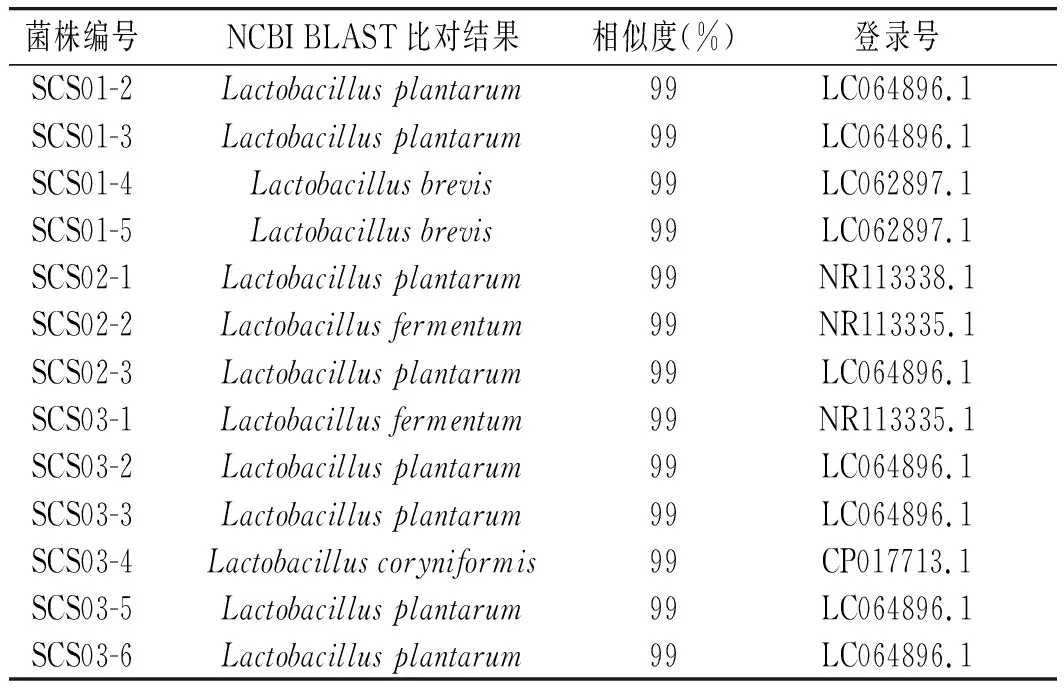
表3 酸菜水中16S rDNA基因序列比对结果
由表3可知,从3个样品中共分离出8株植物乳杆菌(Lactobacillusplantarum)、2株短乳杆菌(Lactobacillusbrevis)、2株发酵乳杆菌(Lactobacillusfermentum)和1株棒状乳杆菌(Lactobacilluscoryniformis),这进一步证实恩施地区酸菜水中的乳酸菌具有较高的多样性。
3 结论
本研究采用Miseq高通量测序技术与PCR-DGGE技术相结合的方法对恩施地区酸菜水中的微生物多样性进行了解析,同时利用传统微生物纯培养方法分离乳酸菌。结果发现,酸菜水样品中的细菌微生物主要是隶属于硬壁菌门的乳杆菌属和片球菌属,其中乳酸杆菌属是优势属,经PCR-DGGE和纯培养的方式进一步发现酸菜水中的优势乳酸菌为植物乳杆菌。通过本研究可知传统发酵酸菜中蕴含着丰富的微生物资源,其中以乳酸菌最为丰富,而乳酸菌作为一种益生菌被广泛应用于各类食品加工中,这为传统发酵食品的产业化生产提供了有利条件。
