14359例患者痰培养病原菌分布及细菌耐药性分析
2019-01-15李杰芬储从家李雪梅孙丽
李杰芬 储从家 李雪梅 孙丽

【摘要】 目的:對住院患者下呼吸道病原菌的分布及耐药性进行分析,为临床合理选择用药提供依据。方法:选取14 359例患者的痰标本作为研究对象,对痰标本进行常规培养、菌种鉴定和药敏试验。结果:在所有送检的14 359例痰标本中总计分离出6 339株病原菌,检出率为44.1%,排除重复菌株共分离出病原菌4 546株,其中革兰阴性杆菌2 330株,占51.3%,革兰阳性球菌741株,占16.3%,真菌1 475株,占32.4%。药敏结果分析显示,在革兰阴性杆菌中,克雷伯菌属对阿莫西林/克拉维酸、呋喃妥因、亚胺培南、美罗培南和头孢唑啉耐药率均高于大肠埃希菌,差异均有统计学意义(P<0.05);大肠埃希菌对氨曲南、复方新诺明、环丙沙星、哌拉西林、庆大霉素、四环素、头孢吡肟、头孢曲松、左旋氧氟沙星的耐药率均高于肺炎克雷伯菌,差异均有统计学意义(P<0.05)。大肠埃希菌对四环素的耐药率,不动杆菌属对亚胺培南和头孢他啶的耐药率,以及铜绿假单胞菌对阿莫西林/克拉维酸、复方新诺明和头孢曲松的耐药率均显著高于其余四种菌,差异均有统计学意义(P<0.05)。在革兰阳性球菌中,凝固酶阴性葡萄球菌和金黄色葡萄球菌对16种抗菌药物的耐药率除万古霉素、奎奴普丁/达福普汀、利奈唑胺和替加环素均敏感,两者对青霉素、呋喃妥因和克林霉素的耐药率比较,差异均无统计学意义(P>0.05);凝固酶阴性葡萄球菌对其余抗生素的耐药率均高于金黄色葡萄球菌,差异均有统计学意义(P<0.05)。1 475株真菌对5种抗真菌药物5氟胞嘧啶、两性霉素B、氟康唑、伊曲康唑和伏立康唑的耐药率分别为6.0%、0、3.2%、4.4%、0。在克雷伯菌属中有94株产ESBLs,产酶率为16.1%,在大肠埃希菌中有283株产ESBLs,产酶率为54.5%;在金黄色葡萄球菌中有45株为耐甲氧西林金黄色葡萄球菌,占19.3%;在凝固酶阴性葡萄球菌中有213株为耐甲氧西林凝固酶阴性葡萄球菌,占87.7%;在检出的276株流感嗜血杆菌中有168株产β-内酰胺酶,产酶率为60.9%。结论:下呼吸道病原菌主要以克雷伯菌属、大肠埃希菌等革兰阴性杆菌,凝固酶阴性葡萄球菌和金黄色葡萄球菌等革兰阳性球菌,白假丝酵母菌为主,各种菌对不同抗菌药物显示不同的耐药性,临床上应根据病原菌的分布情况和耐药性分析,并结合临床信息合理选用抗菌药物。
【关键词】 痰培养 菌种鉴定 药敏试验 耐药率
[Abstract] Objective: To observe and analyze the distribution and drug resistance of pathogenic bacteria in respiratory tract of patients, so as to provide basis of reasonable selection of clinical drugs. Method: Sputum samples from 14 359 patients were selected as the objects of study, and the sputum samples were routinely cultured, identified and tested for drug susceptibility. Result: Among the 14 359 cases of sputum specimens, a total of 6 339 strains of pathogens were isolated and the detection rate was 44.1%, eliminate repetitive strain, a total of 4 546 strains of pathogens were isolated, among them, there were 2 330 strains of gram negative bacilli, accounting for 51.3% and there were 741 strains of gram-positive cocci, accounting for 16.3%. 1 475 strains of Fungi were detected, accounting for 32.4%. Drug susceptibility analysis showed that in gram-negative bacilli, the drug resistance rates of klebsiella to Amoxicillin/Clavulinic acid, Nitrofurantoin, Imipenem, Meropenem and Cefazoline were all higher than that of escherichia coli, with statistically significant differences (P<0.05). The drug resistance rates of escherichia coli to Ammotramine, Cotrimoxazole, Ciprofloxacin, Piperacillin, Gentamycin, Tetracycline, Cefepime, Ceftriaxone and Levofloxacin were all higher than those of klebsiella pneumoniae, with statistically significant differences (P<0.05). The drug resistance rate of escherichia coli to Tetracycline, the drug resistance rate of acinetobacter to Imipenem and Ceftazidine, and the drug resistance rate of pseudomonas aeruginosa to Amoxicillin/Clavulic acid, Compound Neomine and Ceftriaxone were all significantly higher than those of the other four bacteria, with statistically significant differences (P<0.05). Among gram-positive coccus, coagulase-negative staphylococcus and staphylococcus aureus were sensitive to the drug resistance rates of 16 antibacterial drugs except Vancomycin, Quinopudine/Dafoprotin, Linezolid and Tegacycline, the differences in drug resistance rates of Penicillin, Furantoin and Clindamycin were not statistically significant (P>0.05). The drug resistance rate of coagulase negative staphylococcus to other antibiotics was higher than those of staphylococcus aureus, the differences were statistically significant (P<0.05). The drug resistance rates of 1 475 strains to five antifungal drugs, 5-fluorouracil, Amphotericin B, Fluconazole, Itraconazole and Voriconazole were 6.0%, 0, 3.2%, 4.4% and 0, respectively. In Klebsiella pneumoniae, 94 strains produced ESBLs and the enzyme production rate was 16.1%. In Escherichia coli, 283 strains produced ESBLs and the enzyme production rate was 54.5%. In Staphylococcus aureus, 45 strains were methicillin resistant staphylococcus aureus, accounting for 19.3%. While in coagulase-negative staphylococcus, 213 strains were methicillin resistant coagulase-negative staphylococcus, accounting for 87.8%. In 276 strains of haemophilus influenzae, 168 strains produced beta-lactamase and the enzyme production rate was 60.9%. Conclusion: The results of sputum culture showed that,in the lower respiratory tract infection,the main pathogens were the gram-negative bacilli such as Klebsiella pneumoniae and Escherichia coli, the gram-positive cocci such as Staphylococcus aureus and coagulase-negative staphylococcus, the fungi such as candida albicans, all kinds of bacteria to antimicrobial drugs showed different resistance, the reasonable use of antibiotics in the clinical practices should be based on the pathogenic bacteria distribution and the results of the drug sensitivity test in combination with clinical information.
3 讨论
3.1 研究的意义、影响因素及创新性 下呼吸道感染是常见的呼吸道感染疾病,痰培养对于诊断下呼吸道感染具有重要的临床应用价值。但由于痰标本的取材受多种因素的影响,所以要得到有临床意义的培养结果,痰标本的取材就显得尤为重要,已有多篇文献对痰培养标本的留取及质量控制进行了研究和阐述[2-4]。本次研究中笔者除对所有采集的痰标本均要求用清水反复漱口,排除和减少正常菌群和定值菌对痰标本的污染外,还对每份痰标本均制备痰涂片,根据鳞状上皮细胞和白细胞的数量对不合格标本进行筛选,初步判断感染病原菌的类型,在接种前对合格标本用痰稀释液进行预处理,使痰液均质化,提高痰液半定量培养检测的准确性,与次日固体培养基上的菌落观察相结合,筛选出有临床意义的菌落进行下一步实验,提高了痰培养报告的最终准确性和临床符合性。当然,随着抗生素的广泛应用和住院时间的延长(特别是重症患者),以及气管插管等侵入性操作的應用,均会影响定植的菌群,导致阴性杆菌数量的增加,这些因素均会影响痰培养作为一个诊断实验的准确性和特异性,所以痰培养结果还需要与临床信息相结合进行解释。
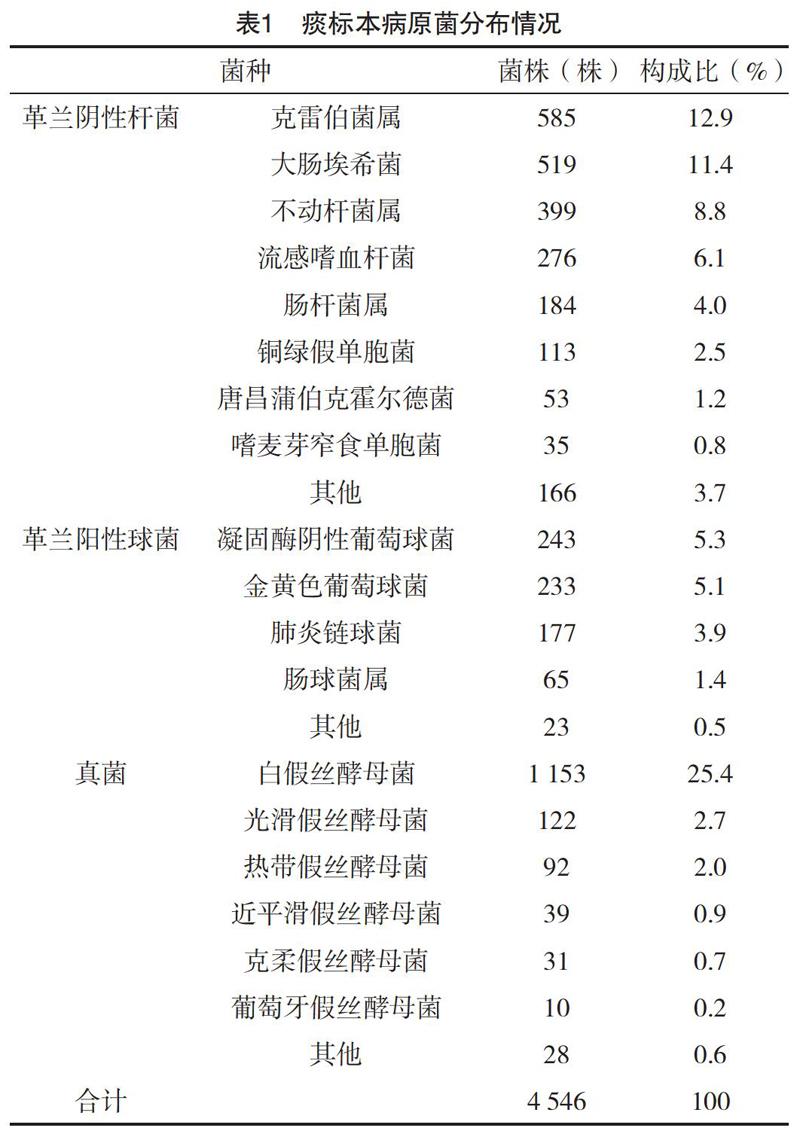
3.2 痰标本病原菌的分布 由表1看出,本次痰培养病原菌主要以革兰阴性杆菌、革兰阳性球菌和真菌为主,在分离的4 546株病原菌中,革兰阴性杆菌最多,占51.3%,低于孙利明[5]报道的69.3%,其中前五位为克雷伯菌属、大肠埃希菌、不动杆菌属、流感嗜血杆菌和肠杆菌属;其次为真菌和革兰阳性球菌,分别占32.4%和16.3%,真菌以白色假丝酵母菌居多,占所有分离真菌的78.2%(1 153/1 475);由于抗生素及介入性诊疗措施、各种免疫抑制剂等的广泛应用,临床分离的葡萄球菌在逐渐增加,本研究显示,所分离的革兰阳性球菌前两位分别是凝固酶阴性葡萄球菌和金黄色葡萄球菌,分别占所有分离革兰阳性球菌的32.8%(243/741)和31.4%(233/741),其次为肺炎链球菌和肠球菌属;下呼吸道革兰阳性球菌的构成与文献[6-7]相似。
3.3 痰培养病原菌的耐药性
3.3.1 痰培养中常见革兰阴性杆菌的耐药性 从表2药敏结果可以看出,不同细菌对各种抗菌药物呈现不同的耐药率,大肠埃希菌对大部分抗菌药物的耐药率均高于肺炎克雷伯菌属,与ESBLs的检出有关,超广谱β-内酰胺酶是细菌在持续的β-内酰胺类抗生素的选择压力下,被诱导产生活跃且不断变异的β-内酰胺酶,使青霉素类和1代、2代、3代及单环β-内酰胺失效而产生;大肠埃希菌和肺炎克雷伯菌属的主要耐药机制就是产生ESBLs,给临床治疗带来了极大挑战。本次研究还发现了碳青霉烯抗生素不敏感的肺炎克雷伯菌属,其对亚胺培南和美罗培南的耐药率分别为3.4%和2.6%,均低于2014年中国云南地区细菌耐药监测的数据6.2%和5.2%[7]。碳青霉烯类(Carbapenems)药物是抗菌谱最广、抗菌效果最强的非典型β-内酰胺类抗生素,对β-内酰胺酶稳定且毒性低,尤其对产生超广谱β-内酰胺酶(extended spectrum β-lactmases,ESBLs)或AmpC酶的菌株具有良好的抑杀作用[8],其对肠杆菌科耐药的主要机制是产碳青霉烯酶[9]。不动杆菌属对亚胺培南和头孢他啶的耐药率显著高于其余几种菌,其中在检出的399株不动杆菌属中,最多的是鲍曼不动杆菌,占不动杆菌属的81.5%(325/399),其对亚胺培南的耐药率高达42.2%,低于2015年全国细菌耐药监测网公布的数据58.0%[10];鲍曼不动杆菌对碳青霉烯类抗生素最主要的耐药机制为产生碳青霉烯水解酶,此外,外膜通道蛋白、菌膜主动外泵以及青霉素结合蛋白也参与耐药机制的形成[11];碳青霉烯酶编码的基因具有较强的传染性,因此,做好院内感染防控及耐药监测显得尤为重要。《中国鲍曼不动杆菌感染诊治与防控专家共识》明确指出,感染该细菌治疗时,凭经验选用抗生素存在较大的偏差,应加强耐药监测,尽量根据药敏结果选用抗生素,针对性的耐药性的不断增加,贺毅[12]建议,采用联合用药治疗,同时,还应考虑抗生素的药代动力学特点,合理选用抗生素治疗,从而进一步提高疗效。检出的276株流感嗜血杆菌对氨苄西林、复方新诺明、头孢克洛和头孢呋辛、显示较高的耐药率,分别为69.7%、69.3%、58.9%和47.6%,其中有168株产β-内酰胺酶,产酶率为60.9%,高于杨勇文等[13]报道的37.1%,可能与本次研究的标本单一性有关;流感嗜血杆菌是呼吸道感染的常见菌,也是社区获得性肺炎的重要致病菌之一,因此应做好流感嗜血杆菌的监测与防治工作。53株唐昌蒲伯克霍尔德菌除对头孢吡肟的耐药率为100%外,对其余抗菌药物的耐药率均较低;该菌广泛存在于水和土壤中,是医院感染的常见病原菌之一,是否是真正的病原菌,临床医生一定要结合患者的临床症状、实验室结果及相关影像资料综合考虑,并加强无菌观念及意识,做好院感监测。嗜麦芽窄食单胞菌大多为多重耐药菌,对亚胺培南天然耐药,本次研究采用K-B法检测了嗜麦芽窄食单胞菌对左氧氟沙星、复方新诺明、米诺环素的耐药性,均显示较低的耐药率,分别为17.1%、2.9%、2.9%,与熊丽蓉等[14]的报道一致。
3.3.2 痰培养中常见革兰阳性球菌的耐药性 从表3药敏结果可以看出,凝固酶阴性葡萄球菌和金黄色葡萄球菌对16种抗菌药物的耐药率除万古霉素、奎奴普丁/达福普汀、利奈唑胺和替加环素均敏感,两者对青霉素、呋喃妥因和克林霉素的耐药率比较,差异均无统计学意义(P>0.05),凝固酶阴性葡萄球菌对其余抗生素的耐药率均高于金黄色葡萄球菌(P<0.05),与张凌等[15]的报道一致,可能与耐甲氧西林葡萄球菌的检出有关,由于耐甲氧西林葡萄球菌不仅对β-内酰胺类抗生素耐药,还对氨基糖苷类等多种抗生素耐药,是现有抗生素难以控制的感染。肺炎链球菌对除对复方新诺明、红霉素和四环素耐药率较高(在75%以上)外,对其余抗菌药物的耐药率均较低,对青霉素的耐药率为0,与文献[16-17]报道的抗肺炎链球菌传统治疗药物青霉素的耐药率有差异;肠球菌属除对万古霉素、呋喃妥因、利奈唑胺和替加环素外,对其余抗菌药物的显示较高的耐药率,均在50%以上,与韩兰芳[18]报道一致。
3.3.3 痰培养常见真菌的耐药率 各种真菌对5种抗真菌药物显示较低的耐药率,均≤6%。真菌感染是一种难治性疾病,病死率较高,及时进行真菌培养及药敏试验,能指导临床合理使用抗真菌药物,提高治愈率和降低死亡率。
3.4 研究的不足 本研究应用大量的数据分析了痰培养病原菌的分布和耐药性,为临床合理选用抗菌药物提供了有力依据,但缺乏往年平行资料的对比分析,对纵向耐药性的变迁分析还不到位,后续的研究中笔者将收集更多的资料,进行更进一步的研究。
综上所述,下呼吸道病原菌主要以克雷伯菌属、大肠埃希菌等革兰阴性杆菌,凝固酶阴性葡萄球菌和金黄色葡萄球菌等革兰阳性球菌,白假丝酵母菌为主,各种菌对不同抗菌药物显示不同的耐药性;由于各地用药习惯的不同,细菌在不同抗菌药物选择压力下生存状况不一致,从而导致引起呼吸道感染的病原菌存在明显的地区差异[19-20],并在不断变化,因此,临床应及时监测本地区病原菌的分布和耐药性,并结合临床信息合理选用抗菌药物。
参考文献
[1]肖彬,汤蓓.2010-2013年ICU下呼吸道感染肺炎克雷伯杆菌的耐药性分析[J].中华急诊医学杂志,2015,24(6):655-657.
[2]韩志海.呼吸道感染患者微生物标本留取及判读[J].中国临床医生杂志,2018,46(12):1394-1397.
[3]张建伟,张雨郝李.痰培养前的质量控制[J].当代护士,2018,25(34):139-140.
[4]漆兆李.为接受痰培养检验的患者使用改进的方法进行痰液标本采集的效果[J].当代医药论丛,2018,16(24):166-167.
[5]孙利明.960例患者痰培养病原菌分布及细菌耐药性分析[J].中国实用医刊,2014,41(3):41-44.
[6]黄婕.下呼吸感染964例病原菌及耐药性的调查[J].交通医学,2016,30(3):276-278.
[7]许云敏,陈瑞春,杜艳,等.2014年中国云南地区细菌耐药监测[J].中国抗生素杂志,2016,41(9):684-689.
[8]杨春.耐碳青霉烯类抗菌药物肠杆菌科细菌耐药机制研究[D].长春:吉林大学,2016.
[9]叶淑瑶,李怡谰,李凤琴,等.耐碳青霉烯类肠杆菌科细菌耐药机制研究进展[J].国外医药抗生素分册,2018,39(6):494-500.
[10]国家卫生计生委合理用药专家委员会,全国细菌耐药监测网.2015年全国细菌耐药监测报告[J].中国职业药师,2016,13(3):3-8.
[11]蔡果果,王春艳.耐碳青霉烯类鲍曼不动杆菌耐药机制及治疗研究进展[J].现代医药卫生,2019,35(2):234-237.
[12]贺毅.耐碳青霉烯类鲍曼不动杆菌耐酶机制及临床治疗的研究进展及其对策[J].抗感染药学,2017,14(4):725-729.
[13]杨勇文,李从荣.某院2012~2015年流感嗜血杆菌分布特征及耐药性分析[J].检验医学与临床,2016,13(13):1745-1746.
[14]熊丽蓉,冯伟,向荣凤,等.我院2005-2017年嗜麦芽窄食单胞菌的临床分布及耐药性分析[J].中国药房,2018,29(16):2248-2251.
[15]张凌,黄欣,何祖光.呼吸内科患者下呼吸道感染病原菌分布及耐药性分析[J].实验与检验医学,2019,37(1):90-92.
[16]居里艾提·阿比提,努力曼·伊明.肺炎鏈球菌耐药性分析[J].中国伤残医学,2014,22(3):188-189.
[17]梁培松,孙各琴,张秀明,等.肺炎链球菌的临床分布及耐药性监测[J].国际检验医学杂志,2015,36(8):1045-1046.
[18]韩兰芳.肠球菌属细菌368株临床分布及耐药性分析[J].中国实用医刊,2014,41(3):22-23.
[19]粱玉兰,赵新惠,潘士虎,等.2455例慢性阻塞性肺疾病痰标本病原菌分布及耐药性分析[J].国际检验医学杂志,2015,36(20):3064-3065.
[20]陈秀兰,袁李华,王字卉.肺炎患儿痰标本病原菌分布与耐药性分析[J].中华医院感染学杂志,2015,25(9):2117-2119.
(收稿日期:2019-01-04) (本文编辑:张爽)
