谷物及饲料中青霉酸的污染和防控
2019-01-15李晓雪董燕婕苑学霞丁照华李大鹏赵善仓
李晓雪 董燕婕 苑学霞 丁照华 李大鹏 赵善仓
(山东省农业科学院农业质量标准与检测技术研究所;山东省食品质量与安全检测技术重点实验室1,济南 250100)(山东农业大学食品科学与工程学院2,泰安 271018)(山东省农业科学院玉米研究所3,济南 250100)
青霉酸(Penicillic Acid, PA)是由不同株系的青霉菌(Penicillium)和曲霉菌(Aspergillus)产生的次生代谢产物,具有致突变和致癌作用,能诱导中国仓鼠卵巢细胞DNA单链的断裂和抑制体外培养小鼠成纤维细胞DNA合成[1-3];袁慧等[4]1998年调查湖南省霉变饲料发现有60份霉变饲料中检出青霉酸,检出率高达55.0%。1913年Alsberg等[5]在分析糙皮病与霉变玉米之间的关系时,首次从侵染软毛青霉(P.puberulum)的玉米中分离出青霉酸,并证明了青霉酸对鸡、鹌鹑等实验动物均具有毒性。青霉酸具有诱变性和致癌性,随膳食摄入对公众健康产生风险。
1 青霉酸的主要特征
青霉酸是一种无色针状结晶化合物。熔点83 ℃,沸点在常压下为285.7 ℃,密度在25 ℃下为1.157 g/mL,易溶于热水、乙醇、乙醚、苯、氯仿,略溶于冷水(2 g/100 mL),微溶于热石油醚,几乎不溶于戊烷和己烷。青霉酸分子式为C8H10O4,分子量170.16。青霉酸以两种异构体的形式存在,一种为取代的γ-酮酸(γ-酮-β甲氧基-δ甲叉-A-乙酸)(γ-keto-β-methoxy-δ-methylene-A-hexanoicaci-d),另一种为γ-羟基内酯(y-hydroxylactonc),其分子结构如图1所示。
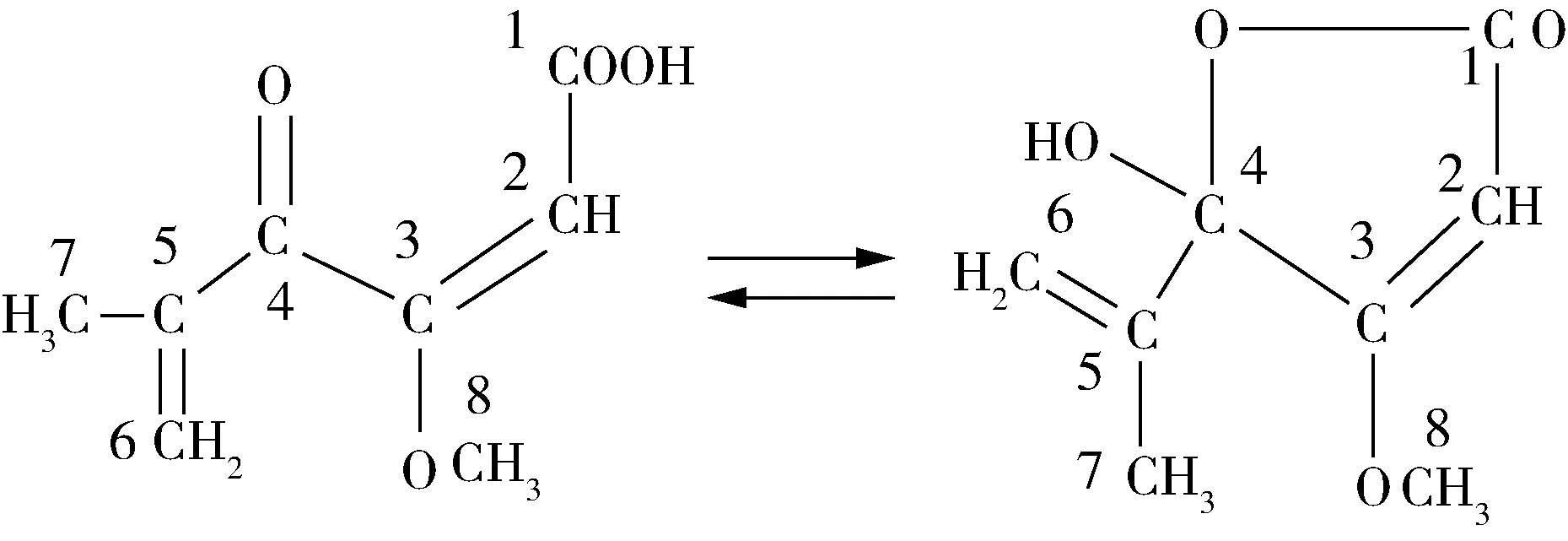
a γ-酮酸 b γ-羟基内酯图1 青霉酸的结构式
2 青霉酸的发生流行
青霉酸是储藏真菌产生的生物毒素,在5~32 ℃都产毒,在15~20 ℃时产毒最高,在低温高湿的条件下,该毒素产量增高。其中青霉属产青霉酸的菌种最多,尤以圆弧青霉菌有毒代谢产物中含量较高。青霉酸存在于谷物中,主要污染玉米、高粱、大麦、小麦、燕麦等粮食作物。1974年Thorpe等监测美国玉米,其青霉酸含量为5~230 mg/kg[6]。干燥的辣椒样品保存在相对湿度为91%~97%的环境中检出青霉酸[7]。小麦中青霉酸含量为5~230 mg/kg[8]。
有研究表明,在霉变饲料中青霉菌的污染率占89.30%,而圆弧青霉菌占青霉菌污染率的60.30%[4],饲料中因青霉酸中毒引起的疾病案例有很多,尤其是位于长江以南的省份较多,之前认为主要是黄曲霉毒素B1(AFB1)引起的中毒,经研究发现,除AFB1引起的中毒外,青霉酸也有毒性作用,故而青霉酸对饲料安全影响很大[9]。
3 青霉酸的生物合成
圆弧青霉中青霉素酸的生物合成途径大约有6步构成[10](图2)。1个单位的乙酰辅酶A同3个单位的丙二酸单酰辅酶A经缩合反应,失去3个分子的二氧化碳生成苔色酸。苔色酸经环裂解和脱羧作用而生成青霉酸[11]。其反应的最后一步是3-甲基苯醌通过氧化环裂变生成青霉酸,通过14C同位素示踪标记,研究结果表明反应需要氧气、还原型辅酶Ⅱ(NADPH)、黄素单核苷酸(FMN)和Fe2+,其反应方程式为2NADPH++2H++O2+3-甲基苯醌=2NADP+H2O+PA,其反应机制为拜耳-维立格氧化重排[12]。Axberg等[13]应用14C标记的前体物研究圆弧青霉青霉酸的生物合成顺序依次是苔色酸生成2-氧-苔色酸、1,4-二氢-6-羟基-2-甲苯、6-羟基-2-甲基-苯醌,最后生成青霉酸。
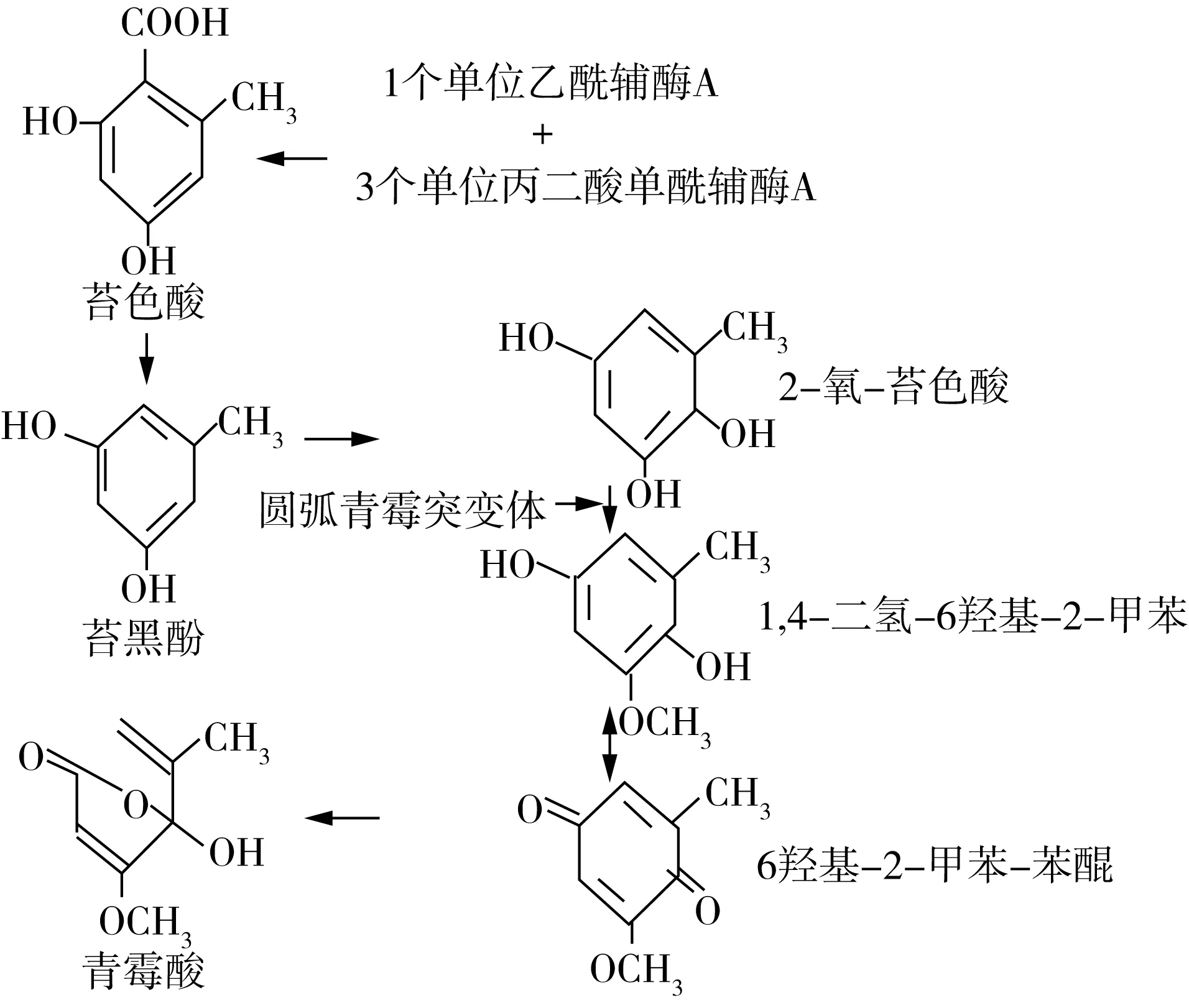
图2 青霉酸的生物合成途径
Sekiguchi等[10]通过N-甲基-N′-硝基-N-亚硝基胍处理圆弧靑霉(P.cyclopium)得到了青霉酸阴性突变体(P.cyclopiumNRRL 1888)。培养的圆弧青霉突变体(SK2N6)中快速积累6-甲基-1,2,3-三羟基苯,14C放射性标记的乙酸迅速进入6-甲基-1,2,3-三羟基苯中,同时,含有14C的6-甲基-1,2,3-三羟基苯快速进入圆弧青霉NRRL 1888。研究结果表明,6-甲基-1,2,3-三羟基苯为圆弧青霉合成青霉酸中间产物。青霉酸的生物合成是由一组聚酮合酶(PKSs)酶催化。通过基因敲除技术和逆转录-聚合酶链反应(RT-PCR)研究表明,只有在曲霉菌westerdijkiae中的pks-nrps基因aolc35-6中编码某些未知的中间体的aomsas基因和参与生物合成的苔色酸和青霉酸的基因[14]。
4 青霉酸的毒性
4.1 细胞毒性
青霉酸能促使人呼吸道上皮细胞死亡,阻断细胞的能量传导,降低细胞的呼吸作用[15]。青霉酸通过增加细胞的长度和宽度而导致扁平的和丝状的细胞的产生,并且这个过程相较于蜡样芽孢杆菌来说,对伤寒沙门菌影响更大。在青霉酸影响下,伤寒沙门菌的细胞壁和细胞膜明显的受到破坏,并且一部分细胞质可能随着细胞的破裂而流出[16]。青霉酸对人卵巢癌细胞系A2780的IC50值为1.5 μg/mL,青霉酸诱导PC-12细胞神经状突起结构变化,产生神经偶极型突起,同双丁酰环腺苷酸诱导作用相似。当青霉酸处理质量浓度为3~6 μg/mL时,诱导许多神经突起从细胞体延伸[17]。小鼠经皮下注射青霉酸,LD50为100 mg/kg,大鼠皮下注射青霉酸1.0 mg,每周2次,64~67周后,注射局部引发纤维瘤,结果表明有致突变作用[9]。家兔青霉酸急性中毒时,临床上出现体温降低,心率先快后慢,呼吸增数,胃肠蠕动加强,脱毛,蛋白尿和引起孕兔流产等现象,病理学变化主要是肾、肝和心肌细胞变性[18]。
4.2 器官毒性
青霉酸易于与含有巯基的半胱氨酸、谷胱甘肽、精氨酸、组氨酸和赖氨酸发生反应,通过对青霉酸与半胱氨酸、谷胱甘肽生成的加合物进行鉴定,加合物鸡胚表现出毒性[19]。尼西鸡经人工染毒60 d内,检测其病理变化及脏器中的残留量,结果表明,青霉酸主要侵害肝、肾及心肌细胞,且在脏器中含量分布依次为肝>肾>心,由此表明青霉酸的分布与各脏器的病变程度具有相关性[20]。对雌性狗腹腔注射青霉酸染毒后,会出现腹部浆膜面出血、充血、肝脏窦状隙扩张现象,肝脏外周小叶肝细胞质中肝糖原量也明显下降,乳酸脱氢酶数量也在降低[21]。另外,青霉酸能抑制Na+、Ca2+、K+进入青蛙的离体心肌,引起心脏功能障碍[22]。
4.3 联合毒性
青霉酸与饲料中其他毒素如赭曲霉毒素A相互作用,联合毒性增强。青霉酸与赭曲霉毒素A联合作用于雏鸡时,其肝脏与肾脏会出现上皮细胞肿胀和颗粒样变性,其毛细血管内皮的单核细胞会出现增殖现象,也能观察到免疫器官退行性变化和淋巴细胞的减少[23]。青霉酸能抑制淋巴细胞的体外增殖,赭曲霉毒素A和青霉酸联合作用于猪,可以引起其实验性肾病[24-25]。赭曲霉毒素A(OTA)与青霉素表现出的协同作用(P<02<20.05),而棒曲霉素(PAT)与青霉素表现出拮抗作用(P<02<20.05)[26]。在保加利亚和南非的农场饲料中,多种真菌毒素污染(特别是伏马毒素B1和青霉酸)引发了猪霉菌毒素中毒、禽肾病,因此动物和人类长期暴露于多种真菌毒素污染的环境中,可能是其慢性肾脏疾病产生的一个重要因素[27-28]。
5 青霉酸的作用机制
青霉酸对细菌的生物作用机制是破坏细胞壁和细胞膜结构,增加其通透性[16]。青霉酸通过改变牛巨噬细胞(BoMac)基因表观遗传调控中所涉及的关键酶而抑制蛋白质和RNA的合成。青霉酸能显著诱导组蛋白去甲基化酶(JMJD-3)的表达,略微降低组蛋白去乙酰化酶(HDAC)的表达[29]。青霉酸对脲酶的毒性是通过结合酶分子的基本基团硫醇而形成的[30]。青霉酸可通过抑制亮氨酸的进入而阻碍蛋白质的合成,其阻碍作用随浓度的增高和时间的延长而增强[31]。青霉酸能抑制DNA、RNA、蛋白质和一些含巯基的酶的合成,选择性抑制细胞膜上的(Na+, K+)-ATP酶活性[32]。Bentley等[11]1962年研究表明青霉酸浓度(80 μmol/L)通过选择性地抑制各种致病因子和其他群体感应调节基因影响铜绿假单胞菌的群体感应通信。在Burkitt淋巴瘤Raji细胞中,青霉酸浓度为100~200 μmol/L时通过调节半胱氨酸蛋白酶8(caspase-8)靶位活性而抑制Fas介导的细胞凋亡[33]。青霉酸作为群体感应抑制剂能显著提高活细胞比例和中心感染数,但对相应的噬菌体裂解量影响较小[34]。
6 青霉酸检测方法
6.1 免疫学方法
6.1.1 酶联免疫法
通过青霉酸与牛血清白蛋白、卵清白蛋白结合制备青霉酸完全抗原,通过人工抗原免疫小鼠获得特异性单克隆抗体[35-36]。在此基础上采用酶联免疫吸附法来测定样品中青霉酸含量。酶联免疫吸附法 (ELISA)具有特异性强、灵敏度高、安全性高、操作简便等特点,但由于样品中存在的复杂成分会干扰抗原-抗体反应的专一性,因而与色谱学方法相比,ELISA法对基质的要求更高,一般不能同时检测多种毒素。
6.1.2 免疫金标记法
免疫胶体金技术是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术;朱丽等[37]探讨了胶体金标记抗圆弧青霉菌毒素—青霉酸单克隆抗体探针的制备方法,摸索其最佳反应条件并对其活性进行检测。结果表明,胶体金标记抗青霉酸单克隆抗体的最佳pH为8.2,1 mL胶体金标记的最小蛋白质量为25 μg。金标体与二抗发生牢固结合,即金标探针具有活性。
6.2 理化分析方法
6.2.1 薄层层析法
Golinski等[38]建立了谷物(大麦、玉米、燕麦、黑麦和小麦样品)中青霉酸的薄层色谱检测方法。采用甲苯-乙酸乙酯-90%甲酸作为薄层色谱的展开剂,将展开的色谱板进一步暴露于吡啶、乙酸酐或它们的混合物蒸汽中,通过这种处理将青霉酸转化为新的荧光化合物,并在365 nm处检测。
6.2.2 气相色谱法
采用三甲基硅烷衍生或使用非衍生固定剂3%的聚碳硼烷-甲基硅氧烷(Dexsil 300),应用OV-17 OV-25毛细管建立青霉酸气相色谱检测方法,青霉酸定量限为25 ng。建立了在发霉的玉米样品中同时提取和检测青霉酸和展青霉素的气相色谱方法。
6.2.3 高效液相色谱法
采用高效液相色谱法将对酞内酰胺苯甲酸氯(PIB-CL)作为柱前衍生试剂对青霉酸进行衍生反应,在乙腈-水(47∶53,V/V)为流动相的条件下,采用ODS柱,紫外检测器分离(λ=300 nm)青霉酸[39];应用反相高效液相色谱法分离青霉酸,以乙腈-水-冰醋酸作为流动相,采用10 μm色谱柱,在紫外(UV)254 nm处进行检测。在5~500 μg/mL的线性范围内,青霉酸的最低检出限为5 ng,尿和胆汁样品加标回收率为92%~105%[40]。
6.2.4 质谱分析法
目前色谱质谱联用在真菌毒素检测方面的应用越来越普遍[41-43]。一种同时分析奶酪中的9种真菌毒素(黄曲霉毒素B1、B2、G1、G2、M1,赭曲霉毒素A、霉酚酸、青霉酸和娄底青霉素C)的检测方法,该方法包括液相萃取-高效液相色谱的分析物的分离和质谱检测,样品加标浓度在5~200 μg/kg范围内,青霉酸的定量限为5 μg/kg,平均回收率为96%~143%[44];一种液相色谱串联质谱(LC-MS/MS)法同时测定小麦、大麦和燕麦中曲霉、镰刀菌、青霉菌、麦角真菌产生的31种真菌毒素的方法,包括溶剂自动萃取、过滤、浓缩与粗提物的分析,反相色谱分离,电喷雾离子源(ESI),多反应监测(MRM),负离子模式,青霉酸在小麦中的最低检出限为15 μg/kg,定量限为35 μg/kg,平均回收率为70%~108%[45];一种能同时测定开心果、小麦、花生、玉米、玉米片中33种霉菌毒素的液相色谱串联质谱测定方法,反相色谱分离,电喷雾离子源(ESI),多反应监测(MRM),正离子模式[46];Vishwanath等[47]建立了一种同时测定室内基质中186种真菌和细菌代谢物的液相色谱串联质谱测定方法,青霉酸基质抑制效应为(67±4)%,最低检出限为38.0 μg/kg;Varga等[48]建立了一种同时测定杏仁、花生、榛子和开心果中191种真菌代谢产物的测定方法,该方法包括欧盟法典和食品法典所有规定真菌毒素,样品用酸化乙腈-水溶液提取,提取液稀释,直接注入UHPLC-MS/MS系统,正离子模式,多反应监测。
7 青霉酸的污染防控
良好田间操作(GAP)可减少青霉酸的污染,通过良好的田间管理来抑制青霉酸的产生被认为是最有效的防控策略。青霉菌、曲霉菌容易在植物体受伤位置繁殖生长,所以防止植物体的机械或害虫损伤能很大程度上减少青霉酸的污染。饲料中青霉酸等霉菌毒素的污染可以从多种途径进行,加强对饲料的监测,防止饲料原料在生产前就霉变,发现被污染的饲料,立即剔除;在饲料中加入足量的防霉剂,饲料中添加防霉剂是预防霉变的重要措施[49-50]。
谷物中青霉酸的产后防控策略主要是采用不同的处理方法将其高效、安全地清除,控制好饲料原料的质量、储藏及其加工运输过程,特别是控制好饲料的水分及高温制粒后的降温过程,是污染消除的关键。对于已经被青霉酸污染的饲料可以用物理或者化学方法加以去除。许多研究表明,通过物理、化学、生物、热灭活、辐射等方法,可去除饲料中多种霉菌毒素或使其在不同程度下失活,如在饲料中添加可吸附霉菌毒素的物质:铝硅酸盐类、活性炭,沸石,酵母或酵母细胞壁成分等[51],使毒素在经动物肠道时不被吸收,直接排出体外[52];微生物的降解为控制青霉酸的污染提供了新的思路,可以利用微生物之间的竞争作用筛选出能抑制产毒霉菌生长的菌株,以降低青霉酸的污染[53-54]。
8 展望
青霉酸同时具有抗菌、抗肿瘤的活性[55]。青霉酸在1~25 μg/mL最小抑菌浓度(MIC)范围内,具有较高的体外抗疫霉菌(Phytophthoraspp)活性。青霉酸能诱导辣椒疫霉菌(P.capsici)顶端分枝、菌丝体肿胀,恶疫霉菌(P.cactorum)菌丝顶端不规则分枝和小球形肿胀,栗疫霉黑水病菌(P.cambivora)有不规则的分枝和肿胀,德雷疫霉(P.drechsleri)菌丝顶端或附近不规则的球形膨胀[56]。对12种植物病原细菌进行体外青霉酸抗菌活性测试,结果表明,青霉酸在12.3~111.1 μg/mL MIC值范围内能抑制所有细菌病原体的生长;青霉酸在111.1 μg/mL和333.3 μg/mL浓度条件下能有效抑制桃离体叶片细菌性斑点病,抑制率分别为82.4%和94.1%[57]。青霉酸对革兰氏阳性菌和革兰氏阴性菌均具有抑制作用,青霉酸可作为农业生产中新型植物杀菌剂开发的先导分子。近年来,真菌毒素污染问题引起人们的广泛关注,而青霉酸是霉变饲料中的高产型真菌毒素,对各种动物都具有不同程度的毒性,更应引起我们的重视。目前,研究主要集中于青霉酸的单一毒性,但在饲料及饲料原料中通常不仅仅存在青霉酸,还存在其他毒素,混和毒素的摄入对健康造成的不良影响比单一毒素的摄入风险更大。而3种或更多种真菌毒素的联合毒性的报道较少,且真菌毒素联合毒性的机理尚不清楚,有待进一步研究。另外,随着人们对青霉酸毒性机理的进一步了解和对青霉酸检测技术、脱毒方法研究的日渐深入,加强饲料防霉脱毒工作,降低对人和动物的危害,也是今后的研究方向。
