GPRC5A抑制肺癌细胞A549增殖和迁移及与EGFR的相关性研究
2019-01-15黄华奇闻剑波江明君石世青赵子恩黄科峰葛建军戚赛春
黄华奇 闻剑波 江明君 石世青 赵子恩 黄科峰 葛建军 戚赛春
肺癌是发病率和死亡率最高的恶性肿瘤。仅在2013年,全国肺癌新发病例约73.28万例,死亡病例约58.07万例[1]。大多数患者发现时已处于晚期,5年生存率低于15%[2-3]。非小细胞肺癌(non-small cell lung carcinoma,NSCLC)约占所有肺癌的80%。G蛋白偶联受体 C 家族 5A(G protein-coupled receptor,GPRC5A)是一种由全反式维甲酸诱导的基因,也称为维甲酸诱导蛋白 3(retinoic acid-induced 3,RAI3)。Tao 等[4]敲除小鼠GPRC5A基因导致肺癌发生,同时他们还发现,肺癌组织的GPRC5A的表达水平相较于邻近的癌旁组织低。肺癌分子靶向药物中,最受瞩目的是表皮生长因子受体(epidermal growth factor receptor,EGFR)。Siegelin 等[5]发现,EGFR在超过60%的转移性NSCLC中高表达,且与不良预后相关。本研究探讨GPRC5A基因对人肺癌细胞A549增殖和迁移能力的影响及其与EGFR的相关性,现将研究结果报道如下。
1 材料和方法
1.1 主要细胞、试剂和培养液 A549细胞购自中科院上海生命科学研究所;真核表达载体pLenti6.3-MCS购自上海诺百生物科技有限公司;DH5α购自北京全式金生物技术有限公司;DMEM培养基、胰酶、吐温-20及新生FBS购自美国Hyclone公司;Lipofectamine 2000转染 试 剂 、SuperScript Ⅲ Reverse Transcriptase、SYBR GreenⅠ购自美国Invitrogen公司;OBIO cell count kit(CCK-8)购自和元生物技术(上海)股份有限公司;RIPA细胞裂解液、BCA蛋白浓度测定试剂盒 (增强型)购自上海碧云天生物技术有限公司;Tanswell plate购自美国Corning Costar公司;单克隆抗体GPRC5A、EGFR购自美国Santa Cruz公司。
1.2 pLenti6.3-MCS-GPRC5A质粒的构建和鉴定 通过美国国家生物技术信息中心检索,查出人GPRC5A的mRNA序列(NM_003979.3),设计特异性引物(酶切位点(Nhe I/Asc I);扩增引物 F:5′-GCTAGC ATGGC TACAA CAGTC CCTGA TGG-3 ′;R:5 ′-GGCGCGCC TTAGE TGCCC TCTTT CTTTA CTTCA TAGT-3′) 进行PCR扩增,重组到载体pLenti6.3-MCS中,并测序验证。PCR 扩增条件为:94℃预热 2min,94℃变性30s,60 ℃退火40s,72℃延伸1min,变性至延伸共进行30个循环,72℃最终延伸10min。用NheⅠ、AscⅠ内切酶分别双酶切PCR扩增产物和pLenti6.3-MCS,1.5%琼脂糖凝胶电泳,凝胶回收试剂盒回收目的片段,在T4 DNA连接酶作用下,16℃连接过夜,转化DH5a感受态细胞,筛选Amp抗性的完全落单的菌落,PCR鉴定测序,命名为pLenti6.3-MCS-GPRC5A。
1.3 细胞转染和阳性克隆筛选 选择状态良好的处于对数生长期的A549细胞制成细胞悬液,接种至24孔板中。37℃培养过夜,使细胞融合至70%密度。实验开始前,更换无血清Opti-MEM培养基。根据转染试剂说明书分别将pLenti6.3-MCS-GPRC5A、pLenti6.3-MCS质粒与Lipofectamine 2000按照合适比例转染至A549细胞。转染4~6h后,更换DMEM完全培养基。48h后,将转染细胞按1∶4传代,继续培养24h,换含新霉素400μg/ml的培养液筛选2周。挑取单细胞阳性克隆继续在含新霉素200μg/ml的培养液中扩大培养。转染pLenti6.3-MCS-GPRC5A质粒的细胞命名为A549-GPRC5A,转染pLenti6.3-MCS质粒的细胞命名为A549-NC。
1.4 GPRC5A和EGFR mRNA检测表达情况 采用实时荧光定量-逆转录-聚合酶链反应(qRT-PCR)技术检测靶基因的表达。先利用TRIzol法提取各组细胞的总RNA,然后反转录合成cDNA,根据SYBR GreenⅠ说明书要求配制反应体系,采用美国Bio-Rad荧光定量PCR仪(CFX96TMReal-Time Systerm)进行qRT-PCR检测,以 β 肌动蛋白(β-actin)为内参,采用 2-ΔΔCt法比较A549-GPRC5A和A549-NC细胞中GPRC5A和EGFR mRNA的表达水平。GPRC5A引物为 F∶5′-GCTGC TCACA AAGCA ACGAA-3′,R∶5′-ATAGAGCGTGTCCCCTGTCT-3 ′;EGFR 引 物 为 F∶5 ′-CAGAT GGATG TGAAC CCCGA,R∶5′-TTCTT ACACT TGCGG ACGCC。
1.5 GPRC5A和EGFR蛋白表达情况检测 采用Western blot方法检测靶蛋白的表达。收集细胞,加入RIPA细胞裂解液,利用BCA试剂盒测定蛋白浓度。样品加入5×蛋白上样缓冲液混合,煮沸5min,取20μg蛋白上样。聚丙烯酰胺凝胶先90V跑完积层胶,再将电压升至200V直到电泳结束。取下凝胶进行转膜,恒压100V转膜。取下膜,先用含有吐温-20的PBS溶液(PBST)洗涤4次,每次5min。将膜置于5%脱脂奶粉封闭液中封闭37℃1h。用封闭液稀释一抗,膜在一抗稀释液中4℃过夜。次日将膜取出后用PBST洗膜4次,每次5min,用含5%牛奶的封闭液稀释二抗。膜在二抗中37℃反应1h。反应完毕后,将膜取出置于干净的盒子中洗膜4次,每次5min。电化学发光法显影、曝光。利用Image J软件分析WB条带的灰度值。
1.6 A549细胞增殖情况检测 采用CCK-8法,取两组对数生长期细胞,按每孔3000个细胞接种于96孔培养板,每组设5个平行孔,于37℃、5%CO2培养箱中培养。分别于 24、48、72h 后,在每孔中加 10μl的 CCK-8,继续培养2h后,用酶标仪在450nm处测OD值,取5个孔的平均值,比较两组细胞在各时间点增殖速度的变化和GPRC5A对A549细胞的增殖抑制效果。
1.7 A549细胞迁移能力检测 采用Transwell方法,首先把含8μm孔径PET膜的Transwell小室放置在无血清DMEM培养基中,37℃平衡30min,准备待用。取对数生长期的各组细胞,分别用无血清的培养基制成细胞悬液,细胞密度调整为1E5/ml。Transwell培养板下室加入800μl含血清的完全培养基,上室加入200μl细胞悬液。于37℃,5%CO2培养箱中培养24h。取出Transwell小室,用棉签擦去膜靠近内室上层的细胞,下层细胞用4%多聚甲醛固定30min,1%结晶紫染色10min,用清水洗3遍以上。显微镜下观察,利用ipwin32软件计数。
1.8 统计学处理 应用SPSS 17.0统计软件,符合正态分布的计量资料以表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 pLenti6.3-MCS-GPRC5A质粒酶切鉴定结果 3、4泳道显示的两条带大小分别为8.9kb和1kb,与pLenti6.3-MCS-GPRC5A的大小一致(图1)。pLenti6.3-MCS-GPRC5A阳性重组克隆子的测序结果与标准的GPRC5A基因mRNA序列完全相同,说明pLenti6.3-MCS-GPRC5A真核表达载体构建成功。
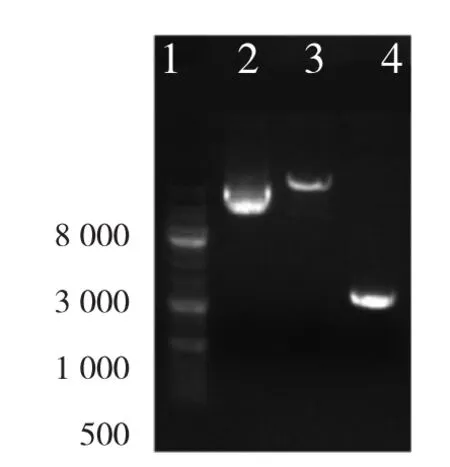
图1 pLenti6.3-MCS-GPRC5A质粒酶切鉴定结果(1:DL10000 DNA Marker;2:环状 pLenti6.3-MCS-GPRC5A 质粒;3:pLenti6.3-MCS质粒;4:GPRC5A片段)
2.2 两组细胞GPRC5A、EGFR mRNA和蛋白表达情况的比较见表1。

表1 两组细胞GPRC5A、EGFR mRNA和蛋白表达情况的比较
由表1可见,与A549-NC细胞比较,A549-GPRC5A细胞GPRC5A mRNA和蛋白的表达量明显上升,EGFR mRNA和蛋白的表达显著降低。Western blot检测靶蛋白的电泳图见图2。

图2 两组细胞GPRC5A和EGFR蛋白表达的电泳图
由图2可见,与A549-NC细胞比较,A549-GPRC5A细胞GPRC5A电泳条带明显变粗,EGFR电泳条带显著变细。
2.3 两组细胞各时点的增殖情况见表2。

表2 两组细胞各时点增殖情况(OD值)
由表2可见,与A549-NC细胞比较,A549-GPRC5A细胞同一时间段内的OD值均较低,其中24、48和72h的差异有统计学意义(均P<0.05)。进一步分析发现,GPRC5A细胞对A549细胞增殖抑制率在24、48、72h分别为22.34%、31.28%、33.52%。
2.4 两组细胞迁移能力比较 A549-GPRC5A细胞和A549-NC细胞迁移的数目分别为(453.0±21.20)个和(751.0±18.36)个。与A549-NC细胞相比,A549-GPRC-5A细胞迁移数目显著减少,表明GPRC5A对A549细胞的迁移有抑制作用。两组细胞迁移情况见图3。

图 3 两组细胞迁移情况(a:A549-GPRC5A;b:A549-NC;结晶紫染色法,×100)
3 讨论
近年来,国内外学者对NSCLC分子机制的大量研究发现,肺癌发生过程中存在许多起关键性作用的遗传突变——驱动型突变[6],肺癌的发生或维持离不开这些突变。其中,EGFR发生了最明显的激活突变。磷酸化的EGFR激活下游 RAS/RAF/MEK/MAPK,PI3K/AKT和JAK/STAT等信号通路[7]。这些通路对于细胞的生长增殖、转移侵袭、抑制促凋亡蛋白等功能发挥着重要作用。现阶段,NSCLC中EGFR靶向治疗药物的研发仍是热点。
G蛋白偶联受体是人体内最大药物靶标蛋白质超家族,目前已报道了约2000种不同的GPCRs[8]。GPRC5A是GPCRs C型家族中的一员,定位于染色体12p12.3-p13区域,它包含的7个α螺旋跨膜结构域是抑制EGFR活性所必须的。自1998年GPRC5A基因在人头颈鳞状细胞癌细胞株UMSCC-22B中被发现后,众多学者对其功能进行探究。GPRC5A被发现主要在肺组织表达[4,9-10],在其他组织中低表达或者不表达,表明其在肺组织中有着特殊的作用。在肺肿瘤细胞或组织中,GPRC5A表达被抑制或者敲除后,EGFR、STAT3、NF-κB、cAMP等多个信号通路被过度激活[11-14],对肺肿瘤发生起着非常重要的作用。GPRC5A在调控cAMP的过程中存在一个负反馈的环路,过表达GPRC5A被发现能够降低细胞内cAMP的水平[14]。cAMP通路的活化在许多肿瘤细胞的增殖、侵袭等活动中发挥着重要作用,能够促进酪氨酸磷酸化,显著地反式激活EGFR[15]。体内激活的EGFR通过催化GPRC5A羧基端酪氨酸残基Y317/320和Y347/350发生磷酸化,与GPRC5A基因进行互作[16]。钟霜霜等[17]表明,STAT3是EGFR下游的信号通路,GPRC5A-/-(敲除型)小鼠气管上皮细胞和肺组织中EGFR-STAT3信号通路发生过度激活,且在人肺癌细胞系中过表达GPRC5A能够抑制EGFR信号通路的激活。Chen等[12]研究发现GPRC5A-/-小鼠肺上皮细胞中STAT3的磷酸化水平较高且持续性激活,其调控的BCL-XL、Cryab等抗凋亡基因的表达水平都较高。在肺癌、肝癌等多种肿瘤中,磷酸化的EGFR可以通过IKK激酶复合物激活NF-κB,进而给癌细胞传递致癌信号[18]。Deng等[13]研究发现,GPRC5A-/-小鼠的肺上皮细胞中NF-κB的活性加强,导致细胞自主性增高,炎性反应增强,最终协同产生促进肿瘤发生的微环境。上述研究表明,GPRC5A与肺癌细胞多个通路存在关联,其发挥功能最主要的途径是抑制EGFR通路的激活。
现今有关GPRC5A与EGFR相关性的报道较少,GPRC5A对肺癌细胞的生物学行为和功能需要进一步研究。GPRC5A与EGFR通路的关联需要更多的实验进一步挖掘,GPRC5A能否通过其他未研究的通路对肺癌细胞造成影响也需要探究发现。本实验的目的是了解GPRC5A对肺癌细胞A549的影响并且探讨其与EGFR通路的相关性。本研究发现,过表达GPRC5A后,A549细胞中EGFR mRNA和蛋白的表达量显著下降,细胞的生长增殖受到明显抑制,迁移能力减弱,表明GPRC5A可能通过抑制EGFR通路的激活对细胞的功能产生影响。这些研究为更好地了解GPRC5A在肺癌细胞内的生物学功能提供了实验依据,也为深入探讨GPRC5A和EGFR的相互作用奠定了一定基础。
