VEGF与Notch信号通路对再生障碍性贫血患者骨髓间充质干细胞的调控机制研究
2019-01-15邓姝项静静胡致平沈建平曾宇晴
邓姝 项静静 胡致平 沈建平 曾宇晴
再生障碍性贫血(aplastic anemia,AA)是一种由多种病因引起的骨髓造血功能衰竭、全血细胞减少性疾病,临床常表现为贫血、出血及感染,病死率高。骨髓造血微环境的改变参与了AA的病理生理过程,并与造血衰竭程度[1]及治疗反应有关。骨髓中新生血管形成是造血微环境的重要一环。研究发现,血管内皮生长因子(vascular endothelial growth factor,VEGF)可直接作用于内皮细胞,参与新生血管形成;Notch信号通路通过影响局部细胞间的相互作用也对血管的形成产生重要影响。但VEGF如何影响AA患者骨髓造血微环境的作用机制尚未完全阐明。因此,本研究旨在观察VEGF通过Notch信号通路对AA患者骨髓造血微环境的影响,探讨VEGF与Notch信号通路对骨髓间充质干细胞(mesenchymal stem cell,MSC)的调控机制,现报道如下。
1 对象和方法
1.1 对象 选取2016年7月至2017年2月浙江中医药大学附属第一医院收治的AA患者10例。其中男4例,女6例;年龄15~46岁,中位年龄26.5岁。同时招募健康骨髓造血干细胞捐献志愿者5例。本研究经浙江中医药大学附属第一医院医学伦理委员会批准,患者或家属及志愿者知情同意并签署知情同意书。
1.2 方法
1.2.1 MSC的分离、培养、传代及鉴定 留取AA患者与健康志愿者的骨髓标本各5ml。骨髓标本与DMEM(美国Hyclone公司)1:1混匀添加到淋巴细胞分离培养基上(美国Sigma公司),并通过离心机(上海贝恩生物科技有限公司)分离。将骨髓单个核细胞重悬于DMEM培养基中,并以1×105/ml的密度接种于培养瓶中。在37℃、5%二氧化碳条件下培养48h后更换培养基。每3~4d换液1次,约2周后完成原代培养,并依次记为P2、P3代细胞。取P3代细胞应用流式细胞仪(美国BD公司)检测细胞免疫表型,包括 CD34、CD44、CD45、CD90 等。1.2.2 细胞分组 将MSC分为5组。正常MSC组:健康志愿者的MSC于DMEM完全培养基中培养。AA组:AA患者的MSC于DMEM完全培养基中培养。AA+γ-分泌酶抑制剂(DAPT)组:AA患者的MSC于含有10μmol/L DAPT(美国Sigma公司)的DMEM完全培养基中培养;AA+VEGF组:AA患者的MSC于含有100ng/ml VEGF(美国Peprotech公司)的DMEM完全培养基中培养;AA+DAPT+VEGF组:AA患者的 MSC于含有10μmol/LDAPT和100ng/ml VEGF的DMEM完全培养基中培养。
1.2.3 细胞增殖检测 使用CCK-8试剂盒(中国碧云天公司)检测各组MSC的增殖能力。将各组MSC接种在 96孔板(100μl/孔)中,并在 37℃、5%二氧化碳环境中培养直至完全黏附。处理48h后,向每孔中加入10μl CCK-8溶液并孵育2h。应用酶标仪(美国Thermo Scientific公司)检测450nm处的光密度(OD值)以反映细胞增殖能力。
1.2.4 细胞周期检测 应用流式细胞仪(美国BD公司)检测各组MSC的细胞周期。以1500rpm离心5min收集细胞,并用冷PBS洗涤2次。在细胞周期检测过程中,将经消化的MSC用5ml 70%冷乙醇溶液在4℃下固定,过夜;用冷PBS洗涤2次,将这些细胞与0.5ml碘化丙啶(PI,美国Sigma公司)在黑暗环境中孵育20min,最后在流式细胞仪上分析细胞的细胞周期。
1.2.5 相关蛋白表达检测 采用Western blot法。收集各组细胞,PBS漂洗2次,细胞裂解液(中国碧云天公司)4℃环境下裂解细胞 30min,12000rpm 4℃离心10min,使用BCA蛋白浓度测定试剂(中国碧云天公司)检测蛋白含量。取30μg蛋白样品加上样缓冲液煮沸变性后,经10%十二烷基硫酸钠聚丙烯酰胺凝胶(SDSPAG,北京普利莱基因技术公司)电泳分离后,转移到PVDF膜上,用含5%脱脂奶粉室温封闭1h。一抗孵育,于4℃环境中过夜,用TBST(上海百赛公司)洗膜3次,加入二抗室温孵育1h后,再用TBST洗膜3次,ECL化学发光显影,检测VEGF蛋白与Notch信号通路相关蛋白表达情况,包括 VEGF、VEGFR、Cleaved Notch-1、Notch-1、Jagged1、Delta-like1、hes1。
1.2.6 相关基因表达检测 采用qRT-PCR法。收集正常MSC组与AA组细胞,严格按照Trizol试剂盒(北京全式金公司)说明书操作提取总RNA。取100ng总RNA,采用PrimeScipt逆转录试剂盒(日本Takara公司)进行逆转录,反应条件为37℃ 60min,85℃ 5s,逆转录完成后进行qRT-PCR,反应条件为50℃ 2min,预变性95℃ 30s,PCR 反应 95℃ 5s,60℃ 30s,40 个循环,熔解反应条件为95℃ 15s,60℃ 60s,95℃ 15s。引物序列如下:VEGF 上游 5′-ACTTTCTGCTGTCTTGGGTG-3′,下游 5′GGCTTGAAGATGTACTCGAT-3′;VEGFR 上游 5′-TCCTGACTTGTACCGCATAT-3′,下游 5′-CTCTCAATTCTGTTTCCCAT-3′;Notch-1 上游 5′-TGGCCTCCTTCTACTGCGAG-3′,下游 5′-CAGTTGGAGCCCTCGTTACA-3′;Jagged1 上游 5′-CGGATTTAAGTGTGTGTGCC-3′,下游 5′-CGGGAAGACAGTCGCAGTAG-3′;Delta-like1 上游 5′-TCTCCTGATGACCTCGCA AC-3′,下游 5′-GTCACA-CACGAAGCGGTAGG-3′;hes1 上游5′-GATCTTTGC-TCCTGACGTCC-3′,下游 5′-CCTTGCAATCTTTCCCGTCC-3′;GAPDH 上游 5′-GCCTTCCGTGTCCCCACTGC-3′,下游 5′-GGCTGGTGGTCCAGGGGTCT-3′。反应结束后导出数据,并分析VEGF与Notch信号通路相关基因mRNA的相对表达水平。
1.2.7 内皮分化能力检测 采用免疫荧光法。吸弃正常MSC组、AA组、AA+DAPT组细胞培养上清液,加PBS清洗2次;用4%多聚甲醛固定各组细胞,4℃环境下过夜,PBS 清洗 3 次,各 5min;1%TritonX-100(上海朝瑞公司,PBS配制)孵育1次 15min,PBS清洗1次,5min;孵育 10min,PBS清洗 1次,5 min;5%牛血清白蛋白(BSA,美国Sigma公司)封闭30min,配制一抗稀释液(1:100)CD31一抗4℃环境下过夜;PBS清洗3次,各5 min,37℃孵育 2h;PBS 清洗 3 次,各 5min,4′,6-二脒基-2-苯基吲哚(DAPI,中国碧云天公司)染核5~10min,PBS洗3次,荧光显微镜拍照,比较细胞内皮分化能力。
1.3 观察指标 (1)比较AA患者与健康志愿者MSC免疫表型;(2)比较正常MSC组、AA组、AA+DAPT组、AA+VEGF组、AA+DAPT+VEGF组MSC增殖能力、细胞周期情况、VEGF蛋白与Notch信号通路相关蛋白表达情况;(3)比较AA组与正常MSC组MSC VEGF与Notch信号通路相关基因mRNA表达情况;(4)比较正常MSC组、AA组、AA+DAPT组MSC内皮分化能力。
1.4 统计学处理 应用SPSS 17.0统计软件;计量资料以表示,两组比较采用两独立样本t检验,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 AA患者与健康志愿者MSC免疫表型比较见表1。
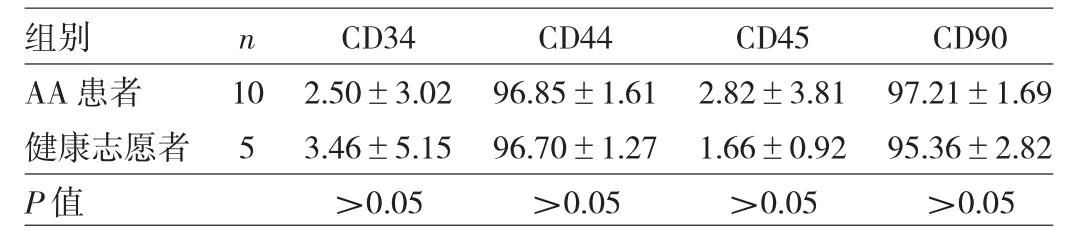
表1 AA患者与健康志愿者MSC免疫表型比较(%)
由表1可见,AA患者与健康志愿者MSC免疫表型比较差异均无统计学意义(均P>0.05)。
2.2 正常MSC组、AA组、AA+DAPT组、AA+VEGF组、AA+DAPT+VEGF组MSC增殖能力比较见图1。
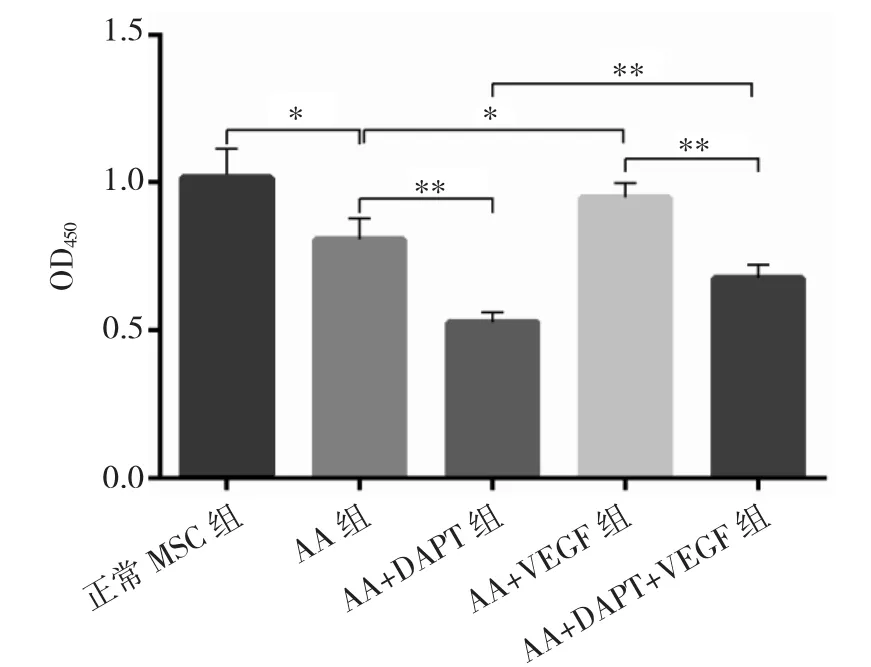
图1 正常MSC组、AA组、AA+DAPT组、AA+VEGF组、AA+DAPT+VEGF(*P<0.05,**P<0.01)
由图1可见,正常MSC组、AA组、AA+DAPT组、AA+VEGF组、AA+DAPT+VEGF组MSC细胞增殖能力比较差异有统计学意义(P<0.05);AA组MSC增殖能力弱于正常MSC组(P<0.05),AA+VEGF组MSC增殖能力强于AA组(P<0.05)。即AA患者MSC增殖能力弱于正常MSC细胞,经过VEGF处理后,AA患者MSC增殖能力增强。
2.3 正常MSC组、AA组、AA+DAPT组、AA+VEGF组、AA+DAPT+VEGF组MSC细胞周期情况比较见图2。
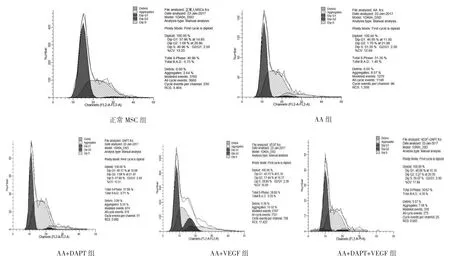
图2 正常MSC组、AA组、AA+DAPT组、AA+VEGF组、AA+DAPT+VEGF组MSC细胞周期情况比较
由图2可见,与正常MSC组相比,AA组MSC G1期细胞比例降低,S期细胞比例增加,G2期无明显变化,说明细胞阻滞在S期,增殖能力减弱。与AA组相比,AA+VEGF组MSC G1期细胞比例无明显变化,S期细胞比例降低,G2期细胞比例增加,说明细胞进入G2期,增殖能力增强。与AA+VEGF组相比,AA+DAPT+VEGF组MSC G1期细胞比例无明显变化,S期细胞比例增加,G2期细胞比例降低,说明细胞阻滞在S期,增殖能力减弱。即AA患者MSC细胞增殖能力弱于正常MSC细胞,VEGF通过阻断S期细胞促进AA患者MSC的增殖,抑制其凋亡。
2.4 正常MSC组、AA组、AA+DAPT组、AA+VEGF组、AA+DAPT+VEGF组MSC VEGF蛋白与Notch信号通路相关蛋白表达情况比较见图3。
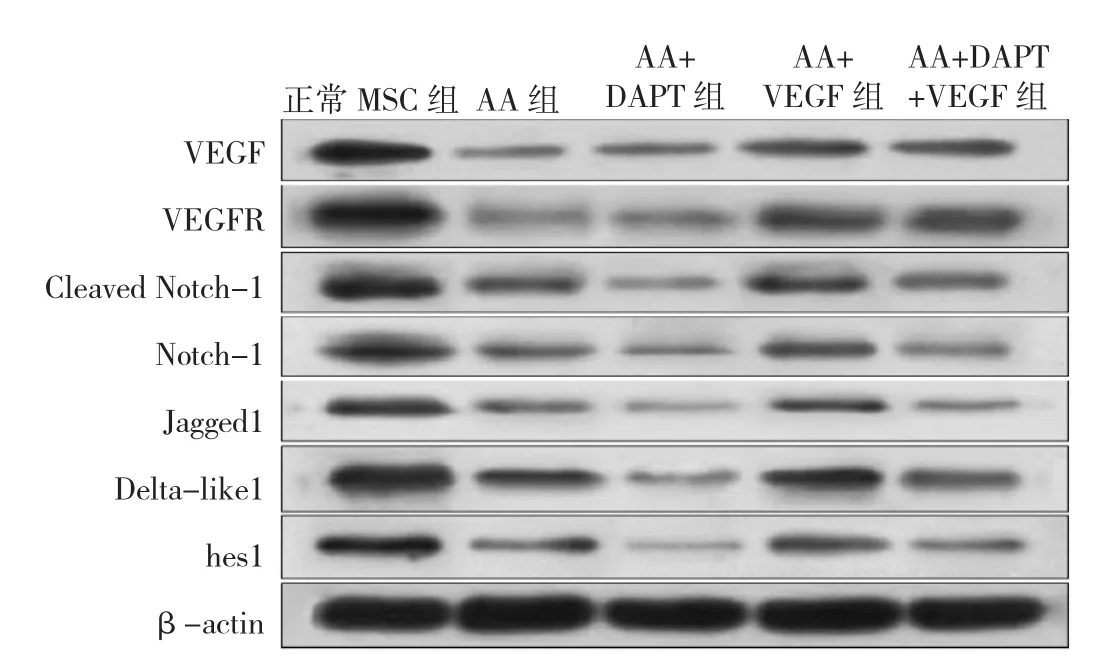
图 3 正常 MSC组、AA组、AA+DAPT组、AA+VEGF组、AA+DAPT+VEGF组MSC VEGF蛋白与Notch信号通路相关蛋白表达情况比较
由图3可见,与正常MSC组相比,AA组MSC VEGF、VEGFR、Cleaved Notch-1、Notch-1、Jagged1、Deltalike1、hes1蛋白表达均下调。与AA组相比,AA+VEGF组 MSC VEGF、VEGFR、Cleaved Notch-1、Notch-1、Jagged1、Delta-like1、hes1蛋白表达均上调。与AA+DAPT组比较,AA+DAPT+VEGF组 MSC Cleaved Notch-1、Notch-1、Jagged1、Delta-like1、hes1 蛋白表达上调,但低于AA+VEGF组。
2.5 AA组与正常MSC组MSC VEGF与Notch信号通路相关基因mRNA表达情况比较见图4。
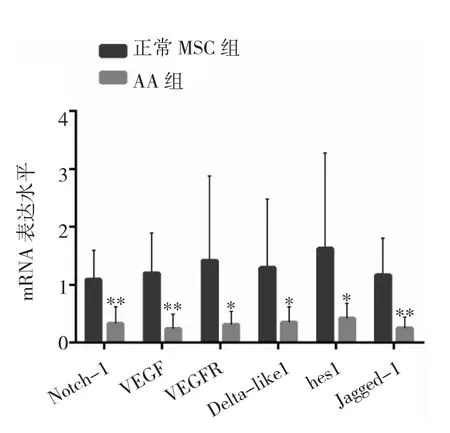
图4 AA组与正常MSC组MSC VEGF与Notch信号通路相关基因 mRNA 表达情况比较(*P<0.05,**P<0.01)
由图4可见,与正常MSC组相比,AA组MSC VEGF、VEGFR、Notch-1、Jagged1、Delta-like1、hes1 基因 mRNA表达均下调。即AA患者的MSC Notch信号通路与VEGF表达受抑制。
2.6 正常MSC组、AA组、AA+DAPT组MSC内皮分化能力比较见图5。
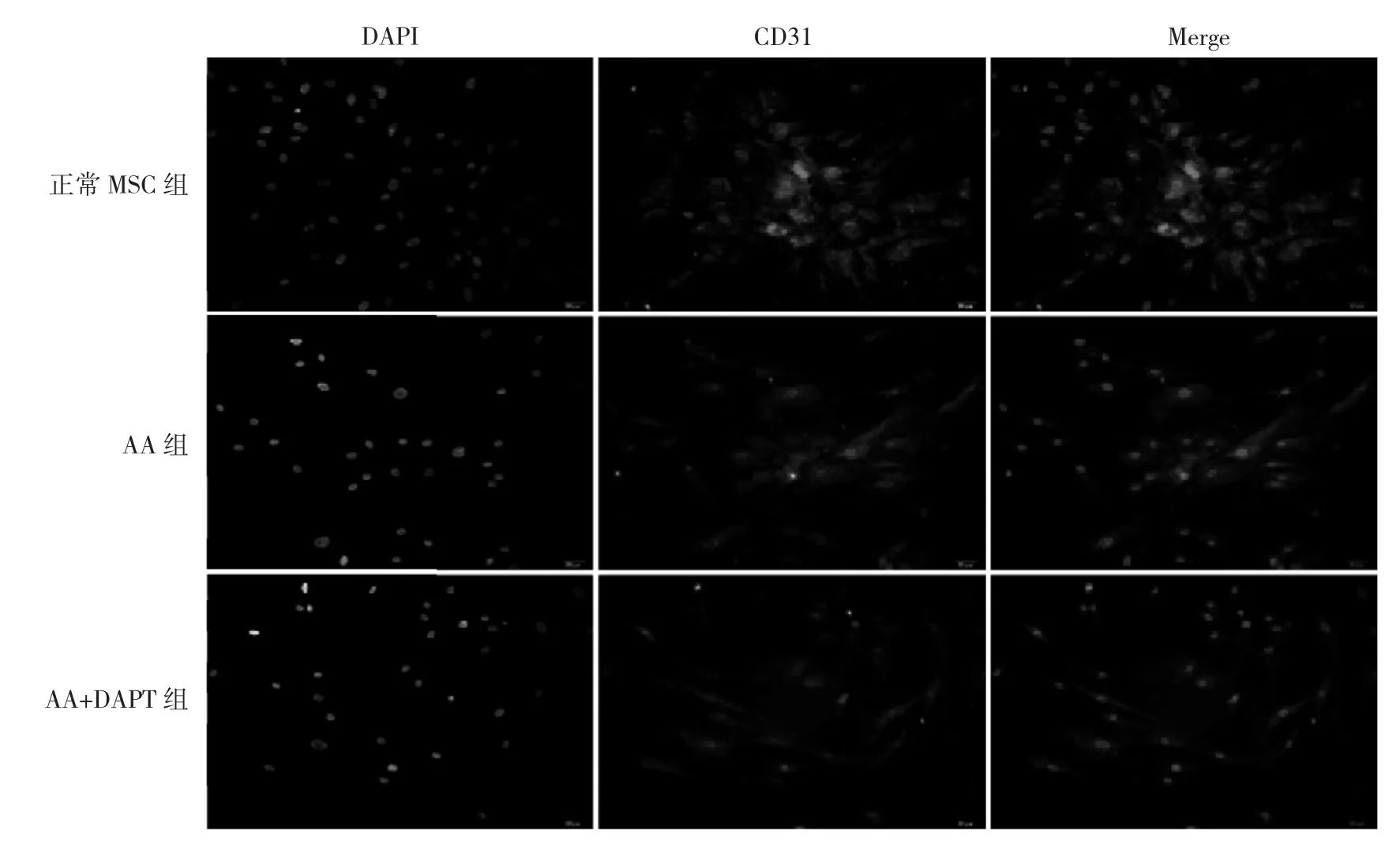
图5 正常MSC组、AA组、AA+DAPT组MSC内皮分化程度比较(免疫荧光染色,×200)
由图5可见,与正常MSC组相比,AA组MSC CD31阳性细胞比例明显降低,说明内皮分化程度降低。与AA组相比,AA+DAPT组MSC CD31阳性细胞比例降低,说明内皮分化程度降低。即AA患者MSC内皮分化能力弱于正常MSC,DAPT可进一步抑制MSC内皮分化。
3 讨论
AA是血液系统常见疾病,有研究认为其与造血干细胞内在增殖或分化缺陷,骨髓造血微环境异常及机体免疫功能紊乱有关,3种机制在不同个体单独或联合作用,导致造血功能衰竭[1]。目前认为,AA是一种以造血系统为靶目标的自身免疫性疾病。造血干细胞无细胞及分子遗传学异常,因此骨髓衰竭的始动因素应该来源于造血微环境而非造血干细胞。研究表明,MSC作为骨髓基质细胞的前体细胞,是一类具有自我更新能力和免疫调节作用的干细胞,是骨髓造血微环境的重要组成部分,其通过介导造血干细胞黏附,分泌多种细胞因子和生长因子而发挥造血支持作用[2-4]。AA患者MSC的异常可能在其发病机制中产生重要作用[5-7]。
临床上发现,AA患者血清VEGF水平明显低于正常人。其降低的机制可能是患者的骨髓造血功能障碍,骨髓血管减少,血管通透性降低,供血、供氧量减少,VEGF分泌减少,进一步地加速了骨髓的脂肪化。AA患者血清VEGF水平的降低可能成为导致干细胞集落形成能力降低以及骨髓微环境支持功能缺陷的因素之一。有研究报道,AA患者的VEGF表达低于正常对照组,VEGF对大鼠MSC有明确的促增殖作用,其作用机制与Notch信号通路密切相关[8]。Notch信号通路对血管的发育和形成起重要的调控作用,其间涉及到Notch信号通路与MSC间复杂的关系,但具体的调控机制尚未完全阐明[9]。
Notch信号通路是一个在进化上高度保守的信号传导系统,广泛存在于所有已知动物细胞中,调控着几乎所有的组织和器官细胞的增殖、分化与凋亡。鉴于Notch信号通路在调节造血干细胞和骨髓基质细胞的功能中起到的重要作用,研究发现,多种血液恶性疾病的Notch信号通路存在异常,影响疾病的发生、发展过程[10]。研究发现,Notch信号通路导致AA的发生,可能与从TBX21下调Notch-1有关[11]。Notch信号通道参与MSC向软骨细胞分化的过程,对于单层培养MSC,γ-分泌酶抑制剂DAPT可抑制Notch信号通道,不仅可抑制MSC的增殖,亦可抑制MSC成软骨分化[12]。Notch被认为是AA发病机制的主要驱动因子。据报道,Notch信号通路参与调节AA小鼠模型中的Treg/Th17平衡[13]。
本研究结果显示,AA患者MSC的Notch信号通路受抑制,MSC内皮分化能力弱于正常MSC细胞,而VEGF通过激活Notch信号通路可促进AA患者MSC的增殖。此外,本研究还发现,VEGF可通过阻断S期细胞促进AA患者MSC的增殖,抑制其凋亡。VEGF的干预可以恢复AA患者的增殖能力。这说明,VEGF可通过Notch信号通路调控AA患者MSC,从而改善骨髓造血微环境,并与患者造血功能恢复有关。同时本研究结果验证了AA患者存在骨髓造血微环境异常,这为再障免疫学提供新的理论参考。
