纳米磁珠联合MALDI-TOF-MS技术在甲状腺微小乳头状癌诊断中的应用价值
2019-01-15詹宇红马丽珍张险峰黄佼韩辉徐哲奕
詹宇红 马丽珍 张险峰 黄佼 韩辉 徐哲奕
近年来,甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)的发病率越来越高。PTMC由于瘤体小,易导致误诊、漏诊。纳米磁珠联合基质辅助激光解吸电离飞行时间质谱(magnetic bead combined with matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)技术是一种蛋白质组学研究手段,在临床上主要应用于相关疾病尤其是恶性肿瘤的诊断和鉴别,具有较高的灵敏度和特异度。本研究拟应用纳米磁珠联合MALDI-TOF-MS技术,检测PTMC患者的血清蛋白标志物,筛选PTMC患者血清中的特异性表达差异蛋白,并结合生物信息学方法建立诊断模型。
1 对象和方法
1.1 对象 抽取2014年1月至2016年1月我院65例PTMC患者血清和45例健康体检者血清。所有PTMC经2位病理学专家证实。血清标本按随机数字表法分为试验组60例(包括PTMC 35例,健康体检者血清25例)和验证组50例(包括PTMC 30例和健康体检者血清20例)。
1.2 主要材料和仪器 三氟乙酸、芥子酸饱和溶液、去离子水购自日本Sigma公司。处理液、缓冲液、弱阳离子交换型纳米磁珠试剂盒来自浙江爱睦世医学科技有限公司。MALDI-TOF-MS质谱仪来自美国Ciphergen Biosystems公司。
1.3 方法
1.3.1 标本采集 所有受试者空腹经肘静脉采血2ml,采集后立即于 4℃冰箱静置 2h,4℃、4000r/min离心10min分离血清,将血清于 4℃、12000r/min离心10min,去除所有残留细胞碎片和不溶物,在冰上将血清转移到新的离心管中,保存于-80℃冰箱。避免反复冻融。
1.3.2 血清样品处理 从-80℃冰箱中取出血清,于4℃、10000r/min离心 5min。取 10μl血清样品,加20μl U9处理液。充分混匀,冰浴振荡30min后取出,加入370μl结合缓冲液立即混匀。
1.3.3 芯片及磁珠清洗 将蛋白芯片装入bio-缓冲液,室温振荡洗涤2次,5min/次,甩干。每离心管分别加入100μl磁珠溶液,置磁性处理器上,吸去上清液,加入200μl缓冲液,室温下磁性处理器洗涤2次,5min/次,吸干液体,再用去离子水洗涤1次,吸干液体。
1.3.4 样品的磁珠处理及上样 采用弱阳离子交换型纳米磁珠试剂盒对样品进行处理,具体如下:加至已处理好的弱阳离子交换型纳米磁珠的离心管中,置磁性处理器上孵育,除去液体,加弱阳离子交换型纳米磁珠结合缓冲液至已装好磁珠的离心管,置磁性处理器上孵育,除去液体,重复上述操作2次,加5%三氟乙酸洗脱液20μl,反应8min,置磁性处理器至液体上清。取5μl上清液移植至另一个离心管中,加入5μl芥子酸饱和溶液充分混匀,取1μl混合溶液加样到Au芯片上,晾干后上MALDI-TOF-MS质谱仪读取信息,收集数据。
1.4 统计学处理 应用Biomarker Wizard软件,对所有蛋白质指纹图谱数据进行统计学分析(Mann-Whitney U检验),计算P值,找出试验组间血清蛋白质峰的差异。在此基础上应用Biomarker Patterns5.0软件识别诊断PTMC最佳标志物,建立决策树诊断模型。验证组中验证模型。对诊断和验证结果均采用ROC曲线,AUC作为准确度评价指标。P<0.05为差异有统计学意义。
2 结果
2.1 模型构建 收集并分析试验组中35例PTMC患者和25例健康体检者血清蛋白质指纹图谱数据,在质荷比m/z为2000~50000范围内检测共得到两者间表达差异有统计学意义的蛋白质峰19个,其中单独区分PTMC和健康体检者能力最强的2个差异蛋白质峰 m/z为 7979.56、3320.19(表 1),建立决策树模型(图1),所构建组合可达到最佳诊断效果。用此模型分析35例PTMC样本,其中35例区分正确,灵敏度为1;分析25份正常健康体检者样本,24份区分正确,1份区分错误,特异度为0.96。AUC为0.981(图2)。

表1 试验组PTMC患者和健康体检者差异蛋白质峰的表达
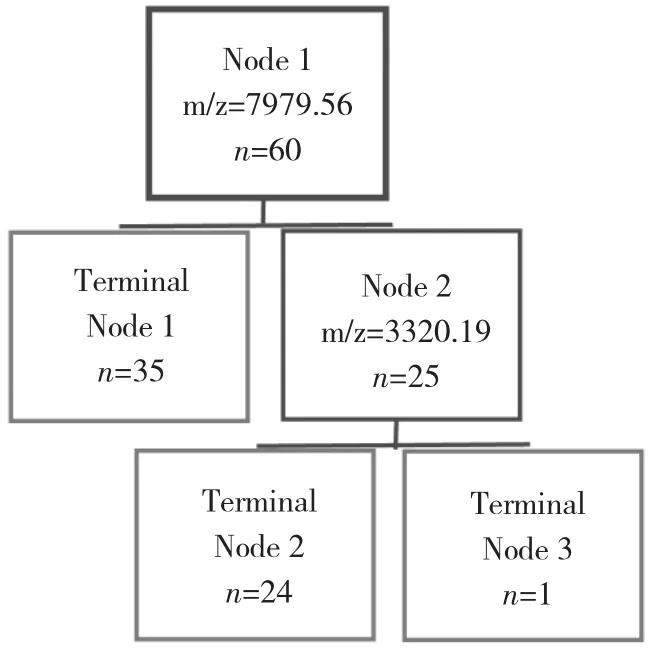
图1 试验组PTMC患者与健康体检者血清决策树
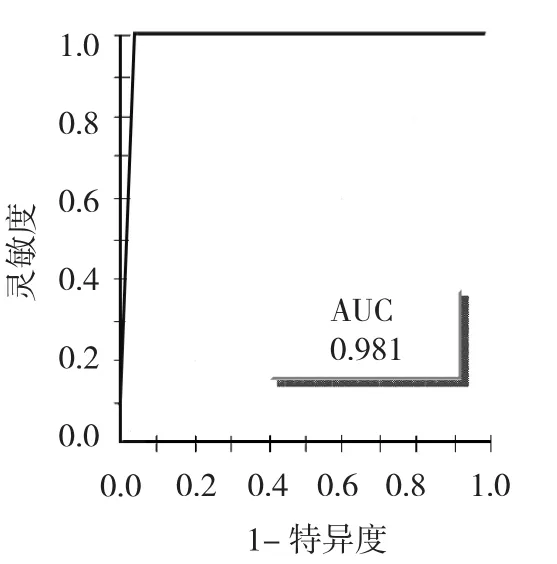
图2 试验组诊断模型ROC曲线
2.2 验证模型 用m/z为7979.56、3320.19差异蛋白质峰组成的诊断模型盲法分析验证组50例血清蛋白质指纹图谱。30例PTMC患者血清样本中26例区分正确,4份区分错误,灵敏度为0.87;20份正常健康体检者血清样本中18份区分正确,2例区分错误,特异度为0.90。盲法验证的AUC为0.910(图3),进一步验证了所建立模型的准确性。

图3 验证组诊断模型的ROC曲线
3 讨论
201 4年WHO公布的全球癌症报告中指出,甲状腺癌新发病例中超过50%为PTMC,占甲状腺癌诊疗的重要比例。超声影像检查及超声引导下细针穿刺是首选的诊断手段,但也存在一定的漏诊。PTMC临床漏诊的原因主要包括:(1)病灶小而隐蔽,触诊很难发现;(2)超声影像学人员技术局限;(3)细针穿刺结果不能诊断或意义未明。2016年我国发布了针对PTMC的诊治指南,认为PTMC有较好的生物学行为,总体治疗效果好,多数经外科手术可根治,5年生存率可达98.5%[1],但也有部分患者可出现淋巴结转移、远处转移及肿瘤复发[2],故也需要提高诊断率,确定合适的治疗时机和方式。有研究发现超声弹性成像对于甲状腺微小癌的诊断具有较高的诊断价值,灵敏度0.881、特异度0.894[3],也有探讨其它放射学手段如核磁共振质子波谱分析[4],单源双能谱CT成像[5]诊断PTMC,但指南并不推荐。辅助分子标志物的检测可使PTMC的术前诊断率进一步提升,对细针穿刺细胞学不确定的,可联合如BRAF分子标志物的检测,基因突变检测在判断疾病侵袭性、预测复发、判断预后上可能具有更大的临床价值[6]。
MALDI-TOF-MS技术由质谱技术发展而来,是一种包含层析与质谱的特殊蛋白质芯片技术,综合了芯片微阵列与质谱技术两者的优点,能很好地捕获人血清中的小分子多肽和蛋白质,在临床上主要应用于胃癌、卵巢癌、肺癌[7-9]等恶性肿瘤的诊断和鉴别,寻找新的肿瘤标志物。在甲状腺领域,也有利用该技术检测血清标本,建立过甲状腺恶性结节的血清蛋白质指纹图谱诊断模型,特异度为0.83,灵敏度为0.88[10]。本研究采用纳米磁珠联合MALDI-TOF-MS技术,对血清高通量筛选PTMC表达的各种蛋白质,发现有价值的蛋白质分子,确定和筛选特异的肿瘤标志物,建立了PTMC血清蛋白质指纹图谱诊断模型,诊断灵敏度0.87,特异度0.90,可能成为一种有效的辅助诊断手段,但是需要进一步扩大样本量进行验证,以期为PTMC的合理诊断及治疗提供有价值的信息。
