出生前PM2.5暴露对成年期小鼠肝脏纤维化发生的影响及机制研究
2019-01-14李政一施懿宸徐申亚王晓珂
李政一 施懿宸 徐申亚 王晓珂


【摘要】 目的:探討出生前PM2.5暴露对成年小鼠肝脏纤维化的影响及其相关机制。方法:20只未经产的4周龄的SPF级C57BL/6J雌性小鼠随机分为对照组(n=10)和PM2.5暴露组(n=10),暴露7周之后,按照雌雄2︰1的比例合笼并继续暴露至子鼠出生,出生后的雄性子鼠饲养至32周。处死后,观察出生前PM2.5暴露对小鼠体重、生化指标(TC、TG、AST、ALT)、肝脏组织纤维化及相关基因表达(TGF-β1、α-SMA、CollagenⅢ)、氧化应激(SOD活性、MAD含量)和炎性指标(TLR4和TNF-α)基因表达的影响。结果:PM2.5暴露组小鼠出生体重低于对照组,成年期体重、肝脏组织TG含量均高于对照组,差异均有统计学意义(P<0.05);两组血清TC、TG、AST、ALT水平比较,差异均无统计学意义(P>0.05);PM2.5暴露组小鼠肝脏组织中TGF-β1、α-SMA、CollagenⅢ的mRNA表达水平和蛋白表达灰度值均高于对照组(P<0.05);出生前PM2.5暴露组小鼠肝脏SOD活性低于对照组,肝脏组织MAD含量、TLR4和TNF-α的mRNA表达均高于对照组,差异均有统计学意义(P<0.05)。结论:出生前PM2.5暴露显著增加小鼠成年期肝脏脂肪酸和胶原蛋白的蓄积,降低肝组织中SOD活性、增加MAD含量及炎性基因的水平,并上调TGF-β1、α-SMA和Collagen Ⅲ基因的表达,可通过激活TGF-β1信号通路诱导肝纤维化的发生。
【关键词】 出生前 PM2.5 肝脏纤维化
[Abstract] Objective: To explore the effect of prenatal PM2.5 exposure on liver fibrosis in adult mice and its related mechanism. Method: Twenty four-week-old female SPF C57BL/6J mice were randomly divided into control group (n=10) and PM2.5 exposure group (n=10). After 7 weeks of exposure, the mice were caged at a ratio of 1︰2 for males and females and continued to be exposed to the birth of their offspring, male offspring were fed for 32 weeks after birth. After death, the effects of PM2.5 exposure on body weight, biochemical indexes (TC, TG, AST, ALT), liver fibrosis and related gene expression (TGF-β1, α-SMA, CollagenⅢ), oxidative stress (SOD activity, MAD content) and inflammatory index (TLR4 and TNF-α) gene expression were observed. Result: The birth weight of mice in PM2.5 exposure group was lower than that of control group, the adult body weight and the content of TG in liver tissue were higher than those of control group, the differences were statistically significant (P<0.05). The levels of serum TC, TG, AST and ALT were compared between the two groups, the differences were not statistically significant (P>0.05). The mRNA expression levels and the protein expression gray levels of TGF-β1, α-SMA, CollagenⅢ of liver tissue in PM2.5 exposure group were higher than those of control group, the differences were statistically significant (P<0.05). SOD activity of liver in PM2.5 exposure group was lower than that of control group, MAD content, TLR4 and TNF-α expression in liver tissue of PM2.5 exposure group were higher than those of control group, the differences were statistically significant (P<0.05). Conclusion: Prenatal PM2.5 exposure significantly increased the accumulation of fatty acids and collagen in the liver of adult mice, decreased SOD activity, increased MAD content and the level of inflammatory genes, and increased the expression of TGF-β1, α-SMA, CollagenⅢ genes, which could induce liver fibrosis by activating the TGF-β1 signaling pathway.
[Key words] Prenatal PM2.5 Hepatic fibrosis
First-authors address: Department of Occupational Medicine and Environmental Toxicology, School of Public Health, Nantong University, Nantong 226019, China
doi:10.3969/j.issn.1674-4985.2019.30.009
随着经济的发展,空气污染成为目前全球面临的重要问题。PM2.5作为空气动力学直径≤2.5 μm的细颗粒物,主要由金属、盐分、含碳化合物、挥发性有机化合物、多环芳烃、内毒素等化学和生物成分组成[1-2]。目前,PM2.5对人体健康的影响已成为国内外研究的热点。研究发现,PM2.5暴露与呼吸系统、心血管系统以及糖尿病的发生密切相关[3]。Li等[4]的流行病学调查结果显示,环境空气污染与肝脏脂肪变性呈正相关。Qiu等[5]的动物模型结果也表明,断乳后的小鼠PM2.5暴露可以诱导肝脏脂质蓄积增加甚至肝脏纤维化的发生[6],提示出生后的PM2.5暴露与肝脏损伤密切相关。生命早期作为机体生长发育的窗口期,对外界的不良环境因素异常敏感[7]。Bonzini等[8]的流行病学调查研究发现,孕期PM2.5暴露可导致流产、早产以及低出生体重的发生,而低出生体重通常与成年期的肥胖、糖尿病和肝脏损伤的发生密切相关[9]。笔者前期研究结果也显示,出生前PM2.5暴露可以诱导子代小鼠成年期肥胖的发生[10]。肝纤维化作为各种慢性肝病及肝损伤进展至肝硬化的中间过程,其实质是肝脏对各种肝损伤的瘢痕修复反应,然而,当肝纤维化一旦进展至肝硬化时,将给家庭和社会带来沉重的经济负担[11]。而出生前PM2.5暴露是否可以导致成年期肝脏纤维化的发生,目前还没有相关的研究报道。鉴于汽车尾气颗粒物(diesel exhaust particles,DEP)是PM2.5的重要组分,本研究拟通过咽后壁滴注DEP的方法建立孕前及孕期PM2.5暴露的小鼠模型[12],观察出生前PM2.5暴露对成年期小鼠肝脏纤维化发生的影响并探讨其相关的作用机制。现报道如下。
1 材料与方法
1.1 主要试剂与仪器 C57Bl/6J小鼠购于南通大学实验中心;基础饲料购于上海斯莱康公司;DEP(#SRM 2975)购买于美国国家标准与技术局(Gaithersburg,Maryland,US)。相关试剂盒均购于中生北控生物科技股份有限公司;Trizol和引物序列购于Invitrogen公司;抗体购买于cell signaling公司;RT-PCR试剂购于Takara公司;荧光实时定量PCR仪LC-480购于罗氏公司;全自动生化分析仪(AU5831)购于贝克曼公司。
1.2 DEP混悬液的配制及使用 根据城市严重污染下的PM2.5浓度、小鼠的通气量(24 mL/min)、小鼠和人按体表面积折算的等效剂量比值(9.1),电子天平称取200 mg DEP粉末并溶解于50 mL的无菌磷酸缓冲盐溶液(phosphate buffer saline,PBS)中,配制成滴注用DEP混悬液(4 μg/μL),折算出PM2.5的时间加权浓度约为211 μg/m3。每次滴注前,混悬液进行超声震荡30 min,以达到颗粒物最大程度分散的目的。
1.3 实验动物分组及饲养 20只未经产的4周龄的SPF级C57BL/6J雌性小鼠适应性喂养1周后,随机分为对照组和PM2.5暴露组,每组10只,均为普通饲料喂养。PM2.5暴露组采用小鼠咽后壁滴注DEP混悬液50 μL(4 μg/μL),每周滴注3次(周一、周三、周五)。暴露7周后两组均分别按照雌雄2︰1的比例合笼,雄性亲代子鼠不接受DEP暴露(F0代雌雄小鼠合笼交配后产生F1代雄性小鼠)。子鼠出生后,每窝留取相同只数,保证每只母鼠的哺乳数量一致。断乳之后,留取雄性子鼠继续普通饲料喂养至成年期,每周测量体重,出生后32周,麻醉处死小鼠。
1.4 观察指标 统计新生雄性小鼠出生体重、成年期体重,麻醉处死小鼠后计算新生雄性小鼠肝脏系数(肝脏重量/体重×100%);对照组、PM2.5暴露组分别随机抽取10、8只小鼠的肝脏组织检测甘油三酯(triglyceride,TG)含量;此外,对照组、PM2.5暴露组另分别随机抽取8、6只小鼠,留取血清用于生化指标的检测,肝脏组织固定后用于病理切片的观察,肝脏组织液氮冷冻后用于肝脏组织纤维化相关基因表达及蛋白水平的检测。
1.4.1 生化指标检测 全自动生化分析仪检测血清中总胆固醇(total cholesterol,TC)、TG、谷丙转氨酶(alanine transaminase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)的含量;肝臟组织匀浆之后,分别按照试剂盒说明书检测肝脏TG、超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)的含量。
1.4.2 肝脏组织病理学观察 新鲜肝脏组织经4%多聚甲醛充分固定后,组织石蜡包埋后连续切片,切片为5 μm,常规油红O和天狼猩红染色后,观察肝脏组织的脂肪蓄积和胶原蛋白沉积状况。
1.4.3 实时定量荧光PCR检测肝脏组织相关mRAN表达 按Trizol说明书从小鼠肝脏组织提取总RNA,核酸蛋白测定仪测定相关RNA浓度,在20 μL的反应体系中将3.0 μg的RNA逆转录得到cDNA。自基因库查得目的基因核酸序列,设计PCR引物。引物序列见表1。
1.4.4 Western-blotting检测肝脏组织的相关蛋白表达 取小鼠肝脏组织提取蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳2 h,转膜1 h,5%脱脂牛奶封闭1 h,1︰1 000稀释的一抗分别孵育转化生长因子-β1(transforming growth factor-β1,TFG-β1)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、胶原蛋白Ⅲ(Collagen Ⅲ)和内参β-actin,4 ℃过夜,1︰10 000稀释的二抗孵育1 h,显色液显色后用自动化学发光凝胶成像分析仪Tanon-5200拍照,Image J软件分析蛋白表达量。
1.5 统计学处理 使用SPSS 20.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组间比较采用t或秩和检验,以P<0.05为差异有统计学意义。
2 结果
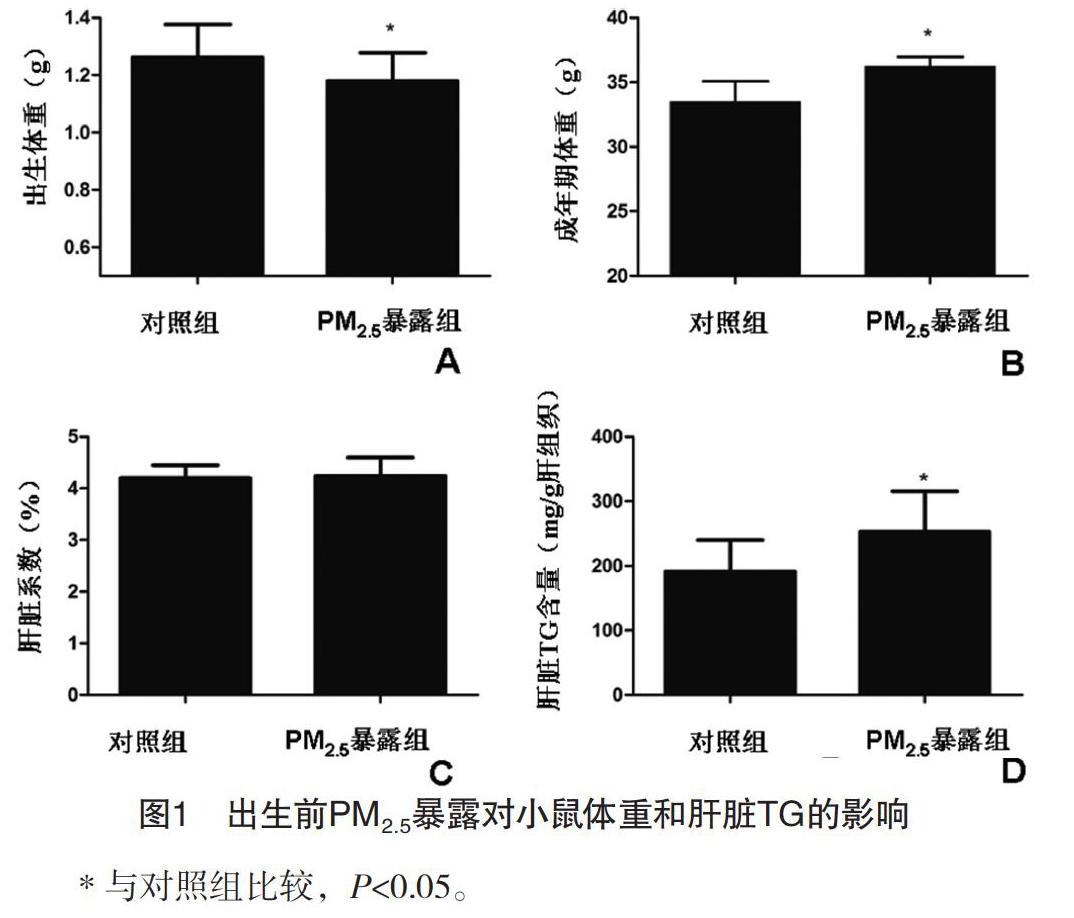
2.1 出生前PM2.5暴露对小鼠体重和肝脏TG的影响 本研究中,对照组新生雄性小鼠22只,PM2.5暴露组新生雄性小鼠17只,全部纳入数据统计;PM2.5暴露组小鼠出生体重(1.18±0.09)g,低于对照组的(1.26±0.11)g,差异有统计学意义(P<0.05),见图1A;PM2.5暴露组成年期体重(36.22±0.75)g,高于对照组的(33.49±1.57)g,差异有统计学意义(P<0.05),见图1B;PM2.5暴露组、对照组小鼠成年期的肝脏系数分别为(4.23±0.36)%、(4.20±0.24)%,差异无统计学意义(P>0.05),见图1C;PM2.5暴露组肝脏组织TG含量(252.81±62.72)mg/g,高于对照组的(191.03±48.63)mg/g,差异有统计学意义(P<0.05),见图1D。
2.2 出生前PM2.5暴露对小鼠血清生化指标的影响 PM2.5暴露组小鼠血清TC、TG分别为(2.20±0.20)、(0.48±0.07)mmol/L,均高于对照组的(2.07±0.17)、(0.43±0.09)mmol/L,但差异均无统计学意义(P>0.05),见图2A、B;PM2.5暴露组AST、ALT分别为小鼠血清(109.50±14.73)、(44.28±14.85)IU/L,均高于对照组的(95.55±17.40)、(40.40±2.63)IU/L,但差异均无统计学意义(P>0.05),见图2C、D。
2.3 出生前PM2.5暴露对成年期小鼠肝脏组织纤维化发生的影响 油红O染色(×200)和天狼猩红染色(×400)结果显示,对照组小鼠肝脏组织肝索结构正常,肝细胞以中央静脉为中心呈放射状排列,无脂肪变性,汇管区少量的胶原沉积;出生前PM2.5暴露组小鼠肝索结构紊乱,同时伴随着脂肪变性和汇管区的胶原沉积以及纤维组织增生的现象。见图3。
2.4 出生前PM2.5暴露对成年期小鼠肝脏组织纤维化相关基因表达及蛋白的影响 对TGF-β信号通路相关因子的mRNA水平和蛋白表达水平进行检测,qRT-PCR结果显示:PM2.5暴露组和对照组小鼠肝脏组织中TGF-β1的表达水平分别为(2.39±0.91)、(0.97±0.45),差异有统计学意义(P<0.01),见图4A;α-SMA表达水平分别为(1.99±0.60)、(1.05±0.30),差异有统计学意义(P<0.05),见图4B;CollagenⅢ的mRNA表达水平分别为(1.52±0.75)、(1.06±0.38),差异有统计学意义(P<0.05),见图4C。Western blotting进一步证实了上述结果,TGF-β1、α-SMA和Collagen Ⅲ的蛋白表达见图5A,PM2.5暴露组小鼠肝脏中TGF-β1、α-SMA、Collagen Ⅲ蛋白表达灰度值分别为(4.78±0.79)、(2.70±0.69)、(1.39±0.31),均高于对照组的(0.79±0.02)、(0.48±0.01)、(0.41±0.12),差异均有统计学意义(P<0.01),见图5B~D。
2.5 出生前PM2.5暴露对肝脏组织氧化应激和炎性基因表达的影响 出生前PM2.5暴露组小鼠肝脏SOD活性(75.44±9.72)U/g,低于对照组的(113.70±44.62)U/g,差异有统计学意义(P<0.05),见图6A;PM2.5暴露组小鼠的肝脏组织MAD含量(12.94±4.41)nmol/g,高于对照组(8.25±3.11)nmol/g,差异有统计学意义(P<0.05),见图6B;PM2.5暴露组小鼠肝脏组织TLR4和TNF-α的mRNA表达含量分别为(2.71±1.21)、(1.91±0.72),高于对照组的(1.08±0.42)、(0.98±0.17),差异均有统学意义(P<0.01),见图6C、D。
3 讨论
肝纤维化的形成的主要原因是由于肝脏受到损害与炎症反应后,肝组织内细胞外基质(ECM)过度增生与异常沉积,导致肝脏内胶原组织的增多,使肝脏结构和肝功能产生异常病变。近年来,随着空气污染的日益加重,PM2.5和肝脏纤维发生的关系也引起了研究者的广泛关注。文献[6,13]发现,出生后单独暴露于PM2.5可诱导小鼠肝脏纤维化的发生。本研究发现,出生前暴露于PM2.5同样可以显著增加肝脏组织胶原纤维的沉积,导致小鼠成年期肝脏纤维化的发生,进一步证实PM2.5暴露与肝脏纤维化的发生密切相关。
已有大量研究发现,静止期肝星状细胞(hepatic stellate cell,HSC)的活化是肝脏纤维化的中心环节,激活的肝星状细胞的增殖和迁移能量明显增加,并可发生表型转化,成为肌成纤维样细胞和成纤维细胞,进而导致肝脏细胞外基质的大量合成,同时,活化的肝星状细胞可分泌各种细胞因子和趋化因子,这些分泌的信号分子可进一步促进HSC细胞的激活[14-16]。α-SMA是肝星形细胞活化的标志,参与合成Ⅰ型胶原、Ⅲ型胶原、纤维连接蛋白等多种细胞外基质成分,促进肝纤维化的发生[17]。本研究进一步检测了各组小鼠肝脏组织α-SMA的表达,结果显示,出生前PM2.5暴露组小鼠α-SMA的表达高于对照组(P<0.05),与前期研究结果一致,提示出生前PM2.5的暴露可程序性调控α-SMA的表达,从而诱导肝星形细胞的活化。
肝星形细胞的活化机制非常复杂,其中TGF-β介导的信号通路是调节肝星状细胞活化的主要途径[18]。TGF-β是一个庞大的超家族,其中哺乳动物TGF-β主要分為TGF-β1、TGF-β2和TGF-β3,其中TGF-β1在肝脏中含量最高且具有生物活性[19]。Zheng等[13]研究结果显示,PM2.5暴露可以显著增加巨噬细胞分泌的TGF-β1的基因和蛋白表达,本研究也发现出生前PM2.5暴露组小鼠的TGF-β1的基因和蛋白表达均高于对照组(P<0.05),与前期研究结果一致,说明TGF-β信号通路在PM2.5诱导的肝脏纤维化中起着重要的作用。
氧化應激和炎性发应是外源性化合物刺激肝脏及其免疫细胞活化并分泌TGF-β1的主要影响因素[20]。以往研究发现,PM2.5暴露之后,肝脏组织的SOD活性降低并伴随着脂质过氧化物的含量升高以及炎性通路因子表达上调[13,21]。本研究结果显示,出生前PM2.5暴露组小鼠的肝脏SOD活性显著降低(P<0.05),MDA含量明显增加(P<0.05),同时炎性因子的表达也显著增加(P<0.05),进一步提示氧化应激和炎性发炎可能是PM2.5诱导肝脏纤维化的始动因素。肝脏线粒体作为氧化应激来源的主要细胞器,在后续研究中,笔者将进一步探讨PM2.5暴露对肝脏线粒体的影响,以期为肝脏纤维化的防治提供科学的依据。
综上所述,生命早期PM2.5暴露与成年期肝脏纤维化发生的关系,同时通过分子生物学研究发现,出生前PM2.5暴露诱导肝纤维化作用的机制是通过启动肝脏内的氧化应激和炎性反应,促进TGF-β1信号通路,激活HSCs,增加ECM的合成来发挥作用的。
参考文献
[1] Zhao J,Gladson L,Cromar K.A Novel Environmental Justice Indicator for Managing Local Air Pollution[J].Int J Environ Res Public Health,2018,15(6):E1260.
[2] Alfaro-Moreno E,Martínez L,García-Cuellar C,et al.Biologic effects induced in vitro by PM10 from three different zones of Mexico City[J].Environ Health Perspect,2002,110(7):715-720.
[3] Cohen A J,Brauer M, Burnett R,et al.Estimates and 25-year trends of the global burden of disease attributable to ambient air pollution:an analysis of data from the Global Burden of Diseases Study 2015[J].Lancet,2017,389(10082):1907-1918.
[4] Li W,Dorans K S,Wilker E H,et al.Residential Proximity to Major Roadways,Fine Particulate Matter,and Hepatic Steatosis:The Framingham Heart Study[J].Am J Epidemiol,2017,186(7):857-865.
[5] Qiu Y,Zheng Z,Kim H,et al.Inhalation Exposure to PM2.5 Counteracts Hepatic Steatosis in Mice Fed High-fat Diet by Stimulating Hepatic Autophagy[J].Sci Rep,2017,7(1):16286.
[6] Ding S,Yu L,An B,et al.Combination effects of airborne particulate matter exposure and high-fat diet on hepatic fibrosis through regulating the ROS-endoplasmic reticulum stress-TGFβ/SMADs axis in mice[J].Chemosphere,2018,199:538-545.
[7] Grandjean P,Barouki R,Bellinger D C,et al.Life-Long Implications of Developmental Exposure to Environmental Stressors:New Perspectives[J].Endocrinology,2015,156(10):3408-3415.
[8] Bonzini M,Carugno M,Grillo P,et al.Impact of ambient air pollution on birth outcomes:systematic review of the current evidences[J].Med Lav,2010,101(5):341-363.
[9] Fleisch A F,Rifas-Shiman S L,Koutrakis P,et al.Prenatal exposure to traffic pollution:associations with reduced fetal growth and rapid infant weight gain[J].Epidemiology,2015,26(1):43-50.
[10] Chen M,Wang X,Hu Z,et al.Programming of mouse obesity by maternal exposure to concentrated ambient fine particles[J].Part Fibre Toxicol,2017,14(1):20.
[11] Hernandez-Gea V,Friedman S L.Pathogenesis of Liver Fibrosis[J].Annu Rev Pathol,2011,6(1):425-456.
[12] De Vooght V,Vanoirbeek J A,Haenen S,et al.Oropharyngeal aspiration:an alternative route for challenging in a mouse model of chemical-induced asthma[J].Toxicology,2009,259(1-2):84-89.
[13] Zheng Z,Xu X,Zhang X,et al.Exposure to ambient particulate matter induces a NASH-like phenotype and impairs hepatic glucose metabolism in an animal model[J].J Hepatol,2013,58(1):148-154.
[14] Higashi T,Friedman S L,Hoshida Y.Hepatic stellate cells as key target in liver fibrosis[J].Adv Drug Deliv Rev,2017,121:27-42.
[15] Lee Y,Friedman S L.Fibrosis in the liver:acute protection and chronic disease[J].Prog Mol Biol Transl Sci,2010,97:151-200.
[16] Mederacke I,Hsu C C,Troeger J S,et al.Fate tracing reveals hepatic stellate cells as dominant contributors to liver fibrosis independent of its aetiology[J].Nat Commun,2013,4:2823.
[17]武希润,吕敏和,王琦,等.α平滑肌肌动蛋白表达及血浆 转化生长因子β1变化在肝纤维化发生发展中的作用[J].中华肝脏病杂志,2004,12(7):400-402.
[18] Fabregat I,Moreno-Càceres J,Sánchez A,et al.TGF-β signalling and liver disease[J].Febs Journal,2016,283(12):2219-2232.
[19] Tefferi A.Pathogenesis of myelofibrosis with myeloid metaplasia[J].J Clin Oncol,2005,23(33):8520-8530.
[20]张忠佩,秦元华,任一鑫,等.氧化应激反应对肝纤维化形成研究的进展[J].中国病原生物学杂志,2017,12(11):1130-1133.
[21] Liu X,Meng Z.Effects of airborne fine particulate matter on antioxidant capacity and lipid peroxidation in multiple organs of rats[J].Inhal Toxicol,2005,17(9):467-473.
(收稿日期:2019-07-08) (本文編辑:董悦)
