微生物源谷氨酰胺转胺酶修饰蛋白质机理及其在食品方面的应用进展
2019-01-14李明奇贺稚非李洪军
李明奇,贺稚非,2,李洪军,2*
1(西南大学 食品科学学院,重庆,400715) 2(西南大学 重庆市特色食品工程技术研究中心,重庆,400715)
谷氨酰胺转氨酶(Transglutaminase,EC2.3.2.13,简称TGase或TG),又名转谷氨酰胺酶,可以通过催化酰基转移反应使蛋白质分子中谷氨酰胺残基和伯胺类物质发生交联[1],因其安全无毒且催化得到的蛋白质产物可以被人体消化吸收,所以在食品行业中被广泛用来修饰蛋白质[2],可以使蛋白质发生分子间或分子内交联或使蛋白质发生脱酰胺以及糖基化,从而改善食品的理化和功能性质。该酶来源较广,在动植物和微生物中均有发现,相比于动植物来源,微生物源谷氨酰胺转氨酶(microbialtransglutaminase,MTGase)产量较高、价格适中,最关键的是具有较优的酶学特性,如反应最适pH范围广、耐热性强、催化活性不依赖Ca2+、受酶抑制剂和金属离子的影响小、底物特异性低等优点[3]而备受关注。
目前,国内对MTGase的应用研究较多,但是缺乏对该酶活性位点和作用机理的系统性总结。该文以此为出发点,通过查阅近年的文献资料,概述了MTGase催化蛋白质交联、脱酰胺和糖基化的作用机理,介绍了其在食品工业中的最新应用,以期对该酶的后续研究和应用提供理论依据。
1 微生物源谷氨酰胺转氨酶
1.1 MTGase的性质
1989年ANDO等[3]从5 000株来自土壤环境的微生物群落中筛选出一株链轮丝菌StreptoverticilliumS-8112可以产MTGase,该酶分子量为37 863,等电点为 8.9,最适pH值为5~7,最适反应温度为50℃,除了Zn2+、pb2+和Cu2+会抑制其活性外,不受其他金属离子的干扰,在酶抑制剂方面,乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)和苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)对其活性无影响,氯汞苯甲酸酯(parachloro-mercuri-benzoate, PCMB)、N-乙基顺丁烯二酰亚胺(N-ethylmaleimide, NEM)和碘乙酸(monoiodoacetate, MIA)会抑制其部分活性,但与来源于豚鼠肝脏的谷氨酰胺转氨酶(GTGase)相比,MTGase受到的抑制作用较小。随后又陆续发现了茂源链霉菌(Streptoverticilliummobaraense)[4],放线菌(Actinomadurasp.T2)[5],环状芽孢杆菌(BacilluscirculansBL32)[6],吸水链霉菌(Streptomyceshygroscopicus)[7],枯草芽孢杆菌(Bacillussubtilis)[8],多头绒泡菌(Physarumpolycephahum)[9]等均为产酶菌株。需要注意的是,链霉菌最初分泌的是谷氨酰胺转氨酶酶原,酶原的N-末端结构是α-螺旋,该结构占据了活性位点导致底物无法接触到活性中心,所以酶原不具备催化能力,只有当N-末端的螺旋结构被内源性金属蛋白酶和三肽氨基肽酶裂解解离后才活化成为具有催化活性的转谷氨酰胺酶[10],如表1[3-9,11]所示的不同微生物来源和动物来源的MTGase的性质对比。
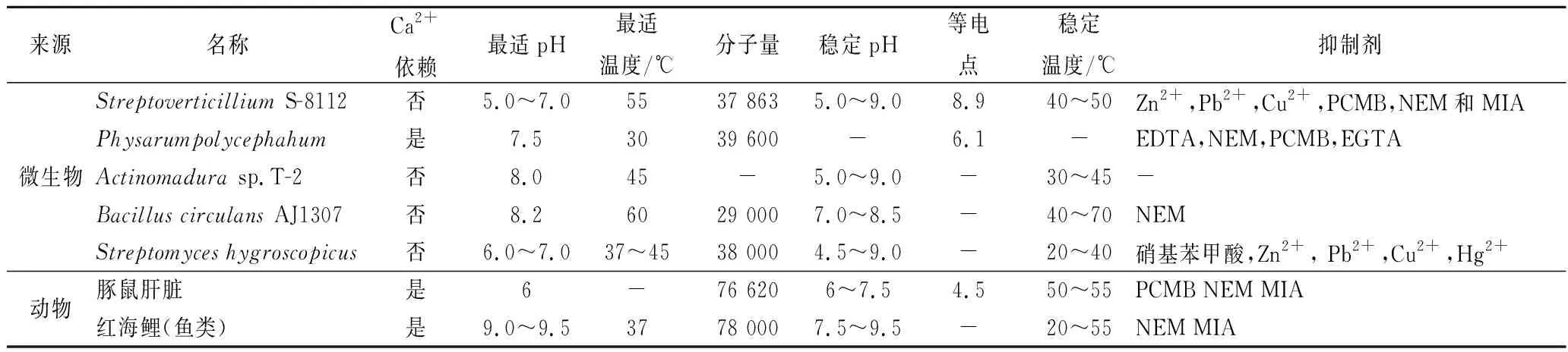
表1 不同来源MTGase的性质Table 1 Properties of MTGase from different sources
1.2 MTGase结构
MTGase的一级结构是由331个氨基酸残基组成的一条多肽链,其氨基酸序列与GTGase的序列完全不同,表明两者没有序列同源性。二级结构显示MTGase属于α+β折叠类酶,有11个α螺旋和8个β-折叠,多分布于多肽的N-末端与C-末端。该酶的晶体结构是一个单一紧凑的结构域,折叠成板状,分子边缘有裂缝,活性位点位于由两个螺旋形成的16Å的裂缝底部。MTGase的催化活性位点是由3个氨基酸组成的三联体结构,即Cys64-His274-Asp255,当利用突变手段将Asp255换成Ala,则酶的活性会大幅度下降,证明Asp255残基在酶催化过程中发挥重要作用,推测Asp255的主要作用是使活性位点的半胱氨酸硫醇去质子化,这也是大部分半胱氨酸蛋白酶催化反应的第一步。而同样利用突变技术测试His274则发现酶活只下降了50%,说明在MTGase中His274对催化效力影响较少,推测其主要作用是利用自身的亲核性与Asp255形成氢键以维护酶活性中心的稳定性。除此之外在活性中心表面还有很多的酸性氨基酸和芳香族氨基酸如Trp和Tyr,这些氨基酸影响了酶对底物的特异性结合。由于活性中心呈现环状结构,其可伸缩性减少了酶与底物之间的位阻,大大提高反应速率,降低了与底物特异性结合[12-13]。在对比动物来源和微生物来源的谷氨酰胺转氨酶的结构时发现,动物性谷氨酰胺转氨酶的活性位点被Cys残基上的Sγ原子和Try残基上的Oη原子组成的氢键覆盖,只有当底物中存在Ca2+,才能使酶的构象发生变化,Try残基从催化位点被释放,暴露活性位点以进行催化反应,而MTGase的Cys64充分暴露在溶剂中,所以不需要Ca2+,且反应迅速[14]。
1.3 MTGase的催化机理
MTGase可以催化酰基转移反应,其中酰基供体是肽链上谷氨酰胺残基的γ-甲酰胺基,受体分为两类:氨基底物和水。氨基底物是指带有伯胺的物质,如蛋白质、多聚物、小分子物质、核酸和功能性碳水化合物等;当底物中没有胺基时,水分子作为底物[15],下面根据受体来源介绍在食品中经常发生的3种反应:蛋白质交联、脱酰胺和糖基化反应。
(1)当底物是肽链赖氨酸残基上的ε-氨基时,则肽链或蛋白质之间通过形成ε-(γ-谷氨基)赖氨酸异肽键(G-L键)实现分子间或分子内交联,形成稳定的蛋白网状结构,这些高分子蛋白质多胺进一步缀合产生大分子聚合物(106~107g/mol),会改变蛋白质的结构和功能性质[16],引入限制性氨基酸,在食品中应用广泛。目前关于两个大分子蛋白怎样对抗空间位阻,从而靠近MTGase酶的活性位点形成交联键的机制尚不明确,但是实验表明只有具有相同热力学相容性的两种蛋白才更容易发生交联,即极性不同的蛋白不易交联,可能是因为热力学相容性不同的蛋白质无法同时到达酶的活性中心而影响催化反应的进行[17]。关于反应具体步骤有一种假设,分为下列四步:①MTGase的活性中心Cys64的硫醇与酰基供体,即谷氨酰胺残基侧链发生亲核加成反应,供体侧链上的碳氧双键打开,与Cys64相连。②活性中心的Asp255将其质子转移到①中形成的含氧阴离子中间体上从而释放胺。③酰基受体,如赖氨酸侧链的ε-氨基接近活性中心,带负电荷的Asp255攻击酰基受体上的质子。④最后赖氨酸残基侧链和谷氨酰胺残基侧链上的含氧阴离子中间体形成交联产物,并与酶脱离[14]。该反应是3种反应中优先进行的,它会一直持续进行直到底物中没有更多的谷氨酰胺和赖氨酸[18]。
(2)当底物中没有氨基时,水成为酰基受体。MTGase水解谷氨酰胺残基的γ-甲酰胺基,发生脱酰胺反应,转化为谷氨酸,该反应会改变蛋白质的等电点和溶解度。目前有一种假说将在食品中添加的MTGase所引起的脱酰胺作用与脂泻病发病率升高联系在一起,虽然没有更进一步的证据,但也应该引起重视[19]。实际上相比于哺乳动物体内的转谷氨酰胺酶来说,MTGase的脱酰胺作用较慢,原因可能是MTGase的活性中心上的Asp255所带的负电荷无法吸引中性基团水分子,而脱酰胺作用中的限速步骤恰好是水分子与活性中心的亲核反应,也可能是两种酶活性中心的His的位置相反,在脱酰胺时起了不同的作用,还可能是不同的酶分子量导致了脱酰胺反应活性的差异,但对此没有明确的结论[20]。所以对于MTGase来说,催化蛋白质交联是最快的反应。
(3)当反应(1)中的赖氨酸残基被其他基团替代,则可将该基团与蛋白质通过共价键交联在一起,当所连接的基团是糖时,则发生蛋白质的糖基化反应,该反应的性质与(1)相似,即含有伯胺基的糖类作为酰基受体,通过MTGase的催化作用与蛋白质结合,该反应的前景在于取代美拉德反应实现蛋白质糖基化[21]。下图为3种机理反应式。

2 微生物源转谷氨酰胺酶在食品应用中的最新进展
MTGase通过催化交联,脱酰胺以及糖基化反应来改变蛋白质的诸多营养与功能性质,如凝胶性、乳化性、起泡性、粘度、持水力等,提高产品的口感与质量。事实上机理和底物的不同对蛋白质性质的影响各异,下面分别介绍MTGase 3种催化反应对蛋白质性质的影响。
2.1 蛋白质交联的应用
2.1.1 交联反应改善蛋白质凝胶性
凝胶是介于固态和液态之间的中间状态,由大分子物质通过共价键或非共价键交联形成高度有序的三维网状结构,该结构可以截留水和一些小分子物质,这一性质对于肉制品、奶制品和一些豆制品极为重要,可以有效改善产品的性质。
在肉制品中,MTGase可以通过交联作用使其中的肌球蛋白重链结构发生变化,减少α-螺旋结构,从而提高β-折叠的百分比,有助于形成高分子量聚合物,所形成的强凝胶结构改善了产品的质地特性,如刚性、弹性、内聚力和粘附性,使肉的口感得到改善,近年来利用MTGase改善水猪肉(pale soft exudative meat, PSE)品质的研究逐渐增多[22]。MTGase的催化作用与反应pH和肌球蛋白等电点有密切联系。HONG等[23]发现在低于猪肌原纤维蛋白等电点(pI=5.0)时,以脱酰胺作用为主,高于5.0时才以交联作用为主。MTGase对于不同来源的肉制品蛋白的影响是显著不同的,效果依赖于肌肉和肌纤维种类,所含氨基酸的种类,含量及是否存在酶抑制剂等因素,但是在所有肉制品中,MTGase只对肌球蛋白有影响,对于肌动蛋白的作用效果并不显著[24]。
在奶制品中MTGase对于κ-酪蛋白的作用是最显著的。因为其位于酪蛋白胶束表面,更容易接近酶的活性中心,而乳清蛋白则不易被交联,因为二硫键使其球形结构十分稳定,只能通过添加还原剂或预热使其结构展开,暴露更多的谷氨酰胺和赖氨酸残基,才能有显著交联作用[25]。MTGase主要用于酸奶和奶酪的制作工艺中,可有效提高酸奶凝胶效率和强度,增强其持水力[26],在奶酪中添加可有效保水,增加产量,改变质构和流变学性质,提高口感,尤其在低脂奶酪中广泛应用[27]。
在豆制品中,MTGase对7Sβ-伴大豆球蛋白的交联作用比11S球蛋白亚基更好,因为β-伴大豆球蛋白中含有更多的谷氨酰胺和赖氨酸,这些都是MTGase的良好底物,从而有助于形成持久且不可逆的凝胶[28],大豆分离蛋白在MTGase的作用下可以作为辅料添加到重组肉制品和发酵乳饮料中,通过交联提高重组肉制品的强度、硬度、粘聚性、咀嚼性和弹性。
2.1.2 交联反应改善蛋白质乳化性
部分食品体系是呈乳浊液的,比如牛奶、酱汤这些属于水包油体系,即油相分散到水相中,还有泡沫型食品,如冰淇淋和蛋糕,即空气分散到水相中,在这两种体系中,蛋白质都是必不可少的表面活性剂。
MTGase提高乳化稳定性的原理与基质有关系,如在面筋蛋白[29]和猪肉肌原纤维蛋白中[30],是交联作用产生的高分子肽聚集到油滴表面产生静电排斥,阻止油滴靠近,从而阻止聚集、絮凝和油水两相分离,提高乳液的稳定性,除此之外,也提高的食品的质地,增加咀嚼性和弹性。而用MTGase处理酪蛋白时发现虽然交联作用会导致溶解度的降低,但是可能由于蛋白构象变化和负电荷的增加,提高蛋白两亲性质的平衡,有助于在油水两相形成更富有弹性的蛋白膜,从而增加了乳化稳定性[31]。在没有面筋蛋白的烘焙产品中,MTGase引起的交联增加了面团的假塑性和坚硬度,共价键的增多也增加了弹性,从而改善产品的咀嚼性[32]。不过除了基底不同外,反应的pH和所加盐浓度也影响反应效果。
2.1.4 交联反应改善流体黏度
流体的黏度是由其内部分子间的摩擦阻力和压差阻力所引起的一种抗流动的性质。溶液中的蛋白质是影响黏度的重要物质之一,蛋白质的分子形状、大小,与溶剂之间的相互作用,水合后其分子构象变化的灵活度以及流体力学体积的大小均影响流体黏度。浓度越高、分子密度和体积越大、它们之间的相互作用力越强、空间越小,所引起的水流动性越低,因此形成更高的流体黏度。在冰淇淋和酸奶中,黏度是很重要的性质之一,直接影响了产品的质量和口感。
在冰淇淋中,MTGase处理组与空白组相比,其粘度显著提高,原因是酪蛋白发生交联形成高分子物质,提高持水力,减少流动性[33],而且随着碳水化合物(如菊粉中的纤维)和其他蛋白质(大豆分离蛋白,乳清蛋白)进一步参与交联反应,黏度会越来越大。这一性质对制作低脂肪冰淇淋尤为重要。也许是由于聚合度增加,MTGase处理后的冰淇淋假塑性也有所提高[34]。
在含大量干酪乳清的酸奶中,MTGase通过交联提高凝胶强度,随着MTGase的增加,聚合物的分子质量进一步增加,所形成的蛋白网络结构有效减少水的流动性,从而使最终产品的粘度显著增加[35]。在MTGase处理时,以β-酪蛋白为底物的酸奶,其粘度上升的速度比以α-酪蛋白作底物的酸奶要快,因为β-酪蛋白的结构松散无序,比α-酪蛋白更容易与酶接触[36]。
2.2 蛋白质脱酰胺的应用
MTGase的脱酰胺作用虽然比交联作用慢很多,但是也对食品中蛋白质的溶解性、乳化性和起泡性有所影响。
蛋白质的溶解性取决于分子表面亲水基团和疏水基团的数量,亲水基团越多,溶解性越高。当然溶液的外在环境也会影响蛋白质溶解性,如离子强度、有机溶剂、pH和温度等,溶解性又会影响其他性质,如乳化性、起泡性、凝胶性等。MTGase可以提高蛋白质的溶解性,主要机理是脱酰胺作用。如在富含谷氨酰胺和天冬酰胺的蛋白质如大豆蛋白和小麦蛋白中,MTGase可以将其转化为谷氨酸和天冬氨酸,降低其等电点,从而提高偏酸性食品中蛋白质的溶解性[37]。还有研究发现在不同pH条件下用MTGase处理猪肉肌原纤维蛋白,肌球蛋白在低于其等电点(pI=5)的条件下溶解度增加,在pH为3的时候溶解性显著提高,其原因是由脱酰胺作用产生的谷氨酸,而且γ-羧基的解离常数在pH=3(Glu-COOH)时比pH>4时(Glu-COO-)大,解离的谷氨酸可以中和质子化的氨基(如Lys-NH3+→Lys-NH2+),减少蛋白质(离子)与水(偶极子)的相互作用[23]。利用MTGase处理豌豆和大豆分离蛋白时,发现脱酰胺作用可以降低蛋白表面疏水性,增加蛋白链之间的静电斥力作用。尽管MTGase会引起蛋白聚合物的形成,但是脱酰胺作用同时增加了蛋白质净负电荷,促进蛋白质聚合物的解离,提高溶解性[38]。
在起泡性方面,以面筋蛋白和大豆分离蛋白为底物时,MTGase的脱酰胺作用通过降低pH,增加极性基团,当空气受到击打或摇晃作用时,蛋白质迅速在水面上展开进而快速吸附在空气-水界面,从而减少表面张力,增加蛋白质之间的相互作用,提高起泡性和泡沫稳定性[37]。而在乳化性方面,其机理在前文提到,即以大豆分离蛋白作底物,MTGase将其中的谷氨酰胺和天冬酰胺转化为谷氨酸和天冬氨酸,增加负电荷量,提高蛋白质的两亲性,使其在油水界面形成稳定的液滴,降低表面张力,提高与水结合的能力,从而提高乳化性。
2.3 蛋白质糖基化的应用
蛋白质糖基化修饰是将糖链连接到蛋白质分子上,可以改变蛋白质的诸多功能性质。常用的方法是美拉德反应,但是该方法存在反应时间长、温度高、条件难以控制、产物易褐变、营养流失、形成有毒的终期糖基化产物(AGEs)等问题[39],限制了其在食品工业中的应用。
酶法可以避免上述问题,根据转谷氨酰胺酶的反应机理,可以将氨基葡萄糖交联到肽链上谷氨酰胺残基的γ-甲酰胺基上,完成糖基化。
例如表2[40-48]所示MTGase催化糖基化反应在食品中的应用。
通过转谷氨酰胺酶使蛋白质糖基化,一方面可以改善蛋白质的功能性质;另一方面也产生了新的糖蛋白产物,这些物质具有抗氧化和抗菌的功效,可以作为添加剂添加到其他食品中[49],或作为保健食品的新来源。但是过度的糖基化也会降低蛋白质的消化率,所以对于某些特定反应会提前脱去蛋白的部分谷氨酰胺残基,防止过度糖基化[50]。
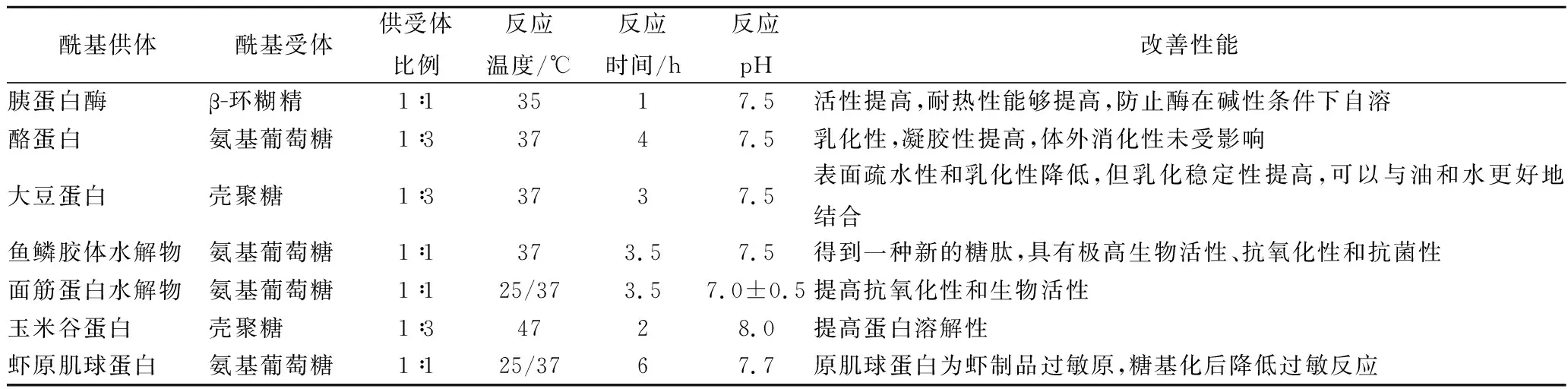
表2 糖基化反应在食品中的应用Table 2 Application of galactosylated modification in the food system
3 展望
微生物转谷氨酰胺酶不仅在食品领域的应用前景十分广阔,在医药和保健品行业的市场需求也与日俱增。在食品领域,作者推测MTGase未来的发展方向如下:
(1)催化过程的控制有待加强。要进一步探究反应机理,反应底物和反应条件的特异性,避免交联不足、过度交联以及产生不均一的产物。
(2)国内市场对MTGase的应用不够广泛。应加大对产MTGase菌株的筛选工作,同时利用诱变技术和工程基因提高MTGase酶活,以降低MTGase的生产成本。
(3)加大对MTGase结构的详细研究。探究其活性位点氨基酸对酶活性的影响,以及与底物结合的作用方式以提高MTGase在食品加工中的精准性。
(4)可以研究与其他技术相结合以提高MTGase的活性和应用范围。如利用超高压、超声波、微波、紫外线等技术处理MTGase,并且优化处理参数。
