杂质离子对黄铜矿浸出的影响机理研究
2019-01-14王洪铎李育彪王新宇
王洪铎 李育彪 王 兵 王新宇
(武汉理工大学资源与环境工程学院,湖北武汉430070)
作为世界上分布最广的含铜矿物[1],黄铜矿(CuFeS2)约占全世界铜资源的70%[2]。尽管有80%~85%的含铜矿物采用火法冶金工艺处理,但由于黄铜矿采出品位逐年下降,使得火法冶金工艺成本高、污染严重等弊端更加突出[3],因此,越来越多的研究者开始关注环境友好、操作简便的湿法冶金工艺[4]。
在黄铜矿湿法冶金的过程中,伴生的脉石矿物常会随之溶解,使杂质离子进入溶液,对浸出产生影响。莫晓兰等[5]在研究杂质矿物对黄铜矿浸出的影响时发现,石英、绢云母能够促进黄铜矿浸出,而白云石含量较高时对铜浸出有明显的抑制作用。黄铜矿中常见的伴生脉石矿物有石英、绢云母、水白云母、白云石、辉石、长石等。云母中Al3+含量较高,同时还含有Na+、K+等,白云石中含有大量Mg2+,辉石中含有Na+、K+、Mg2+、Al3+等杂质离子。
本研究结合实际矿物中脉石矿物的含量[6],并且综合考虑浸出时矿浆浓度的变化等因素,分析不同杂质离子对黄铜矿浸出过程的影响,探究脉石矿物中杂质离子对黄铜矿浸出的作用机制。
1 试验原料及试验设备
1.1 试验原料及试剂
试验所用黄铜矿样品来自澳大利亚某矿山,其XRD分析结果如图1所示。

由图1可知,试验矿样的黄铜矿衍射峰明显,峰型尖锐,表明矿样纯度高,结晶度良好。通过化学滴定法测得矿样中铜含量为30.2%。
试验所用试剂Na2SO4、K2SO4、MgSO4、Al2(SO4)3、NaCl、KCl和H2SO4均为分析纯,购自国药集团化学试剂有限公司,所用浸出剂溶液均由去离子水配制,现配现用。
1.2 试验设备
HH-S4数显恒温油浴锅(金坛市精达仪器制造有限公司),CP224C电子天平(奥豪斯仪器(常州)有限公司),AA240FS火焰原子吸收光谱仪(美国安捷伦公司),Zeiss Ultra Plus扫描电子显微镜(德国)。
2 试验方法
量取400 mL一定浓度的浸出添加剂,加入容积为500 mL的五口烧瓶中,用硫酸调节浸出体系pH=1,待油浴锅温度升至75℃时,将4 g粒度为38~75 μm的黄铜矿置于五口烧瓶中,设置搅拌速度为170 r/min,插入温度计检测反应温度,安装冷凝管减少浸出溶液损失。每次取样1 mL供测试,并进行补液。采用原子吸收光谱仪测试溶液中铜离子浓度,直至待测溶液中铜离子浓度趋于稳定,关闭仪器,结束试验。
3 试验结果与讨论
3.1 阳离子对黄铜矿浸出的影响
研究表明,探究阳离子对黄铜矿浸出的影响时,阳离子浓度范围取10~40 mmol/L为宜[7]。配制阳离子浓度均为20 mmol/L的 Na2SO4、K2SO4、MgSO4、Al2(SO4)3溶液,各取400 mL分别加入五口烧瓶中,在硫酸调节浸出体系pH=1、浸出温度为75℃下进行搅拌浸出试验,结果如图2所示。
由图2可知:Al3+对黄铜矿的浸出有促进作用,在浸出时间为344 h时,浸出率为88.6%;添加Na+后,在浸出时间为264 h时,浸出达到平衡,此时浸出率为72.5%;添加K+后,在浸出时间为272 h时,浸出达到平衡,此时浸出率为70.3%;添加Na+、K+后,浸出率略低于对照组(仅添加H2SO4)的浸出率(78.6%),且K+的抑制作用强于Na+;Mg2+对黄铜矿浸出的抑制效果明显,相比于对照组,浸出平衡时,浸出率下降了36个百分点,表明Mg2+对黄铜矿的抑制作用最强。
3.2 阴离子对黄铜矿浸出的影响
研究表明,探究阴离子对黄铜矿浸出的影响时,阴离子浓度范围取0.5~1 mol/L为宜[8,9]。配制Na2SO4(浓度0.5 mol/L)、K2SO4(浓度0.5 mol/L)、NaCl(浓度1 mol/L)、KCl(浓度1 mol/L)4种溶液,各取400 mL分别加入五口烧瓶中,在硫酸调节浸出体系pH=1、浸出温度75℃下进行搅拌浸出试验,结果如图3所示。
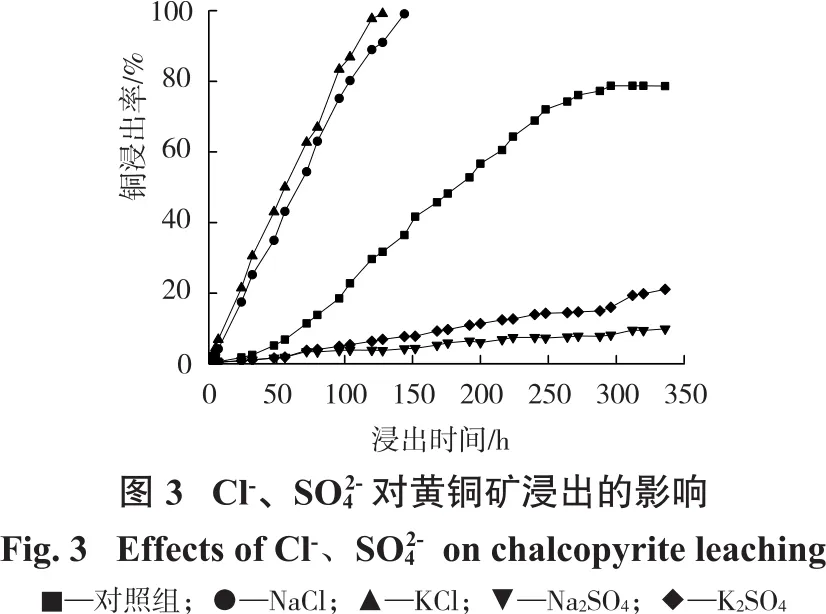
由图3可知:添加Cl-的溶液对浸出有促进作用,加入KCl和NaCl后,铜浸出率分别在128 h和144 h时趋于稳定,此时浸出率分别为99.2%和99.0%;添加的溶液对浸出有抑制作用,添加K2SO4和Na2SO4后,在336 h时铜浸出率分别为21.1%和9.9%,远低于对照组(仅添加H2SO4)在336 h时的浸出率(78.6%)。这是因为在浸出体系中加入Cl-可以增加浸出试样的孔隙度,在物料表面生成疏松多孔的硫层,加快浸出剂通过反应产物层向黄铜矿表面的扩散,促进黄铜矿浸出[8,10]。同时,Cl-可以增加溶液中Cu2+含量,提高浸出体系的临界电位,提高黄铜矿的浸出率[10-13]。
3.3 杂质金属离子与Cl-对黄铜矿浸出的协同影响
从前文可知,Al3+对黄铜矿浸出起促进作用,Mg2+对黄铜矿浸出起抑制作用,而Cl-对黄铜矿浸出起到了显著的促进作用。为探究上述2种杂质金属离子与Cl-对黄铜矿浸出的联合作用,配制NaCl(浓度1 mol/L)、NaCl+MgSO4(NaCl浓度 1 mol/L、MgSO4浓度20 mmol/L)、NaCl+Al2(SO4)3(NaCl浓度 1 mol/L、Al2(SO4)3浓度20 mmol/L)3种溶液,各取400 mL分别加入五口烧瓶中,在硫酸调节浸出体系pH=1、浸出温度75℃下进行搅拌浸出试验,结果如图4所示。
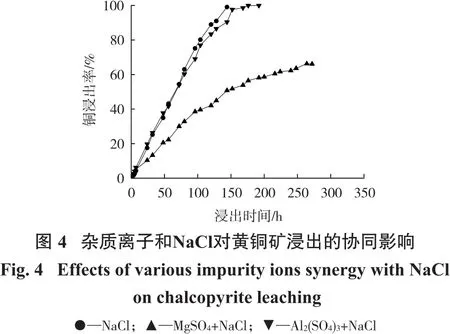
由图4可知:Al3+的促进作用在添加Cl-后不再显著,添加Al2(SO4)3+NaCl后,铜浸出率在浸出时间为192 h时趋于稳定,此时铜浸出率为99.9%,仅添加NaCl时,铜浸出率在浸出时间为144 h时趋于稳定,此时铜浸出率为99.0%;在添加Cl-后,Mg2+依然对浸出具有较强的抑制作用,当浸出反应趋于稳定时,铜浸出率为66.1%,低于只加NaCl的对照组。因此,添加NaCl后,Al3+的促进作用不再显著,但Mg2+对于浸出的抑制作用依然很强。因此,在进行黄铜矿浸出之前,针对性地除去富含Mg2+的白云石、菱镁矿和其他碳酸盐矿物等对浸出有益。
4 动力学分析
缩核模型被广泛应用于黄铜矿浸出动力学的研究[3,14]。若黄铜矿浸出过程受扩散反应控制,则符合式(1)[15-17],受界面化学反应控制,则符合式(2)[18-19]:

式中,X为铜浸出率,t为浸出时间,k1和k2为动力学常数。
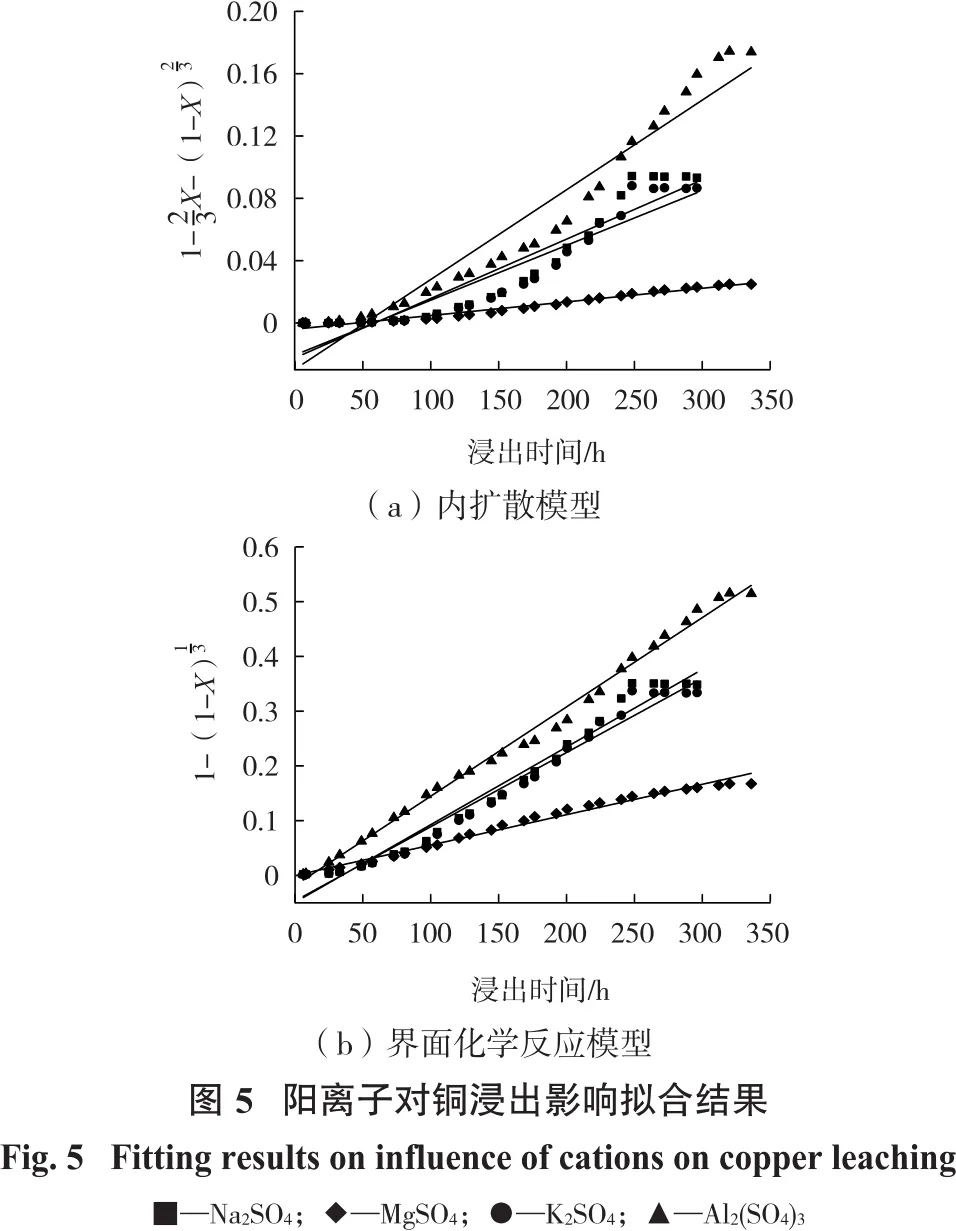
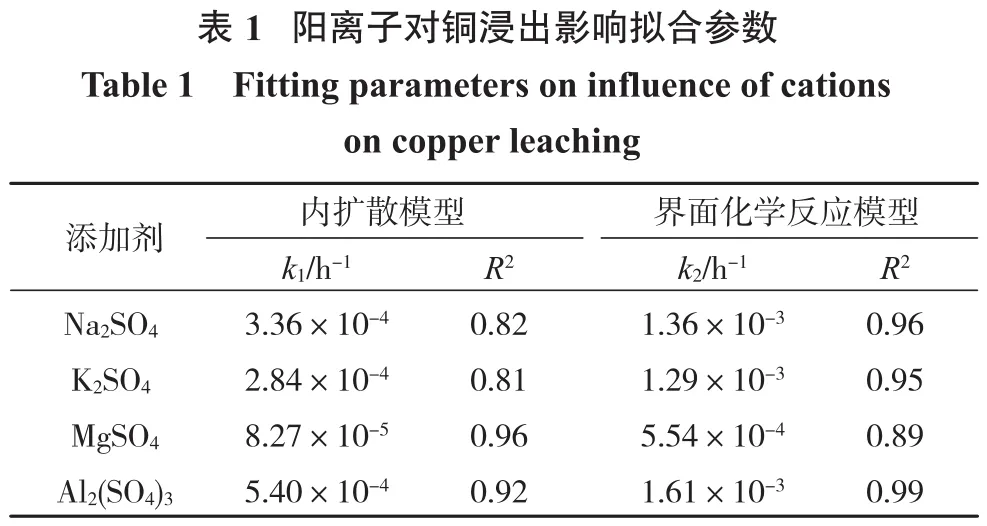
将图2试验数据分别对式(1)和式(2)进行线性拟合,结果如图5和表1所示。
由表1可知:以Na2SO4、K2SO4和Al2(SO4)3为添加剂时,界面化学反应模型的拟合度R2都高于内扩散模型,结合图2可知,浸出平衡时黄铜矿的浸出率高,钝化层对浸出的抑制作用不明显,表明浸出过程更符合界面化学反应模型,即界面化学反应处于主导地位;以MgSO4为添加剂时,内扩散模型的拟合度R2高于界面化学反应模型的拟合度。结合图2可知,Mg2+作用下,铜浸出受到了明显的抑制,表明Mg2+增强了钝化层的抑制作用,降低了浸出剂通过固态产物层到达黄铜矿表面的速率,从而抑制了浸出反应的进行。
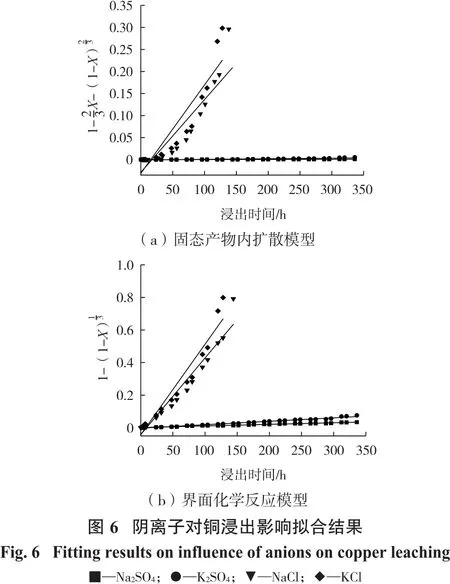
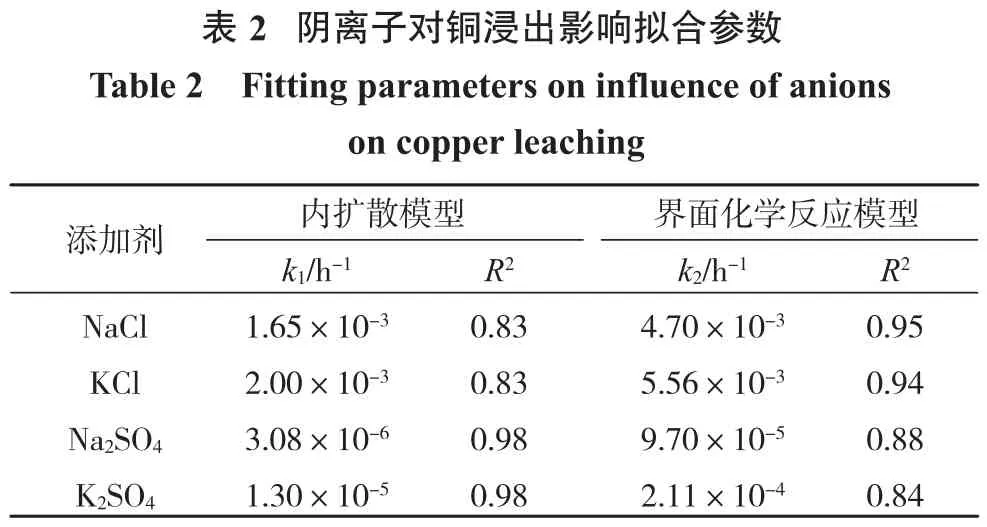
将图3试验数据分别对式(1)和式(2)进行线性拟合,结果如图6和表2所示。
由表2可知,以NaCl和KCl为添加剂时,对于界面化学反应模型的拟合度R2高于内扩散模型的拟合度,由图3可知,以NaCl和KCl为添加剂时浸出效果较好,钝化层对浸出的抑制作用不明显。进一步说明了在Cl-存在条件下钝化层对浸出的抑制作用很小,内扩散速度较快;以Na2SO4和K2SO4为添加剂时,对于内扩散模型的拟合度R2高于界面化学反应模型的拟合度,结合图3可知,此时浸出效果较差,钝化层的抑制作用很强,内扩散反应处于主导地位。

5 SEM分析
选取对照组(仅添加H2SO4)、添加1 mol/L NaCl、添加0.5 mol/L Na2SO4试验条件下浸出反应平衡后的产品进行SEM分析,结果如图7所示。
由图7可知,仅添加H2SO4时,矿物表面存在较为致密的钝化层,添加NaCl组的矿物表面可以看到疏松多孔的钝化层,添加Na2SO4的矿物表面的钝化层呈絮状,结构紧密,且有明显的金属缺陷现象,结合浸出试验数据可知这种絮状钝化层对浸出有明显的抑制作用。
6 结论
(1)Al(2SO4)3对铜浸出起促进作用,而Na2SO4、K2SO4存在时,铜浸出率略低于对照组(仅添加H2SO4)的浸出率(78.6%)。MgSO4存在时,铜浸出率显著降低。存在时,铜浸出率显著降低;Cl-可在黄铜矿表面产生疏松多孔硫层,加快浸出剂的扩散,从而对铜浸出起促进作用。Al3+的促进作用在添加Cl-后不再显著,添加Cl-后,Mg2+对浸出的抑制作用依然很强。
(2)添加Na+、K+、Al3+时,黄铜矿浸出过程由界面化学反应控制;而Mg2+存在时黄铜矿浸出由扩散反应控制;添加Cl-时,黄铜矿浸出受界面化学反应控制;添加时,黄铜矿浸出由扩散反应控制。在进行黄铜矿浸出之前,针对性地除去富含Mg2+的白云石、菱镁矿和其他碳酸盐矿物等对浸出有益。
