鱼藤酮致帕金森病大鼠模型的行为学与病理损伤的研究
2019-01-14袁小凡赵庆余张艺峰张昭强
闫 雪 袁小凡 赵庆余 张艺峰 张 丽 张昭强
(1.泰山医学院基础医学院,山东 泰安 271000; 2. 泰安市中医医院功能检查科,山东 泰安 271000)
帕金森病(Parkinson’s disease, PD)是一种常见的中枢神经系统退行性疾病,主要临床表现包括静止性震颤、运动迟缓、肌强直和姿势步态异常,以黑质(substantia nigra, SN)多巴胺(dopamine, DA)能神经元退行性变性死亡和残存的神经元内形成Lewy小体(Lewy bodies,LBs)为主要病理特征[1]。尽管PD病因现今并未明确,包括遗传、基因突变、炎症反应、氧化应激、线粒体功能障碍和环境因素等多种原因都参与了PD的发病过程[2]。环境中的有害物质已被证实是PD的重要致病因素之一,已经越来越引起人们的重视[3]。鱼藤酮(Rotenone)是一种从豆科植物中提取的脂溶性的杀虫剂,可以透过血脑屏障进而造成黑质多巴胺能神经元选择性的死亡[4]。近年来已有多项研究证实鱼藤酮给药后,可以成功制作包括大小鼠在内的不同的PD动物模型[5-6]。但相应模型的制作方法具有操作复杂、需要特殊设备、费用昂贵和模型成功率低等缺点,并未在PD的研究中广泛应用。本研究通过长期小剂量给予Wistar大鼠腹腔注射鱼藤酮中链甘油三酯乳液(medium-chain triglyceride, MCT),通过对动物行为学和黑质病理的相关检测,成功制作出了操作简便、成功率高的PD大鼠模型,并对其行为学及病理学变化进行了检测,以期为今后PD进一步的相关研究提供参考。
1 材料与方法
1.1 大鼠分组及处理
雄性Wistar大鼠32只(清洁级,北京维通利华实验动物技术有限公司提供),体重(280±20)g,喂养室温20~24 ℃,50%~60%相对湿度,在12∶12 h循环昼夜光照条件下生活,自由取食、饮水。将动物随机分为4组,包括正常对照组8只,生理盐水对照组8只,溶剂对照组8只,鱼藤酮模型组8只。正常对照组不做任何处理,生理盐水对照组腹腔注射生理盐水1 ml/(kg·d),溶剂对照组腹腔注射无鱼藤酮的MCT溶剂1 ml/(kg·d),鱼藤酮模型组腹腔注射鱼藤酮药物(3 mg/mL)1 ml/(kg·d),各组大鼠均连续注射21天。实验前大鼠适应1周实验室环境。
1.2 大鼠行为学检测
1.2.1方桥实验 将木质方桥置于置物架上,离地60 cm。将不同组别的大鼠放置于方桥中间,记录大鼠在方桥上的存留时间,如果大鼠一直存留在方桥上,最长记录时间为120 s。大鼠间隔10 min以上进行重复测量,计测3次后取平均值。
1.2.2旷场实验 将待测大鼠轻放入方盒(55cm× 55cm× 50 cm)中央,通过视频采集分析系统自动记录10 min的大鼠自主活动。使用美国Deacon公司分析软件自动计测每只大鼠的行走速度,记录数值。
1.3 大鼠脑组织切片免疫荧光染色
各组大鼠水合氯醛麻醉后,迅速使用生理盐水和4%多聚甲醛进行灌注固定,梯度沉糖、脱水后,包埋剂充分包埋,进行连续冠状面的冰冻切片,片厚25 μm。将脑组织切片放入6孔板,0.01 mol/L PBS漂洗3次,每次5 min;经0.01 mol/L PBST配制的10%的山羊血清室温孵育30 min;分别加入兔抗大鼠酪氨酸羟化酶(tyrosine hydroxylase, TH)一抗(1∶2000, Millipore, 美国);阴性对照加同体积的0.01 mol/L PBST,室温孵育30 min后,置于4 ℃摇床过夜;0.01 mol/L PBS漂洗,5 min×3次;加入驴抗兔荧光二抗(1∶500, Invitrogen, 美国),室温孵育60 min;0.01 mol/L PBS漂洗5 min×3次; 70%甘油磷酸盐缓冲液封闭;荧光显微镜下观察、拍照并在40倍镜下对黑质(substantia nigra,SN)区TH(+)神经元进行计数,镜下记测4个不同视野的神经元数量,取均值进行统计分析。
1.4 大鼠脑组织SN区蛋白表达的检测
各组大鼠水合氯醛麻醉后,完整取出大鼠大脑组织,迅速在冰上使用采样器准确取出含有完整SN区的脑组织,加入组织裂解液,冰上充分研磨、裂解30 min,4℃;离心12000 r/min,20 min,取上清进行蛋白电泳,300 mA稳流进行转膜,1 h;10%的脱脂奶封闭,室温2 h;用5%的脱脂奶稀释TH(1∶2000, Millipore, 美国)和β-actin(1∶10000, Santa Cruz, 美国)的一抗,4 ℃,过夜;用TBST摇洗3次,每次10 min;用TBST稀释二抗,稀释比例为1∶10000,室温摇1 h,TBST摇洗3次,每次10 min;在膜的蛋白面滴加化学发光试剂1 min,置于UVP化学发光观测系统内进行观察测量。
1.5 统计学分析
2 结 果
2.1 鱼藤酮对大鼠体重变化的影响
鱼藤酮模型组大鼠造模期间体重明显减轻,伴有拒捕行为减弱,弓背、竖毛、毛色发黄变脏,进食量减少,动作迟缓,主动活动减少,部分大鼠出现步态不稳或不能直线行走。造模2周与3周后,模型组大鼠体重较各对照组大鼠体重显著性下降(P<0.05,P<0.01),各对照组大鼠间体重差异无统计学意义。如表1所示。
2.2 鱼藤酮对大鼠行为学检测的影响
通过方桥实验和旷场实验分别检测了各组大鼠运动功能的变化情况。方桥实验显示(表2),鱼藤酮模型组大鼠造模2周和3周后,与对照组相比,方桥存留时间出现显著性下降(P<0.01);旷场实验显示(表3),鱼藤酮模型组大鼠造模2周和3周后,与对照组相比,运动速度显著性减慢(P<0.01);各对照组大鼠间行为学相关检测差异无统计学意义。行为学检测结果显示,鱼藤酮模型组大鼠出现了明显的运动功能障碍。

表1 各组大鼠造模期间体重的变化(g)
注:与各对照组比较,*P<0.01,**P<0.05。

表2 各组大鼠方桥存留时间的变化(s)
注:与各对照组比较,**P<0.05。

表3 各组大鼠旷场实验移动速度的变化(s)
注:与各对照组比较,**P<0.05。
2.3 鱼藤酮致PD模型大鼠SN 区TH(+)细胞数目减少
通过免疫荧光检测技术,我们检测了各组大鼠SN 区TH(+)细胞的数目。如图1所示,与对照组相比,鱼藤酮模型组大鼠造模3周后,大鼠SN 区TH(+)细胞的数目显著性下降(**P <0.01);各对照组大鼠间SN 区TH(+)细胞的数目差异无统计学意义。
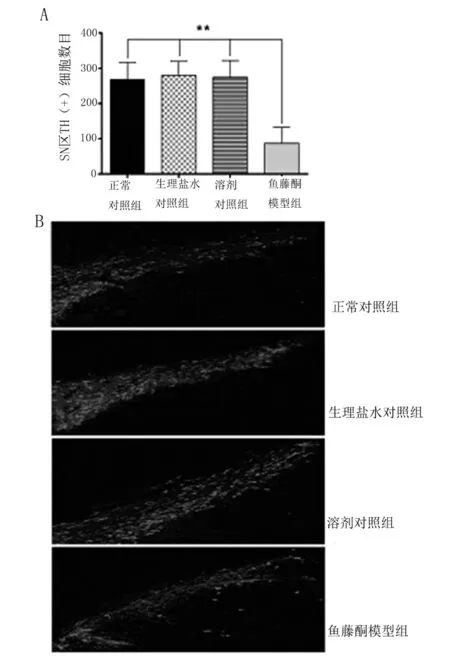
A:各组大鼠SN 区TH(+)细胞数目统计结果的变化(**P<0.01);B:各组大鼠SN 区TH免疫荧光染色。
图1 各组大鼠SN 区TH(+)细胞数目的变化情况
2.4 鱼藤酮致PD模型大鼠SN 区TH蛋白表达水平下降
通过Western-blot检测技术,我们检测了各组大鼠SN 区TH蛋白表达水平的变化。如图2所示,与对照组相比,鱼藤酮模型组大鼠造模3周后,大鼠SN 区TH蛋白表达水平显著性下降(P<0.01);各对照组大鼠间SN 区TH蛋白表达水平差异无统计学意义。
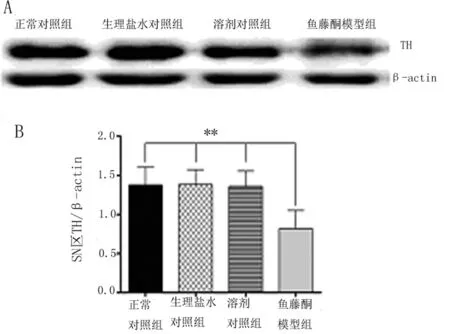
A:各组大鼠SN 区TH蛋白表达水平;B:各组大鼠SN 区TH(+)蛋白表达统计结果的变化(**P<0.01)。
图2 各组大鼠SN 区TH蛋白表达的变化情况
3 讨 论
现今PD的致病因素和发病机制并未研究清楚,包括基因突变、环境因素等多种致病因素均参与其中,因此神经毒性药物模型在PD的相关研究过程中仍具有很广阔的应用范围[7]。上世纪80年代,吸毒者在误将1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine, MPTP)当作杜冷丁类似物吸食后,出现了典型的PD相关症状,因此建立了以MPTP损伤导致的猴和小鼠的PD模型[8]。MPTP在体内被B型单胺氧化酶催化,代谢产生l-甲基-4-苯基-四氢吡啶(1-methyl-4-phenyl-tetrahydropyridine, MPP+),通过MPP+抑制线粒体氧化呼吸链,并聚积在DA能细胞中形成大量NO自由基,致神经细胞死亡,从而导致PD[9]。MPTP制备的灵长类模型在症状及病理、生化方面酷似人类的PD,且稳定可靠,但费用太高、管理不便使其难以广泛应用[10]。鱼藤酮是从毛鱼藤的液汁鱼藤胶中分离出来的一种常用的杀虫剂,具有亲脂性,可透过血脑屏障,抑制胞内线粒体复合物Ⅰ的活性,产生与MPTP相似的作用,使呼吸链电子传递障碍,ATP合成减少,引发脂质过氧化和自由基的产生,通过一系列的继发反应,进而导致细胞死亡[11]。DA能神经元对鱼藤酮尤为敏感,可选择性地直接进入DA能神经元发挥毒性作用,可能与DA能神经元对氧化应激高度敏感有关[12]。
前期Ferrante等报道大鼠持续10 d静脉灌注10~18 mg/(kg·d)鱼藤酮,大鼠出现了明显的运动障碍和僵住症[13];而Betarbet等报道,将微渗泵埋入Lewis大鼠背部皮下,通过下颌角静脉插管连接微泵,以2~3 mg/(kg·d)灌注鱼藤酮,5周后大鼠会出现身体屈曲、运动减少伴强直、震颤[14];Saravanan等报道,采用鱼藤酮立体定向黑质注射也可成功制作PD大鼠模型[15];此外,还有研究应用皮下以及腹腔注射不同剂量鱼藤酮的方法制作PD大鼠模型[16]。大量的实验都证明鱼藤酮致PD动物模型不仅会出现行为学改变,相关神经元内会出现α突触核蛋白(α-synuclein,α-syn)的聚积,甚而出现了LBs,比较好的模拟了PD病理变化的特点[17]。依据Braak提出的PD脑内病理进展分级学说,PD现今已不止被认为是只影响SN区DA能神经元的狭窄区域性病变,而被认为是一种从延髓起始,逐渐向上影响到整个大脑皮层以及全身多个系统的广泛性的病变[18]。鱼藤酮动物模型对研究α-syn在PD发病过程中的作用,以及PD脑内具体病变的顺序都是必不可少的极好的动物模型。
然而以往的造模方法仍存在不少问题,限制了鱼藤酮致PD大鼠模型的广泛应用,比如微泵静脉给药的方式费用较为昂贵,立体定向注射的给药方式操作比较复杂,而经皮下给药的方法模型成功率低,不够稳定可靠,而且以1∶1比例混合的DMSO与PEG为溶剂溶解鱼藤酮,模型死亡率较高。因此,如果能找到一种方便易行的方法来建立鱼藤酮致PD大鼠模型,将会为相关研究提供一种较有价值的动物模型,有助于PD相关研究的开展。
本实验采用雄性Wistar大鼠,使用1∶49的比例预先配制好DMSO和MCT混合物作为溶剂,连续3周通过腹腔注射鱼藤酮。实验中通过体重监测显示,鱼藤酮模型组大鼠在造模2周后,体重较各对照组大鼠明显下降;而第1、2、3周末分别检测大鼠的行为学改变,结果显示,与各对照组大鼠相比,鱼藤酮模型组大鼠方桥存留时间和移动速度在第2周和第3周均明显下降;体重与行为学检测相关变化均与鱼藤酮注射的时程有关。而SN区免疫荧光和Western-blot检测显示,鱼藤酮模型组大鼠较各对照组大鼠,SN区TH(+)神经元数目和TH蛋白表达水平均明显的下降,进一步表明了鱼藤酮模型组大鼠的行为学变化主要是黑质多巴胺能神经元的受损和缺失所引起的。
实验结果显示,通过使用鱼藤酮MCT乳化液,有助于药物的渗透;而中等剂量、中等时间长度的使用鱼藤酮进行造模,大大提高了模型的成功率。本实验中采用的鱼藤酮PD大鼠模型制作方法,可行性强,模型更稳定,且花费较少,操作简便。本研究为开展环境因素与PD的发生关系、PD的发病机制以及PD脑内具体病变顺序的研究,提供了一个适合且更为简便的动物模型,同时为PD相应的预防和神经保护作用的研究提供了新的途径。
