草乌甲素治疗过敏性哮喘小鼠气道炎症的初步探讨
2019-01-14张文琪吕业超唐小牛湛孝东周萍萍姜玉新
张文琪 孙 甜 吕业超 唐小牛 郭 伟 湛孝东 周萍萍 姜玉新
(1.皖南医学院生理学教研室,安徽 芜湖 241002; 2.皖南医学院医学寄生虫学教研室,安徽 芜湖 241002)
过敏性哮喘(哮喘)是以嗜酸性粒细胞(EOS)浸润、并伴有气道高反应性、可逆的气道重塑以及黏液分泌增多为临床特征的慢性气道炎性疾病[1],发病率呈上升趋势。过敏性哮喘发病机理尚不十分清楚,目前认为辅助性T细胞亚群Th1、Th2、Treg和Th17等比例失衡及其分泌的细胞因子紊乱而引起的免疫失调所致[2]。巨噬细胞也参与机体免疫防御过程。研究发现,细胞因子IL-4和IL-13刺激可引起过敏性哮喘小鼠体内的巨噬细胞向肺部募集,从而加速了肺部炎症反应[3]。另有研究显示,过敏性哮喘小鼠体内巨噬细胞数量较低,提示巨噬细胞可能有助于缓解过敏性哮喘症状[4]。目前以糖皮质激素为主的短期治疗和变应原特异性免疫治疗的脱敏疗法为治疗过敏性哮喘的主要手段5]。前者易复发,而后者则治疗周期较长,且脱敏效果欠佳。
草乌甲素(Bulleyaconitine A,BLA)是从乌头碱植物中提取的具有高活性的二酯C19-二萜类生物碱[6]。研究证明,BLA具有抗炎、抗过敏以及免疫调节等作用[7-8]。但其在过敏性哮喘的作用尚不清楚。因此,本研究拟探讨BLA对OVA致敏的过敏性哮喘小鼠模型的抗炎作用及其可能的机理,以期为其治疗过敏性哮喘的潜在作用提供实验基础。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级BALB/c雌鼠60只(18~22 g),购于苏州工业园区爱尔麦特科技有限公司[许可证号:SCXK(苏)2014-0007]。
1.1.2主要试剂 卵白蛋白(OVA)、草乌甲素标准品(BLA)、氢氧化铝[Al(OH)3]购自美国Sigma公司;IgE、IgG、IL-4、TNF-α和MCP-1 ELISA检测试剂盒购自南京建成生物工程有限公司;BCA蛋白定量试剂盒购自碧云天生物技术研究所;兔抗NF-κB1、PKC-δ多克隆抗体购自美国Cell Signaling Technology公司。
1.1.3主要仪器设备 超声雾化仪(型号402AI)为江苏鱼跃医疗设备股份有限公司产品;电子分析天平(型号BS224S)为德国Sartorius公司产品;高速匀浆机(型号T10)为德国IKA公司产品;恒温水浴锅(型号SHKE6000-8CE)为美国Thermo公司产品;超纯水仪(Milli-Q®Direct Water Purification System)为美国Millipore公司产品;多功能酶标仪(Tecan Infinite F200)为瑞士TECAN集团公司产品。
1.2方法
1.2.1过敏性哮喘小鼠模型的制备 将BALB/c雌性小鼠随机分为6组,每组10只,分别为:阴性对照组(NC组)、哮喘组(AS组)、BLA-低剂量组(BLA-L组)、BLA中剂量组(BLA-M组)、BLA高剂量组(BLA-H组)和地塞米松阳性对照组(Dex组)。参照文献[9]的方法制备过敏性哮喘小鼠模型:BALB/c雌性小鼠分别于第0、7及14天腹腔注射0.2 ml含10μg OVA的PBS[含2% Al(OH)3]雾化吸入激发,每天1次,每次30 min,持续雾化1周。雾化吸入前,BLA-L组、BLA-M组和BLA-H组小鼠分别给予剂量为0.16、0.32、0.48的BLA(溶于0.2 ml的PBS)进行腹腔注射;Dex组小鼠则给予剂量1 mg/kg的Dex(溶于0.2 ml的PBS)进行腹腔注射;NC组和AS组则用PBS代替进行雾化激发,且每次雾化吸入前腹腔注射0.2 ml PBS。
1.2.2血清IgE、IgG水平测定 末次激发24 h,每组小鼠取6只用异氟烷麻醉,收集全血于4 ℃静置30 min后,4 ℃3000 r/min离心10 min,取上清用ELISA检测试剂盒测定血清中IgE、IgG含量。操作按试剂盒说明书进行。
1.2.3肺泡灌洗液(BALF)中IL-4、IL-10、TNF-α与MCP-1的测定与细胞分类计数 末次激发24 h,取每组小鼠异氟烷麻醉后,行气管插管,注入总体积为1 ml的PBS(按0.3、0.3、0.4)灌洗3次,回收率在0.75 ml以上为合格。4 ℃3000 r/min离心10 min;上清用ELISA试剂盒检测细胞因子IL-4、TNF-α与MCP-1的水平。细胞沉淀用0.5 ml PBS重悬并调整细胞浓度为1.0×104/ml,并进行细胞涂片,干燥后进行瑞氏染色,光镜下对嗜酸性粒细胞、淋巴细胞与巨噬细胞计数。
1.2.4肺组织病理学检测 分离步骤1.2.2小鼠的肺组织,4%多聚甲醛溶液中固定24 h,常规石蜡包埋、酒精梯度脱水后切片,HE染色后,光学显微镜下观察小鼠肺部病理结构改变。
1.2.5NF-κB1、PKC-δ蛋白表达水平的检测 取新鲜肺组织按1∶20的比例加入细胞裂解液,冰上超声匀浆,4 ℃15000 r/min离心10 min,上清用BCA检测试剂盒测定蛋白浓度后,用12.5%的SDS-PAGE分离胶分离,条件为:恒压110V持续100 min;随后,将分离的蛋白转移至PVDF膜上,转膜条件为:恒流400 mA 120 min。转膜后的PVDF膜用含5%的BSA封闭2 h,分别加入兔抗PKC-δ、NF-κB1和GAPDH一抗(稀释比例1∶2000)4℃孵育过夜,TBS-T洗涤3~5次,加入HRP标记的羊抗兔IgG二抗(稀释比例1∶5000)孵育40 min,ECL试剂盒曝光成像。
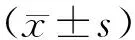
2 结 果
2.1草乌甲素降低血清中IgG、IgE的水平
为了观察草乌甲素对过敏性哮喘小鼠的治疗效果,我们首先检测了小鼠血清中总IgE、总IgG两种抗体水平,结果如图1A,NC组、AS组、BLA-L组、BLA-M组、BLA-H组、Dex组的血清总IgE分别为(15.67± 4.45)、(64.16±5.91)、(44.38±3.56)、(32.48±2.62)、(24.54±2.11)、(25.48±1.30)ng/ml,与哮喘组相比,草乌甲素治疗组、Dex组IgE水平明显降低(P<0.01),其中用药组中剂量最大者效果最为显著。
图1B显示:NC组、AS组、BLA-L组、BLA-M组、BLA-H组、Dex组各组小鼠的血清总IgG含量分别为(12.20±0.67)、(34.38±2.08)、(25.41±1.19)、(18.66±0.78)、(17.70±0.63)、(15.72±0.46)ng/ml。与哮喘组相比,BLA-L组、BLA-M组、BLA-H组的IgG含量显著降低(P<0.01);而Dex组的IgG含量最低。
A:a,与AS组相比,P<0.01;b,与BLA-L组相比,P<0.01;c,与BLA-M相比,P<0.05。B:a,与AS组相比,P<0.01;b,与BLA-L组相比,P<0.01;c,与BLA-M组相比,P<0.01;d,与BLA-H组相比,P<0.05。
图1 草乌甲素对血清总IgE、IgG的影响
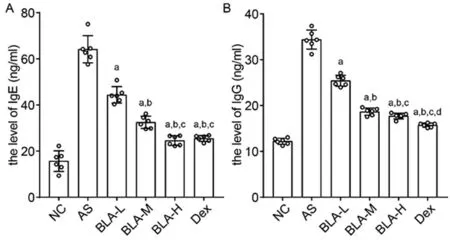
2.2草乌甲素对BALF中IL-4、IL-10、TNF-α与MCP-1的影响
NC组、AS组、BLA-L组、BLA-M组、BLA-H组、Dex组的细胞因子IL-4水平分别为(169.07±2.60)、(339.47±2.52)、(298.82±3.86)、(277.89±7.53)、(277.81±5.98)、(276.67±4.36)pg/ml。与哮喘组相比,草乌甲素处理组灌洗液中IL-4的含量降低(P<0.01);与BLA-L组相比,BLA-M组、BLA-H组与Dex组含量降低(P<0.01);但BLA-M组、BLA-H组与Dex组之间无统计学差异(P>0.05)。见图2A。
NC组、AS组、BLA-L组、BLA-M组、BLA-H组、Dex组的细胞因子TNF-α水平分别为(215.70±13.75)、(454.25〗± 23.16)、(376.24±27.12)、(260.10±17.59)、(245.50±17.92)、(246.27±91.84)pg/ml。与哮喘组相比,草乌甲素处理组灌洗液中TNF-α含量显著降低(P< 0.01);与BLA-L组相比,BLA-M组与BLA-H组含量下降,BLA-M组与BLA-H组、Dex组之间无统计学意义(P>0.05),BLA-H组效果最佳。见图2B。
NC组、AS组、BLA-L组、BLA-M组、BLA-H组、Dex组的细胞因子MCP-1水平分别为(336.15±37.81)、(670.64±52.74)、(630.68±37.66)、(410.39±10.97)、(518.13±25.20)、(360.97±21.66)pg/ml。与哮喘组相比,BLA-L组灌洗液中MCP-1含量下降(P< 0.05),而BLA-M组与BLA-H组含量显著减少(P< 0.01);与BLA-L组相比,BLA-M组与BLA-H组含量下降(P<0.01);与BLA-M组相比,BLA-H组含量增多(P<0.01);与BLA-M组相比,Dex组MCP-1含量减少(P<0.05)。见图2C。
2.3BALF中细胞计数情况
为了进一步了解草乌甲素对肺泡灌洗液中细胞数量的影响,我们对其进行分类计数。结果如图3A: NC组、AS组、BLA-L组、BLA-M组、BLA-H组、Dex组嗜酸性粒细胞数分别为(0.39±0.03)、(5.58±0.22)、(3.05±0.17)、(1.87±0.17)、(1.46±0.16)、(1.29±0.20)×104/ml。草乌甲素处理组的嗜酸性粒细胞数量明显低于哮喘组(P<0.01);与BLA-H组相比,Dex组治疗的效果更佳。
图3B显示:NC组、AS组、BLA-L组、BLA-M组、BLA-H组、Dex组淋巴细胞分别为(0.22±0.03)、(0.47±0.05)、(0.52±0.07)、(0.35±0.04)、(0.30±0.03)、(0.39±0.04)×104/ml,与哮喘组相比,BLA-M组、BLA-H组、Dex组淋巴细胞数量降低(P<0.05),BLA-L组对淋巴细胞的抑制作用不显著。
由图3C可知:NC组、AS组、BLA-L组、BLA-M组、BLA-H组、Dex组巨噬细胞数分别为(0.87±0.45)、(4.85±0.34)、(2.36±0.36)、(1.75±0.20)、(1.13±0.19)、(1.25±0.26)×104/ml,草乌甲素处理组巨噬细胞数显著低于哮喘组(P<0.01)。与BLA-L组相比,BLA-M组、BLA-H组及Dex组淋巴细胞减少(P<0.01)。BLA-H组与Dex组之间差异无统计学意义(P>0.05)。
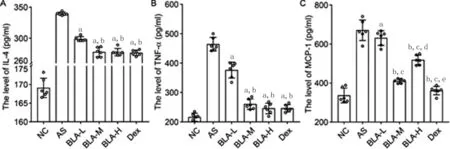
2.4草乌甲素能够减少气道炎性细胞的浸润以及气道粘液分泌
为了分析草乌甲素治疗过敏性哮喘小鼠对肺组织的影响,我们检测了肺组织的病理变化。HE染色结果(图4)显示,NC组小鼠气道周围炎性细胞浸润较少,肺泡上皮细胞与支气管壁结构较完整;而哮喘组小鼠气道炎性细胞浸润较为明显,各剂量的草乌甲素处理组及地塞米松组气道炎症反应均轻于哮喘组,嗜酸性粒细胞浸润显著减少。
A:a,与AS组相比,P<0.01;b,与BLA-L组相比,P<0.01。B:a,与AS组相比,P<0.01;b,与BLA-L组相比,P<0.01。C:a,与AS组相比,P<0.05;b,与AS组相比,P<0.01;c,与BLA-L组相比,P<0.01;d,与BLA-M组相比,P<0.01;e,与BLA-M组相比,P<0.05。
图2 BLA对BLAF中IL-4、TNF-α和MCP-1的影响

A:a,与AS组相比,P<0.01;b,与BLA-L组相比,P<0.01;c,与BLA-M组相比,P<0.01。B:a,与AS组相比,P<0.05;b,与BLA-L组相比,P<0.01。C:a,与AS组相比,P<0.01;b,与BLA-L组相比,P<0.01;c,与BLA-M组相比,P<0.01;d,与BLA-M组相比,P<0.05。
图3 各组小鼠BALF分类计数图
图4 小鼠肺组织病理形态(HE染色,×200)
2.5草乌甲素下调肺组织中NF-κB1、PKC-δ的表达
为了探讨草乌甲素对过敏性哮喘抗炎作用的初步机制,我们分析了草乌甲素对NF-κB信号通路的影响。Western blot结果(图5)显示,在哮喘组中NF-κB1与PKC-δ较正常组表达明显增加,而用草乌甲素处理后发现,NF-κB1与PKC-δ的表达均显著减少。
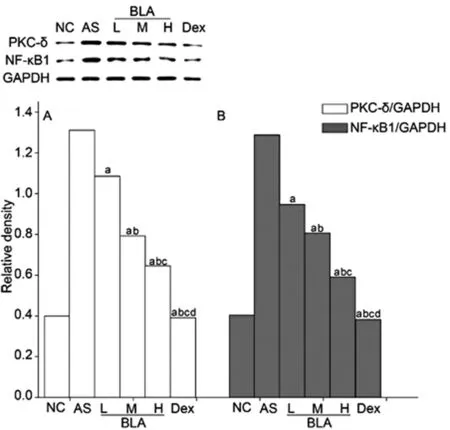
A:a,与AS组相比,P<0.01;b,与BLA-L组相比,P<0.01;c,与BLA-M组相比,P<0.01;d,与BLA-H组相比,P<0.01。
B:a,与AS组相比,P<0.01;b,与BLA-L组相比,P<0.01;c,与BLA-M组相比,P<0.01;d,与BLA-H组相比,P<0.01。
图5 草乌甲素减少NF-κB1与PKC-δ的表达
3 讨 论
过敏性哮喘是一种气道慢性炎症性疾病,特征是气道炎症、IgE分泌增多、EOS数量增加、淋巴细胞浸润以及黏液分泌增多[10-11]。其中,Th1/Th2细胞比例失衡是导致过敏性哮喘的主要原因[12]。此外,巨噬细胞也参与了过敏性哮喘气道炎症的发生[13]。
Bulleyaconitine A(BLA)是一种从乌头属植物中提取的二萜类生物碱。目前,针对BLA的生物学活性主要聚焦于其对疼痛的研究。研究发现,口服BLA可减轻紫杉醇诱导的大鼠脊髓背角C-纤维突触的神经病理性疼痛[14]。最新研究显示,BLA优选阻断L5脊神经结扎大鼠背根神经节神经元中的TTX-S钠通道[15]以及Nav通道[16]从而缓解疼痛。也有研究发现,BLA可直接刺激脊髓小胶质细胞分泌强啡肽而参与抗过敏作用[17]。但其在过敏性哮喘中的抗炎作用尚未见报道。
本研究结果表明,草乌甲素可显著降低血清总IgE和总IgG水平,尤其是高剂量组效果更明显。这说明草乌甲素与抗过敏作用密切相关。肺巨噬细胞通过分泌IL-4、TNF-α与MCP-1等炎性因子诱导炎症反应,在哮喘的发病机制中至关重要,与此同时,与该发病机制密切相关的蛋白已成为研究热点[18-20]。在本课题的研究过程中,我们通过对BALF中的炎性因子IL-4、TNF-α与MCP-1等的检测发现,不同浓度的草乌甲素均可明显下调三者的水平,尤其是中高浓度效果更明显。MCP-1是主要由巨噬细胞分泌的CC趋化因子蛋白家族成员之一,主要参与机体的抗炎作用[21]。研究发现,哮喘患者血清中MCP-1显著高于正常人群[21]。这与我们的结果相一致,即BALF中MCP-1在AS组中的表达显著高于NC组。而草乌甲素处理可显著降低MCP-1的表达,我们推测草乌甲素可能导致巨噬细胞的数量下降引起的。通过检测BALF中的巨噬细胞数量,我们进一步证实草乌甲素可以通过降低巨噬细胞的数量进而抑制MCP-1的表达。此外,草乌甲素的处理也降低了EOS和淋巴细胞数量,而这些细胞数量的下降也有助于缓解过敏性哮喘症状。
为了分析草乌甲素对NF-κB信号通路蛋白的影响,本课题检测了这条通路的关键蛋白NF-κB1与PKC-δ在细胞质中的表达,发现NF-κB1与PKC-δ蛋白在草乌甲素处理组小鼠中的表达低于OVA诱导的过敏性哮喘组小鼠,说明草乌甲素能够通过NF-κB信号通路下调NF-κB1和PKC-δ蛋白在肺组织中的表达。转录因子NF-κB参与了炎症相关基因的表达调控[22],在免疫、炎症、细胞增殖中起着关键作用[23]。在过敏性哮喘发病过程中,刺激因素活化NF-κB信号通路后,可促进气道上皮细胞因子如IL-4、TNF-α增加[24],NF-κB的增加与疾病严重程度密切相关,重症哮喘患者NF-κB的表达明显升高[25]。在OVA诱导的过敏性哮喘小鼠模型,腹腔注射PKC-δ特异性抑制剂,可抑制气道炎症反应和气道高反应[26],说明PKC-δ的活化能够抑制气道炎症和气道重塑的形成[27],这与本研究的结果一致,并且在本研究中得到了进一步验证。
综上所述,本研究通过动物实验证明草乌甲素能够减轻OVA诱导的过敏性哮喘,其机制可能是通过NF-κB信号通路减少PKC-δ/NF-κB1的蛋白表达。作为一种安全性能高的天然化合物有较高的应用价值与前景。
