流产奶牛胎儿肺炎克雷伯氏菌的分离与鉴定
2019-01-14叶勇刚廖党金张明国康润民
叶勇刚,廖党金,张明国,康润民,肖 璐,谢 晶,曹 冶,张 涛
(1.四川省畜牧科学研究院,成都 610066;2.动物遗传育种四川省重点实验室 成都 610066;3.凉山科华奶牛繁育有限公司,西昌615099;4.凉山州畜牧兽医科学研究所,西昌 615042)
肺炎克雷伯氏菌(Klebsiella peneumoniae)属肠杆菌科肠道杆菌属克雷伯氏菌种,是一种人兽共患、革兰氏阴性条件致病菌。该菌在自然界广泛分布,可存在于人、畜禽的呼吸道和消化道,一般情况下不致病,但当动物机体免疫力下降时,可引发支气管炎、肺炎、泌尿系统和创伤感染、败血症、脑膜炎、腹膜炎等[1-4]。近年来肺炎克雷伯氏菌引发的家畜疾病屡见报到,但感染奶牛的报道相对较少,尤其未见引起奶牛流产[5-8]。
2017年4月,四川攀西地区一奶牛(荷斯坦)养殖小区发生1例怀孕7个月奶牛流产,母牛出现子宫内膜炎及疑似瘫痪症状,采用补钙和一般抗生素治疗后,效果不良。本研究从无菌采集的胎儿腹水和心血中分离到1株革兰氏阴性短杆菌,通过微生物分离纯化、生化鉴定、16S rRNA 扩增测序、小鼠致病性试验鉴定该菌株为致病性肺炎克雷伯氏菌,并根据药敏试验的结果,给予母牛治疗,最终母牛得以治愈。
1 材料和方法
1.1 材料
1.1.1 主要试剂 麦康凯琼脂培养基、鲜血琼脂培养基、抗生素药敏纸片和微量生化反应管均购自杭州微生物试剂有限公司;Mueller-hinton agar和Mueller-hinton BROTH购自上海叶舟生物科技有限公司;2×TaqPCR Mastermix和凝胶回收试剂盒购自天根生化科技有限公司;D2000 Plus DNA ladder购自中科瑞泰生物科技有限公司。
1.1.2 病料和试验动物 流产胎儿组织样本来自四川攀西地区某奶牛养殖小区;40 d昆明鼠购置四川成都达硕实验动物有限公司。
1.1.3 引物 16S rRNA通用引物 27F: 5'-AGAGTTTG ATCCTGGCTCAG-3';1492R: 5'-GGTTACCT TGTTACGACTT-3';16S~23S rRNA 通用引物(Jensen等[9]设计)F: 5'-GAAGTCGTAGTAA CAAGG-3';R: 5'-CAAGGCATCCACCGT-3'。引物由成都擎科梓熙生物技术有限公司合成。
1.2 方法
1.2.1 细菌的分离纯化 用接种环无菌采集流产胎儿心血和腹水接种于肉汤培养基中,带回实验室37℃培养,过夜后于超净台无菌涂于血琼脂培平板上分离单菌落,并对分离株纯培养细菌进行革兰氏染色,观察细菌个体形态,然后接种于麦康凯培养基观察其培养特征。
1.2.2 生化试验 将分离纯化的细菌接种于普通营养琼脂中,培养 24 h并按照微量生化管说明书进行生化试验。
1.2.3 16S rRNA和16S~23S rRNA 核苷酸序列鉴定挑取单菌落溶于10 μL ddH2O混成菌液作为DNA模板。反应体系(20 μL):DNA模板(菌液)1 μL,PCR Mstermix 10 μL,dd H2O 7 μL,上下游引物各1 μL(50 ng/μL)。PCR反应条件:94℃ 预变性2 min,94℃变性30 S, 55℃退火30 S,72℃ 延伸1 min,30个循环;72℃ 延伸10 min。扩增产物经10 g/L 琼脂糖凝胶电泳后回收,纯化后送成都擎科梓熙生物技术有限公司测序,将测序结果在 NCBI上进行BLAST 比对鉴定。
1.2.4 药敏试验 采用纸片琼脂扩散方法,对常见的28种抗生素进行药敏试验,结果参照 national committee clinicallaboratory standards(NCCLS)药敏试验标准按敏感、中度敏感和耐药进行判定。
1.2.5 致病性试验 挑取分离纯化的单菌落于Muellerhinton BROTH培养基中35℃摇菌培养过夜,部分用比浊管按1.2×109cfu/mL稀释。将小白鼠分为4个组,每组5只,第1组于腹腔接种培养过夜原菌液0.2 mL;第2组于腹腔接种浓度为1.2×109cfu/mL菌液0.2 mL;第3组为对照组,于腹腔接种MH培养基0.2 mL;第4组为对照组,不接种任何物质。
2 结果
2.1 细菌分离培养在麦康凯培养基和血琼脂平板培养基上均长出1~2 mm的黏液状菌落,经革兰氏染色后,镜检见革兰氏阴性短杆菌,两端钝圆,见图1。
2.2 生化特性该菌能分解葡萄糖和乳糖,分解葡萄糖能产酸产气,能还原硝酸盐,分解尿素,V-P试验呈阳性。该分离菌的生化特征基本与报道的肺炎克雷伯氏菌一致[10],具体见表1。
2.3 16S rRNA和16S~23S rRNA基因鉴定16S rRNA基因扩增结果显示,PCR扩增片段位于1000~2000 bp(见图2A)。BLAST结果显示,分离菌株的16S rRNA基因序列与肺炎克雷伯氏菌 16S rRNA基因序列的同源性为 99%,16S~23S rRNA基因扩增结果显示,该PCR扩增出3个片段(见图2B),测序结果表明该分离株的16S~23S rRNA序列与肺炎克雷伯氏菌的16S~23S rRNA同源性最高。以上结果表明,该分离细菌为肺炎克雷伯氏菌。

图1 肺炎克雷伯氏菌革兰氏染色Fig.1 Gran staining of Klebsiella pneumoniae
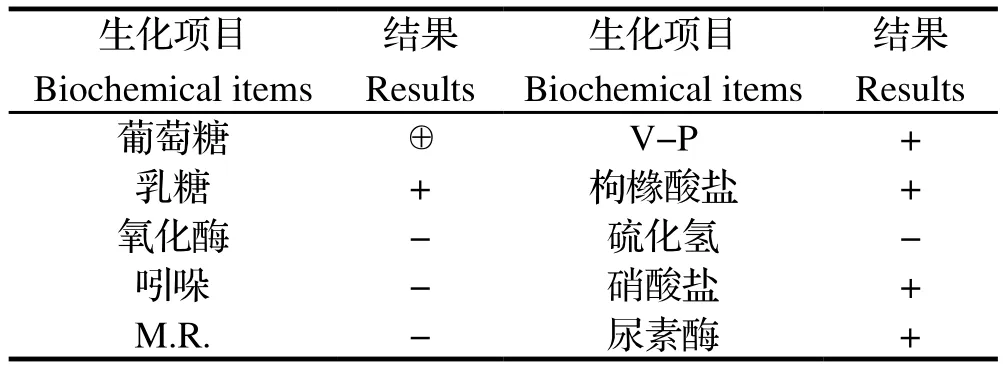
表1 细菌生化鉴定结果Table 1 The results of biochemical test of the bacteria
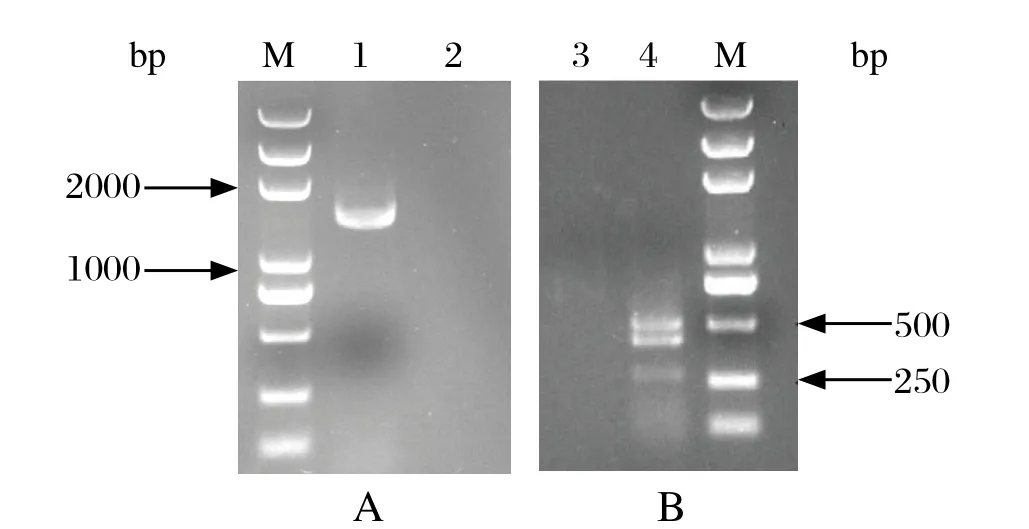
图2 16S rRNA (A)和 16S~23S rRNA(B)基因的PCR扩增Fig.2 The PCR ampli fication of 16S rRNA (A) and 16S~23S rRNA gene(B)
2.4 药敏试验在选用的常见28种抗生素中,该分离菌株对氨苄西林、头孢曲松、头孢唑林、多粘菌素等16种抗生素敏感;对多西环素、四环素、新霉素等7种抗生素中度敏感;对青霉素、苯唑西林、红霉素、米诺环素和氯唑西林耐药,具体见表2。
2.5 动物试验接种0.2 mL原菌液组的小鼠于24 h内全部死亡,接种0.2 mL 1.2×109cfu/mL菌液组小鼠于36 h内全部死亡;而对照未见任何临床症状。解剖小鼠,可见其肺脏、胸腔有明显出血,腹腔有大量积液;取腹腔积液或胸腔积液进行染色镜检,均可见大量革兰氏阴性短杆菌,与犊牛分离病原菌形态一致。
3 讨论
PCR和DNA碱基测序技术用于鉴定细菌种类具有快速、准确的优势,现已经广泛用于对未知菌种进行检测。其中16S rRNA和16S~23S rRNA 编码的基因序列具有高度保守和变异的特性,是用于鉴定细菌的理想靶序列[11,12]。16S rRNA适合于细菌属内种间的鉴定,在分类学中被誉为“金标准”,但由于进化慢,序列相对保守,对相近种或同一种不同型之间进行鉴别存在一定缺陷,如大肠埃希菌与宋内志贺菌、炭疽杆菌与蜡样芽胞杆菌的16S rRNA序列相同,因此无法用此基因片段进行鉴别[13]。而16S~23S rRNA间隔区序列(intergenic spacer region,ISR)除保守外,其进化速度高于16S rRNA的10倍,能对相近菌种和同种内的不同菌株进行鉴别,成为细菌分类和鉴定的热点[14]。本试验采用16S rRNA通用引物,成功扩增了16S rRNA基因片段,通过测序确定了该分离菌株为肺炎克雷伯氏菌。此外,本研究还借鉴了Jesen等[9]设计的经典引物对本株肺炎克雷伯氏菌进行扩增,扩增结果显示在250~500 bp间出现3条带的特异性图谱,测序结果同样证明了该分离菌株为肺炎克雷伯氏菌。
据报道,肺炎克雷伯氏菌可产生各种使抗生素失活的酶,如产生β-内酰胺酶、头孢菌素酶和碳青霉烯酶;此外,肺炎克雷伯氏菌还可通过缺失菌体外模蛋白、改变抗生素作用靶位,以及产生生物膜等机制产生耐药[15]。畜禽生产过程中,抗生素作为促生长的饲料添加药物和临床不合理使用抗生素,使畜禽肺炎克雷伯氏菌产生了严重的耐药性。

表2 药敏试验结果Table 2 The result of drug sensitive test
肺炎克雷伯氏菌引发的疾病越来越常见,现均能从人、牛、羊、猪、皮毛动物等中分离到致病性肺炎克雷伯氏菌。肺炎克雷伯氏菌感染奶牛主要造成奶牛乳房炎、肺炎、子宫内膜炎,也有报道在流产奶牛胎儿中分离到肺炎克雷伯氏菌,但其不是造成奶牛流产的主要病因[16,17]。本试验从流产奶牛胎儿心血和腹腔液中分离到1株细菌,采用16S rRNA基因扩增测序、生化鉴定等方法确定该分离菌株为肺炎克雷伯氏菌,小白鼠感染试验证明其具有很强的致病力;加之没有分离到其他的病原菌,由此判断,可能是孕牛免疫力低下,肺炎克雷伯氏菌乘机在孕牛体内大量繁殖而引起奶牛发病和流产,病原菌经垂直传播给胎儿。另外试验还通过药敏试验,筛选出敏感性药物并对临床生产进行指导用药,取得了较好的治疗效果,进一步证明了该奶牛的流产与肺炎克雷伯氏菌相关。肺炎克雷伯氏菌作为一种人兽共患病原菌,奶牛场应加大对该类疫病的预防,除科学使用抗生素外,还需加强卫生消毒,加强饲养管理,用药前多做相关药敏试验,实施针对性用药,提高防治效果。
