gga-miR-142-5p负调控chMDA5抗传染性法氏囊病病毒感染的分子机制
2019-01-14欧阳伟潘群兴王晶宇王晓丽夏兴霞诸玉梅王永山
欧阳伟,潘群兴,钱 晶,王晶宇,王晓丽,夏兴霞,诸玉梅,王永山
(1. 江苏省农业科学院兽医研究所 农业部兽用生物制品工程技术重点实验室,南京210014;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
传染性法氏囊病(Infectious bursal disease,IBD)是由传染性法氏囊病病毒(infectious bursal disease virus,IBDV)引起的以侵害幼禽法氏囊为主要特征的传染病。该病不仅引起患病动物死亡,而且还导致机体免疫抑制,使机体的免疫防御能力降低和对多种疫苗免疫接种失败。IBDV属双RNA病毒科双RNA病毒属,基因组易变异,且IBDV的生物学性质稳定以及多种禽鸟类可带毒传播,致该病毒难以根除[1]。从IBD疫苗免疫失败的鸡群中分离到的IBDV自然重配超强毒株表现出更强的致病性[2-4]。以上因素的共同作用,使IBD仍是危害养鸡业的主要疫病之一,并呈现出新的流行特点:早期感染、免疫抑制、免疫失败、与其他病原共感染或混合感染、协同致病、临床症状及病变多样化,已成为亟待解决的重大科学与生产实际问题。因此,寻求IBD防治新途径已成为鸡传染病防控中亟待解决的问题。
天然免疫(innate immunity)是激活获得性免疫的重要基础和前提,在机体抵御病毒感染方面具有非常关键的作用。病原微生物感染宿主后,宿主细胞通过自身的模式识别受体(pattern recognition receptor,PRRs)识别病毒的病原相关分子模式(pathogen associated molecular pattern,PAMPs),激活宿主的天然免疫应答,诱导产生I型干扰素、炎性细胞因子和趋化因子等免疫活性介质,同时也诱导树突状细胞的成熟,激活获得性免疫反应[5,6]。
模式识别受体中的RIG-I样受体(RLR)家族包括:RIG-I、MDA5和LGP2,主要分布在细胞质中,其识别的病毒PAMPs包括病毒基因组DNA、单链RNA(ssRNA)、双链RNA(dsRNA)、含5'端三磷酸基团的RNA以及病毒蛋白[7,8]。人源RIG-I和MDA5在进化上保守,其分子结构及在整个信号通路中的地位较为一致,是识别细胞内病毒核酸(包括病毒自身的基因组和病毒复制过程中产生的核酸中间体)、激活干扰素系统的两个关键的PRRs。鸡源细胞缺乏RIG-I,其功能由MDA5补偿[9,10]。鸡细胞PRRs如何识别病毒PAMP启动天然免疫应答其分子机制尚不清楚。
microRNA(miRNA)是一种21~25 nt的小分子RNA,本身不具有开放阅读框(open reading frame,ORF)[11]。细胞内源性miRNA可以作为一种引导性分子通过碱基配对与靶mRNA结合,从而在转录后水平引起靶mRNA的剪切或是翻译的抑制,在多种生理和病理途径中发挥调节作用[12]。miRNAs在天然免疫细胞内有独特的表达谱,miRNA可以有效靶向PRRs介导的天然免疫信号通路上的众多分子,包括PRRs、接头蛋白、激酶、转录因子以及炎性因子等[13,14]。目前,尚缺乏miRNAs对鸡细胞chMDA5介导的抗病毒天然免疫信号转导通路调控研究。
本研究拟在前期工作基础上,分析鉴定IBDV感染对chMDA5表达的影响,以及chMDA5在识别IBDV感染中的作用,并进一步在miRNA水平分析chMDA5的调控机制,探索鸡细胞识别/启动抗病毒天然免疫反应的关键分子,为预防和治疗免疫抑制疾病的新策略提供理论基础和药物靶点。
1 材料与方法
1.1 病毒、细胞和试剂IBDV 弱毒(B87株)鸡B淋巴细胞传代细胞(DT40)适应毒株和DT40细胞为本实验室保存;RNAiso Plus购自TaKaRa公司;5×All-In-One RT MasterMix(with AccuRT Genomic DNA Removal Kit)和EvaGreen 2×qPCR MasterMix购自ABM公司;Lipofectamine 2000转染试剂和Lipofectamine RNAiMAX购自Invitrogen公司;T7 RiboMAX Express RNAi System体外转录试剂盒、双荧光素酶报告载体(pRL-CMV、pGL3-control)以及Dual Luciferase Reporter Gene Assay Kit均购自Promega公司;SuperSignal West Pico化学发光底物购自Thermo公司;pcDNA3.1-Flag+chMDA5真核表达质粒由本实验室保存。
1.2 IBDV感染对chMDA5表达水平的影响在病毒感染前24 h预铺DT40细胞于6孔板,第二天,每孔接种103TCID50的IBDV B87株,在IBDV感染后2 h、4 h、12 h和24 h 4个时间点分别收集细胞培养物,同时设立正常的DT40细胞做对照。用qRT-PCR和Western blot 分别分析chMDA5 的转录和蛋白表达水平。
1.3 chMDA5过表达和抑制表达对IBDV复制的影响运用siRNA在线设计工具(http://rnaidesigner.lifetechnologies.com/rnaiexpress/),针对chMDA5基因保守区分别设计了2个siRNA(在siRNA正义链序列的5'端和反义链的3'端分别加上T7 RNA聚合酶启动子序列,使两者能够成为互补双链),并通过Blast分析确认他们特异性,同时设计siRNA阴性对照siRNACON。DNA寡核苷酸由北京鼎国昌盛生物技术有限责任公司合成。
将合成的单链DNA序列通过退火配对,分别得到正义siRNA转录模板和反义siRNA转录模板。反应体系:正义DNA模板(100 pmol/μL)10 μL,反义DNA模板(100 pmol/μL)10 μL,5×Oligo annealing buffer 20 μL,无Nuclease-Free water 60 μL,95℃ 5 min,室温退火30 min,制备双链DNA模板。siRNA的转录合成按T7 RiboMAX Express RNAi System体外转录试剂盒说明书进行。
将pcDNA3.1-Flag+chMDA5或si-chMDA5转染DT40细胞,转染按Lipofectamine 2000操作说明书进行。24 h后,每孔接种103TCID50的IBDV B87株,感染后24 h,测IBDV滴度。同时设立pcDNA3.1(+)空质粒或siRNACON转染对照。
1.4 chMDA5过表达和抑制表达对IFN-β promoter、Mx promoter活性的影响将pcDNA3.1-Flag+chMDA5、si-chMDA5分别与pGL3-Basic+IFN-β promoter、pRL-CMV或pGL3-Basic+Mx promoter、pRL-CMV共转染DT40细胞,转染按Lipofectamine 2000操作说明书进行,同时设立pcDNA3.1(+)空质粒转染对照。5 h后,更换成2 mL含2%胎牛血清的DMEM。siRNA转染组,转染后24 h弃细胞上清,每孔接种103TCID50的IBDV B87株,感染后24 h,使用双荧光素酶报告系统检测试剂盒检测各孔荧光素酶活性。
1.5 chMDA5过表达和抑制表达对NF-κB和IRF7信号通路的影响将pcDNA3.1-Flag+chMDA5或sichMDA5分别与pGL3-Basic+NF-κB、pRL-CMV或pGL3-Basic+IRF7、pRL-CMV共转染DT40细胞,转染按Lipofectamine 2000操作说明书进行,同时设立pcDNA3.1(+)空质粒转染对照。5 h后,更换成2 mL含2%胎牛血清的DMEM,转染后24 h弃细胞上清。siRNA转染组,转染后24 h弃细胞上清,每孔接种103TCID50的IBDV B87株,感染后24 h,使用双荧光素酶报告系统检测试剂盒检测各孔荧光素酶活性。
1.6 生物信息学预测调控chMDA5的miRNA用生物信息学在线工具miRDB(http://mirdb.org/miRDB/)预测调控chMDA5的miRNA,合成miRNA的模拟物,进行功能分析。
1.7 双荧光素酶报告系统分析gga-miR-142-5p对chMDA5 3'UTR的调控作用将gga-miR-142-5p、pGL3-chMDA5 3'UTR和pRL-CMV共转染DT40细胞,转染按Lipofectamine 2000操作说明书进行,5 h后,更换成2 mL含2%胎牛血清的DMEM,转染后24 h弃细胞上清,使用双荧光素酶报告系统检测试剂盒检测各孔荧光素酶活性。同时设立miRNA control转染对照组。
1.8 gga-miR-142-5p对chMDA5 mRNA转录和蛋白表达的影响将gga-miR-142-5p转染DT40细胞,转染按Lipofectamine 2000操作说明书进行,5 h后,更换成2 mL含2%胎牛血清的DMEM,转染后24 h,用Western blot和定量PCR分别检测chMDA5的蛋白水平和mRNA水平。同时设立miRNA control转染对照组。
1.9 gga-miR-142-5p对IFN-β promoter和Mx promoter活性的影响将gga-miR-142-5p或ggamiR-142-5p inhibitor分别与pGL3-Basic+IFN-β promoter或pGL3-Basic+Mx promoter和pRL-CMV共转染DT40细胞,转染按Lipofectamine 2000操作说明书进行,5 h后,更换成2 mL含2%胎牛血清的DMEM,转染后24 h弃细胞上清,每孔接种103TCID50的IBDV B87株,感染后24 h,使用双荧光素酶报告系统检测试剂盒检测各孔荧光素酶活性。同时设立mimic control或inhibitor control转染对照组。
1.10 gga-miR-142-5p对NF-κB和IRF7信号通路的影响将gga-miR-142-5p或gga-miR-142-5p inhibitor分别与pGL3-Basic+NF-κB或pGL3-Basic+IRF7和pRL-CMV共转染DT40细胞,转染按Lipofectamine2000操作说明书进行,5 h后,更换成2 mL含2%胎牛血清的DMEM,转染后24 h弃细胞上清,每孔接种103TCID50的IBDV B87株,感染后24 h,使用双荧光素酶报告系统检测试剂盒检测各孔荧光素酶活性。同时设立mimic control或inhibitor control转染对照组。
1.11 gga-miR-142-5p对IBDV复制的影响将ggamiR-142-5p或gga-miR-142-5p inhibitor转染DT40细胞,转染按Lipofectamine 2000操作说明书进行,5 h后,更换成2 mL含2%胎牛血清的DMEM,转染后24 h,每孔接种103TCID50的IBDV B87株,感染后24 h,收集细胞上清,测病毒滴度。同时设立mimic control或inhibitor control转染对照组。
2 结果
2.1 IBDV感染对chMDA5表达水平的影响用qRTPCR分析IBDV感染后4个时间点(2 h,4 h,12 h和24 h)细胞培养物中chMDA5 mRNA含量,结果显示,chMDA5 mRNA的表达水平在IBDV感染后的2~24 h内总体呈上升趋势,在感染后的第24 h表达量最高。用Western blot分析IBDV感染后12 h和24 h 2个时间点细胞培养物中chMDA5蛋白含量结果见图1,chMDA5的蛋白水平在IBDV感染后的12 h和24 h均高于正常对照细胞。以上结果表明,IBDV感染可促进chMDA5在DT40细胞中的表达。

图1 qRT-PCR和Western blot分析IBDV感染对chMDA5 表达水平的影响(*P<0.05,**P<0.01)Fig. 1 IBDV infection increased the transcription and protein expression level of chMDA5 in DT40 cells(*P<0.05,**P<0.01)
2.2 chMDA5过表达和抑制表达对IBDV复制的影响将chMDA5在DT40细胞中瞬时过表达,接种IBDV,用TCID50测上清中的病毒滴度,结果见图2。chMDA5过表达组IBDV滴度显著低于对照组,表明chMDA5过表达可抑制IBDV在DT40细胞中的复制,而chMDA5抑制表达组IBDV滴度显著高于对照组。以上结果表明chMDA5具有抗IBDV复制功能。


图2 chMDA5过表达和抑制表达对IBDV复制的影响(*P<0.05 )Fig. 2 Chicken MDA5(chMDA5) can inhibit IBDV replication in DT40 cells(*P<0.05 )
2.3 chMDA5过表达和抑制表达对IFN-β promoter、Mx promoter活性的影响为了分析chMDA5抗IBDV复制的机理,用双荧光素酶报告系统分析chMDA5对IFN-β和抗病毒基因Mx表达的影响,结果见图3。chMDA5过表达可激活IFN-β promoter和Mx promoter活性。用siRNA下调chMDA5表达,感染IBDV,用双荧光素酶报告系统分析发现IFN-β promoter和Mx promoter活性降低。以上结果表明,chMDA5可促进IFN-β和抗病毒基因Mx的表达。


图3 chMDA5过表达和抑制表达对IFN-β promoter、Mx promoter 活性的影响(*P<0.05, **P<0.01)Fig. 3 chMDA5 increased the activity of IFN-β promoter and Mx promoter(*P<0.05,**P<0.01 )
2.4 chMDA5过表达和抑制表达对IRF7和NF-κB信号通路的影响为了分析chMDA5促进IFN-β promoter活性是依赖IRF7还是NF-κB通路,用双荧光素酶报告系统分析chMDA5对IRF7和NF-κB报告质粒荧光素酶活性的影响,结果见图4。结果表明,chMDA5激活IFN-β promoter活性主要通过IRF7通路,而对NF-κB信号通路无影响。

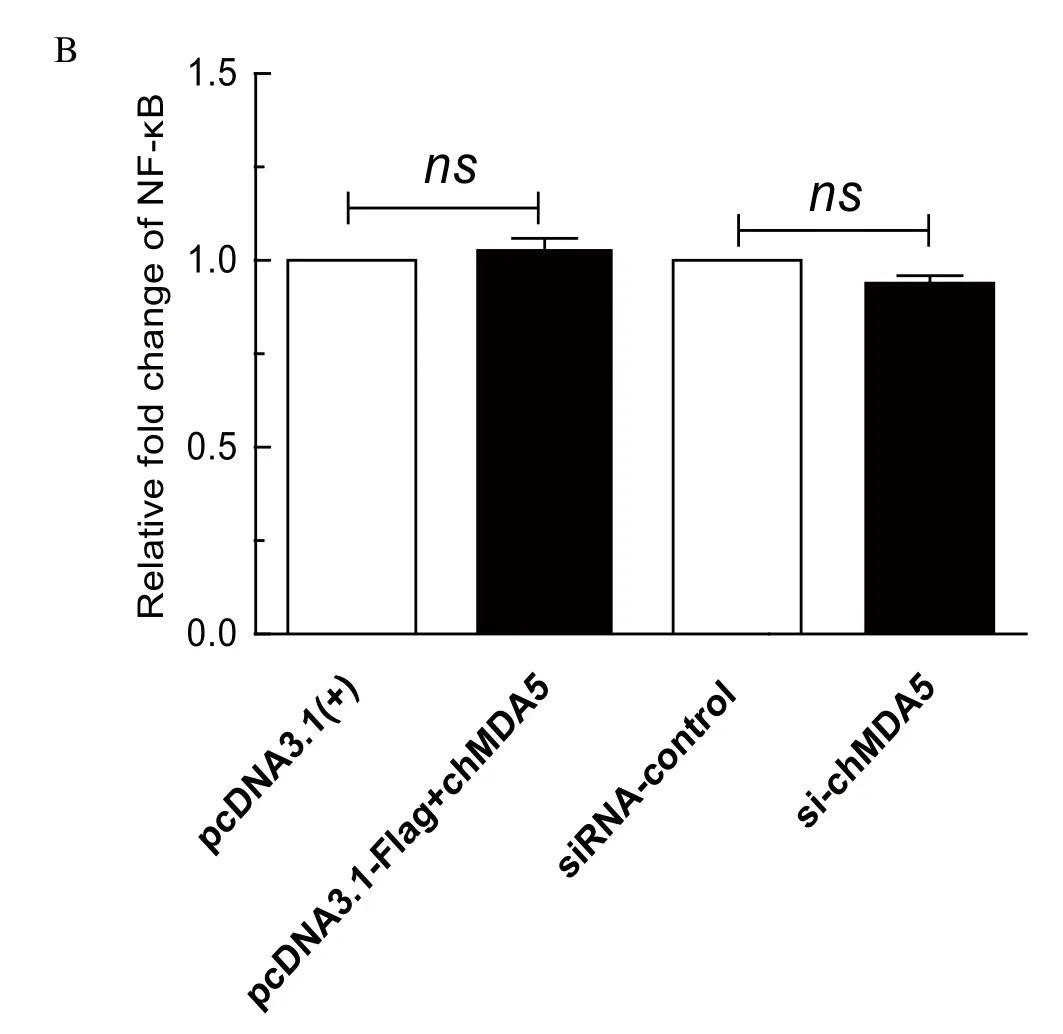
图4 chMDA5过表达和抑制表达对IRF7和NF-κB信号通路的影响(*P<0.05)Fig. 4 chMDA5 activated the activity of IFN-β promoter depending mainly on IRF7 signaling pathway, not on NF-κB signaling pathway(*P<0.05)
2.5 miRNA调控chMDA5(IFIH1)抑制IBDV复制的分子机制用生物信息学预测调控chMDA5(IFIH1)的miRNA,发现gga-miR-142-5p可与chMDA5 3'UTR结合(图5A)。进一步用双荧光素酶报告系统分析gga-miR-142-5p与 chMDA5 3'UTR的相互作用,结果显示gga-miR-142-5p可以作用于chMDA5的3'UTR,使荧光素酶活性显著降低59%。用Western blot 检测gga-miR-142-5p能否调控chMDA5蛋白在DT40细胞中的表达水平,结果显示,gga-miR-142-5p过表达可下调chMDA5蛋白在DT40细胞中的表达(图5B)。用qRT-PCR分析chMDA5 的mRNA水平,gga-miR-142-5p转染组与对照组无显著差异,表明gga-miR-142-5p下调chMDA5蛋白的表达主要是通过转录后抑制chMDA5 mRNA的翻译而不是降解chMDA5 mRNA来实现(图5C和5D)。
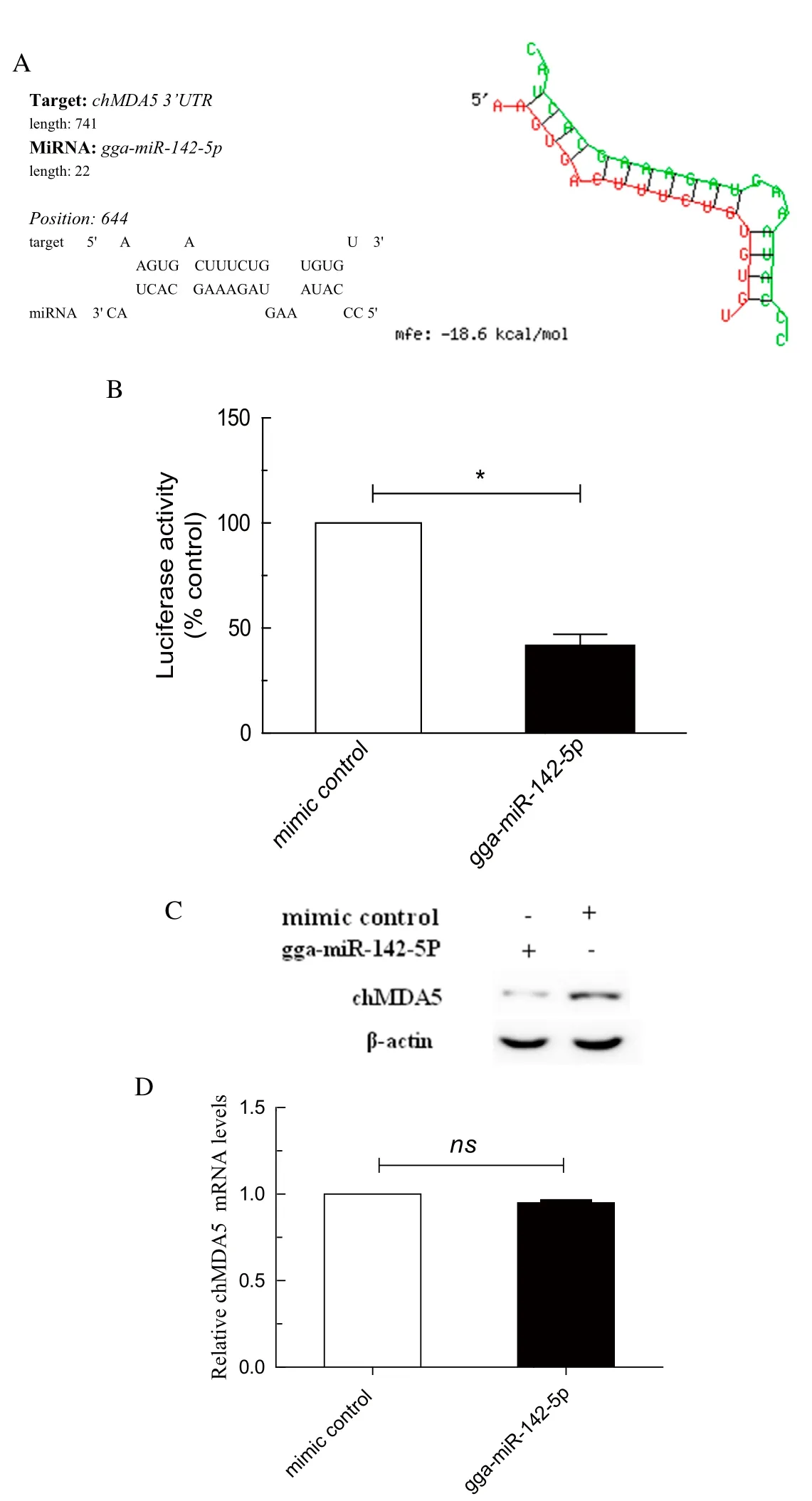
图5 gga-miR-142-5p对chMDA5(IFIH1)的调控作用Fig. 5 gga-miR-142-5p can target chMDA5
2.6 gga-miR-142-5p对IFN-β promoter、Mx promoter活性的影响为了分析gga-miR-142-5p对IFN-β promoter、Mx promoter活性的影响,用双荧光素酶报告系统分析gga-miR-142-5p过表达对IFN-β和抗病毒基因Mx 表达的影响,结果见表6。gga-miR-142-5p过表达可使IFN-β promoter和Mx promoter活性降低;而gga-miR-142-5p抑制表达可使IFN-β promoter和Mx promoter活性增加。

图6 gga-miR-142-5p对IFN-β promoter、Mx promoter活性的影响(*P<0.05)Fig. 6 gga-miR-142-5p inhibited the activity of IFN-β promoter and Mx promoter(*P<0.05)
2.7 gga-miR-142-5p对IRF7和NF-κB信号通路的影响用双荧光素酶报告系统分析gga-miR-142-5p是否能影响IRF7和NF-κB信号通路,结果见图7。gga-miR-142-5p过表达或抑制表达可影响IRF7通路,而对NF-κB信号通路无影响。

图7 gga-miR-142-5p对IRF7和NF-κB信号通路的影响(*P<0.05)Fig.7 gga-miR-142-5p inhibited IRF7 signaling pathway, but had no effect on the NF-κB signaling pathway(*P<0.05)
2.8 gga-miR-142-5p对IBDV复制的影响为了分析gga-miR-142-5p对IBDV复制的影响,将gga-miR-142-5p过表达或抑制表达,用TCID50测上清中的病毒滴度,结果见图8。gga-miR-142-5p可促进IBDV在DT40细胞中的复制。

图8 gga-miR-142-5p对IBDV复制的影响(*P<0.05)Fig. 8 gga-miR-142-5p promoted the replication of IBDV(*P<0.05)
3 讨论
病原微生物感染宿主后,宿主细胞通过自身的模式识别受体识别病毒的病原相关分子模式,激活宿主的天然免疫应答。模式识别受体中的RIG-I样受体在识别RNA病毒的感染中具有重要的作用。鸡源细胞缺乏RIG-I,其功能由MDA5补偿[15]。尽管已有人研究了chMDA5识别AIV感染的机制研究,但这些研究主要集中在这几个模式识别受体之间是相互协同还是拮抗作用,以及下游接头蛋白或病毒蛋白对模式识别受体的影响,但在miRNA水平分析chMDA5识别RNA病毒感染的分子机制并不清楚。
本研究以IBDV为模式病毒,发现在IBDV感染DT40细胞的早期,可以使细胞内的chMDA5表达水平显著升高,说明chMDA5在IBDV的感染中是一个重要的模式识别受体。Karpala等[10]在研究chMDA5对流感病毒复制的影响时发现,流感病毒感染可以使chMDA5表达上调,激活干扰素的表达。本研究在分析chMDA5的功能时也发现,chMDA5可以激活机体的IFN-β promoter和抗病毒基因Mx promoter活性,激活机体的天然免疫。但与Ye等[16]的研究结果不一致,Ye等发现IBDV感染并不能够使chMDA5的表达显著上调。分析我们与Ye等的研究结果发现,可能是因为二者使用的毒株不同,本研究使用的是IBDV B87株,而Ye等使用的是IBDV BN株,众所周知,IBDV毒株易变异,有时一个关键位点氨基酸的变异会导致其生物学性质差异巨大。进一步分析chMDA5对IBDV复制的作用,发现chMDA5过表达可以抑制IBDV的复制,chMDA5抑制表达,IBDV复制则增强;而Karpala等[10]发现,流感病毒感染也可以使chMDA5表达上调,但用RNAi的方法下调chMDA5的表达之后,却并不能影响流感病毒的增殖,其机理尚不清楚。据其推测,虽然chMDA5表达被激活,但因为鸡缺乏RIG-I,这也可能是为什么鸡比鸭更易感染流感病毒。并且鸡也易感染IBDV强毒株致死,而鸭却不会致死,这也是否与鸡缺乏RIG-I有关呢?有待进一步研究。
鸡的chMDA5可激活IFN-β promoter,这与哺乳动物以及鸭的MDA5功能是一致的[16]。此外,鸡和鸭MDA5具有较高的同源性,Wei等[17]研究发现鸭的MDA5激活IFN-β promoter主要是通过IRF7信号通路。Karpala等[10]研究chMDA5的功能发现,其能够调节IFN-β的表达,并且这种调节作用需要IRF3的参与。
既然鸡的chMDA5可激活IFN-β promoter和抗病毒基因Mx promoter活性,那么是什么在调控chMDA5的表达呢?目前对MDA5的调控研究主要在转录水平和蛋白水平,比如,LGP2是chMDA5的阳性调控子[18],IBDV VP3可以阻止chMD5与IBDV的结合,抑制其在抗病毒天然免疫中的活性[16]。但在miRNA水平分析miRNA对chMD5的直接调控作用尚无研究。miRNA是基因表达的调控子,在各种生理和病理过程中发挥着重要的调控作用[11,12,19]。越来越多的研究表明,机体自身编码的miRNA在抗病毒天然免疫中发挥着越来越重要的作用[20]。在RIG-I样受体的研究中,已发现miR-146a是RIG-I样抗病毒天然免疫通路中的一个负调控子[21]。虽然已有研究发现miRNA在RIG-I样抗病毒天然免疫中是一个重要的调控因子,miRNA可以调控TLR和RIG-I样通路中的关键蛋白,但还没有研究发现能直接调控模式识别受体MDA5的miRNA。
本研究用生物信息学分析发现,调控chMDA5的miRNA有多个,用双荧光素酶报告系统分析发现,能直接与chMDA5的3'UTR作用的miRNA有3个(gga-miR-7442-5p、gga-miR-1739和gga-miR-142-5p),但这2个miRNA(gga-miR-7442-5p和gga-miR-1739)的过表达对IBDV的复制没有影响(数据未提供)。只有gga-miR-142-5p不仅可以作用于chMDA5的3'UTR,而且将其过表达之后,能够使IBDV复制显著增加。表明这2个miRNA(ggamiR-7442-5p和gga-miR-1739)在调控chMDA5抗IBDV复制中无作用。进一步通过qRT-PCR和Western blot分析发现,gga-miR-142-5p可以调控chMDA5蛋白的表达,其机理主要是抑制chMDA5的翻译(并不使mRNA降解)来实现。
Tian等[22]用MDV分别感染易感的和不易感的白来航鸡系,用miRNA芯片分析脾脏组织miRNA的差异表达变化,发现gga-miR-142-5p在不易感染MDV系的白来航鸡中,其gga-miR-142-5p的表达水平显著低于易感MDV的白来航鸡。Wang等[23]用AIV感染鸡,然后用深度测序的方法分析肺和气管中的miRNA在AIV感染前后的差异表达变化,发现鸡在感染AIV之后,其gga-miR-142-5p的表达水平也显著下调。从Tian和Wang等的实验中,以及结合本研究的结果,我们可以推断,当MDV、AIV或IBDV感染鸡时,机体可能使gga-miR-142-5p表达下调,从而使chMDA5表达上调来增强机体对病毒的识别,提高机体的天然抗病毒免疫应答。
既然gga-miR-142-5p可以调控chMDA5的表达,那么它应当也可以影响IFN-β promoter和Mx promoter的活性?为了验证这个推断,本研究将gga-miR-142-5p过表达,感染IBDV,发现IFN-β promoter和Mx promoter活性降低,IBDV复制增强。并进一步分析gga-miR-142-5p对IRF7信号通路和NF-κB信号通路的影响,也发现其能够抑制IRF7信号通路,而不抑制NF-κB信号通路。
综上,我们发现IBDV感染可使DT40细胞中chMDA5的表达水平显著升高。chMDA5可激活IFN-β promoter和Mx promoter活性,且chMDA5激活IFN-β promoter活性主要是通过IRF7通路;进一步在miRNA水平分析发现,gga-miR-142-5p可以作用于chMDA5的3'UTR负调控chMDA5的表达从而影响其下游IFN-β promoter和Mx promoter活性来发挥抗IBDV感染的作用。
