鸡传染性支气管炎病毒分离株CK/CH/HD/171018的生物学特性及其全基因组序列分析
2019-01-14李智超王友令徐腾飞栗永华车路平刘盼娆仇旭升孙英杰宋翠萍孟春春王金泉
李智超,王友令,徐腾飞,栗永华,车路平,刘盼娆,仇旭升,孙英杰,谭 磊,廖 瑛,宋翠萍,丁 铲,姚 刚,孟春春,王金泉
(1.新疆农业大学动物医学学院,乌鲁木齐 830052;2.中国农业科学院上海兽医研究所,上海 200241;3.山东省农业科学院家禽研究所,济南 250023)
鸡传染性支气管炎(infectious bronchitis,IB)是临床常见疾病之一,呈世界范围流行,世界动物卫生组织(OIE)将其列为B类传染病。鸡传染性支气管炎是由冠状病毒科、冠状病毒属中的传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起的一种急性、高度接触性传染性呼吸道疾病[1]。IBV基因组为单股不分节段的正链RNA,基因组长约27.6 kb[2],具有5'端帽子结构和3'端poly(A)结构,包含5'Cap-Replicase-S-3a-3b-3c/E-M-5a-5b-N-poly(A)3'至少10个以上开放性阅读框(open reading frame,ORF)[3],可转录出6种亚基因组mRNA(Gene1~6)[4]。IBV的5'和3'端均存在非转录区(untranslated region,UTR)[5]。病毒基因组的5'端为复制酶(Replicase)基因(Gene1)大小约为20 kb,包含了非编码区5'UTR和编码具有活性的聚合酶的ORF1a和ORF1b独特编码区[6],分别编码440 kDa和300 kDa多肽,下游的ORF1b可通过核糖体移码作用与上游的ORF1a形成700 kDa多聚蛋白pp1ab,ORF1a和ORF1b编码了15种非结构蛋白[7],在RNA复制、转录和病毒复制中发挥重要作用。IBV的3'端包含Gene2~6,其中基因2、3、4、6分别编码病毒的纤突蛋白(S)、小膜蛋白(E)、膜蛋白(M)和磷酸化的核衣壳蛋白(N)[8]。Gene3和Gene5是多顺子结构,是分散在编码结构蛋白的ORF之间的辅助基因,Gene3含有分别编码3a、3b和3c/E的3个ORF,Gene5含有分别编码5a和5b的2个ORF[9]。3a、3b、5a及5b均为非结构蛋白,M和E蛋白是形成病毒样颗粒和病毒出芽及装配所需的膜相关蛋白[10]。N蛋白是磷酸化的核蛋白,与病毒RNA合成有关[11]。S蛋白是病毒的主要免疫原蛋白,在体内翻译后由宿主蛋白酶切割为N端的S1和C端的S2,S1亚基附着于病毒包膜,负责病毒包膜和宿主细胞膜的融合[12],S1糖蛋白含有诱导病毒中和、血清型特异性抗体、血凝抑制抗体和交叉反应ELISA抗体的抗原表位[13],并且在病毒组织嗜性和毒力中起重要作用。
当前我国IB呈现常发态势,尤其在IB免疫鸡群中经常爆发IBV强毒感染[14,15],本实验室在河北邯郸某肉鸡场中分离到1株IBV,将其命名为CK/CH/HD/171018,并对其进行了毒力测定和全基因组序列扩增与分析,为日后预防和控制IBV提供理论参考。
1 材料与方法
1.1 毒株、SPF鸡和SPF鸡胚IBV分离株CK/CH/HD/171018分离自河北邯郸某免疫过IB(H120株)疫苗的发病商品肉鸡群。SPF鸡和SPF鸡胚购自北京梅里亚公司。
1.2 菌种、载体及主要试剂Trizol购于Thermo Fisher Scientific,pMD19-T克隆载体购自宝生物工程大连有限公司,DH5α及普通琼脂糖凝胶DNA回收试剂盒购于天根生化科技有限公司,5'-full RACE试剂盒、3'-full RACE试剂购于北京天恩泽基因科技有限公司。
1.3 引物设计及合成根据GenBank发表的所有IBV的全基因组序列,应用DNAStar软件包中的Clustal W方法进行比对,选择保守区域,进行引物设计,引物序列及相关信息见表1,引物送上海生工生物工程技术服务有限公司合成。
1.4 病毒增殖与鉴定取IBV分离株CK/CH/HD/171018通过尿囊腔途径接种10日龄SPF鸡胚,去除24 h之内死亡的胚,收集36 h鸡胚的尿囊液,-80℃保存。盲传3代,进行HA检查阴性和侏儒胚阳性检查,同时取适量病毒按Trizol试剂说明书提取病毒基因组RNA,应用RT-PCR扩增S1基因并进行序列鉴定。

表1 本研究所用引物Table 1 Primers used in this study
1.5 SPF鸡致病性实验取3日龄SPF雏鸡20羽,随机分为2组,每组10羽,分别经滴鼻点眼接种105.0EID50IBV分离株CK/CH/HD/171018株尿囊液及PBS,0.2 mL/羽,分两个隔离器饲养,连续观察14 d,记录接种鸡的精神状况及发病症状,对发病死亡鸡进行剖检并记录气管、肺脏及肾脏等病理变化。
1.6 病毒基因组的扩增
1.6.1 病毒RNA的提取 取适量病毒按Trizol试剂说明书提取病毒基因组RNA。
1.6.2 基因组不同片段RT-PCR扩增 根据引物Tm值,扩增反应热循环参数:针对P1~P9、P11~P16对引物,95℃预变性5 min,94℃变性1 min、55℃退火1 min,72℃延伸2 min,30个循环,72℃延伸10 min;针对P10及P17~P32引物,95℃预变性5 min、94℃变性1 min、52℃退火1 min,72℃ 延伸2 min,30个循环,72℃延伸 10 min。1%琼脂糖凝胶电泳或4℃保存。
1.6.3 5'和3'RACE方法扩增病毒的5'端及3'端序列 按北京天恩泽基因科技有限公司试剂盒说明书进行。PCR反应结束后,取20 μL的PCR产物进行琼脂糖凝胶电泳检查PCR结果,确认后进行DNA测序。
1.7 目的基因克隆按普通琼脂糖凝胶DNA回收试剂盒说明书分别将扩增的目的片段回收纯化,克隆至pMD19-T载体并进行测序。
1.8 序列拼接和基因组全序列的生物信息学分析根据GenBank中参考毒株的基因序列,利用DNAStar.Lasergene.v7.1生物软件中的Cluster W方法,将CK/CH/HD/171018与参考毒株进行比较后各基因片段拼接,并对其全基因组和各个基因片段分别与IBV参考株进行同源性比较。利用MEGA7软件将CK/CH/HD/171018株的全基因组与57个国内外参考毒株的全基因组进行序列比对并构建遗传进化树。应用RDP3软件分析病毒全基因组序列中基因重组情况,运用RDP、GENECONV、BootScan、MaxChi、Chimaera、SiScan、3Seq 7种重组分析方法来确定重组事件,运用Simplot软件进一步确定重组事件及其重组断点。
2 结果
2.1 IBV分离株CK/CH/HD/171018对SPF鸡胚致病性将IBV CK/CH/HD/171018株接种10日龄的SPF鸡胚,传至第3代时可见胎儿发育障碍、胚体头背部局部出血、胚体卷曲、羊膜增厚等典型IBV病变,与其他IBV强毒株对鸡胚的致病性一致。
2.2 IBV分离株CK/CH/HD/171018毒对SPF鸡致病性动物实验结果表明3日龄的SPF鸡感染IBV分离株CK/CH/HD/171018后出现羽毛松乱、精神萎靡及腹泻症状,个别出现呼吸道症状。攻毒组鸡群在第5 d开始出现死亡,死亡一直持续到第14 d,死亡率达到100%(图1A)。病死鸡的剖检结果显示,主要病变发生在肾脏和气管,所有死亡鸡的肾脏都病变明显,表现为肾脏明显肿大,实质苍白,小管和尿道扩张,并有尿酸盐沉积,是呈现典型的“花斑肾”症状,个别病死鸡气管有出血点,其他脏器肉眼可见病变不明显(图1B)。
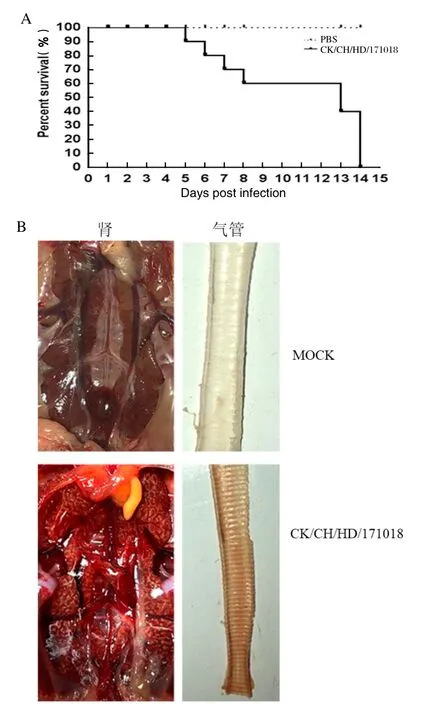
图1 SPF鸡感染IBV分离株CK/CH/HD/171018后死亡情况(A)与肾脏、气管病变(B)Fig.1 Survival rate of chickens (A) and gross lesions in kidney and trachea tissues from chickens experimentally infected with IBV strain CK/CH/HD/171018
2.3 IBV分离株CK/CH/HD/171018全基因组序列测定结果基因组内部分段扩增共获得23个片段,扩增目的条带大小与预期结果基本一致;应用3'和5'RACE试剂盒扩增得到了与预期大小一致的末端片段。将得到的目的片段克隆至pMD19-T载体并进行测序。
2.4 IBV分离株CK/CH/HD/171018全基因组序列测定和拼接将测序获得的各基因片段序列利用DNAStar中Megalign程序对其进行拼接和比对,获得分离株CK/CH/HD/171018的全基因组序列。结果显示,CK/CH/HD/171018基因组的结构为5'Cap-Replicase-S-3a-3b-3c/E-M-5a-5b-N-poly(A)3',与典型的IBV基因组组成特征相同(表2),CK/CH/HD/171018株核苷酸全长为27 688 bp。全基因组序列登录至GenBank中,其登录号为MH020185。
2.5 IBV分离株CK/CH/HD/171018遗传进化分析本研究将IBV分离株CK/CH/HD/171018与57个国内外参考毒株的S基因(图2)进行比较,绘制系统进化树。结果表明,该分离株CK/CH/HD/171018与中国株CK/CH/LJL/140734及CK/CH/LJL/140924的亲缘关系最近,属于QX型IBV。
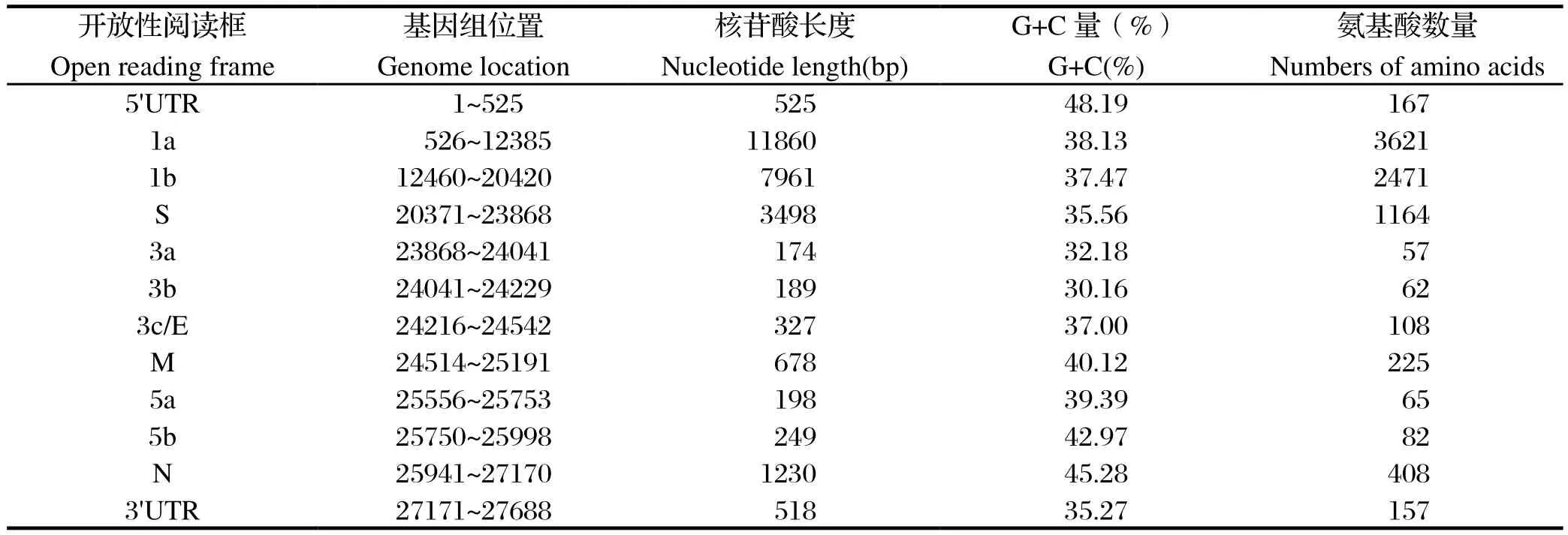
表2 推测分离株CK/CH/HD/171018的ORFTable 2 ORF encoded in CK/CH/HD/171018 genome
2.6 IBV分离株CK/CH/HD/171018的重组分析本研究对IBV分离株CK/CH/HD/171018全基因进行重组来源分析。首先,分离株CK/CH/HD/171018全基因、各个基因片段与参考株同源性对比,结果见表3。分离株CK/CH/HD/171018全基因与QX的同源性最高,其Gene1与CK/CH/LSC/99I型的GX-YL9株及GX-YL5株同源性高达95.5%~97%,基因S、3、M、5、N与QX型同源性较高,这一结果暗示IBV分离株CK/CH/HD/171018在Gene1上可能发生重组事件。故此,我们将CK/CH/HD/171018与参考株全基因进行重组分析。应用RDP3软件分析显示IBV CK/CH/HD/171018株Gene1中检测出2个重组事件。在事件1中,7种检测方法显著性分别达到RDP(5.517×10-47)、GENECONV(1.542×10-29)、BootScan(2.826×10-30)、MaxChi(1.644×10-15)、Chimaera(4.061×10-18)、SiScan(1.669×10-14)及3Seq(2.410×10-30),重组片段位于5661~8223 bp,重组来源minor与major母代毒株分别是GX-YL9与DY07。事件2重组片段位于14 101~18 762 bp,重组来源minor与major母代毒株分别是DY07与GX-YL9,有5种检测方法检测的重组概率P值小于1×10-12。2个重组事件均可以在Simplot软件分析中得到确认(图3)。
3 讨论
本研究分离了IBV变异株CK/CH/HD/171018株,致病性实验结果显示,分离株C K/C H/HD/171018人工感染3日龄SPF鸡后,可引起严重肾脏病变、咳嗽、甩鼻及张口呼吸等临床症状,从d5开始有死亡,死亡率达到100%,表明本研究分离株属于IBV强毒株。
本研究完成了全基因组测序,序列分析发现其与参考株CK/CH/LJL/140924基因组高度同源,同源性高达98.2%~99.6%,CK/CH/LJL/140924是吉林2014年分离株。CK/CH/HD/171018与CK/CH/LJL/140734、CK/CH/LJL/140924吉林分离株等QX基因型IBV高度同源,且全基因进化树分析都处于同一进化分支,因此我们认为CK/CH/HD/171018属于IBV QX基因型。QX型毒株在现阶段已经成为最流行的优势基因型,基因重组事件可能导致QX基因型变异株的出现[16],每年我国许多地区都会发生IBV,且QX型IBV已在我国流行多年,给养禽业造成了巨大损失,然而近年来发现分离的QX型IBV大都存在重组现象[5,16,17],这使得我国QX型IBV的发病情况越来越复杂,也进一步加剧了该病的流行情况。

图2 IBV分离株CK/CH/HD/171018(▲标注)与参考株S基因遗传进化树Fig.2 Phylogenetic tree of S gene of IBV strains (CK/CH/HD/171018 marked with ▲)
IBV容易通过基因突变、插入、缺失和重组等分子机制产生新的变异株[18],其中重组可以发生在野毒株之间,也可以发生在疫苗株和野毒株之间[19],此外还涉及基因突变、插入和缺失等多种变异机制,目前分离的QX基因型野毒株也呈现多样性进化。由于IBV很容易通过基因重组及突变发生变异,导致出现新的变异株。本研究利用RDP3软件及Simplot 软件进行同源性分析确定了所分离到的IBV分离株CK/CH/HD/171018是通过基因重组而出现的变异株,重组现象发生在Gene1处,是QX型DY07野毒株和CK/CH/LSC/99I型GX-YL9野毒株的重组,且引起鸡群产生严重的肾脏病变及高死亡率。已有研究标明,Gene1包含表达两种多蛋白pp1a和pp1ab的复制酶基因,两种多蛋白被两种病毒编码的蛋白酶切割,通常产生16种非结构蛋白(Nsp1~16),IBV缺乏Nsp1,从而编码Nsp2~16,复制酶基因涉及病毒复制和致病性[20,21]。变异株CK/CH/HD/171018的Gene1发生野毒株之间的重组可能是决定了该病毒高致病性的原因,但确切的结论还有待进一步的证实。所以在日后IBV流行病学检测中要对在Gene1发生重组的病毒进行追踪调查其流行情况、变异机制及致病特征。

表3 IBV分离株CK/CH/HD/171018基因组与参考株序列同源性(%)比较Table 3 Pairwise sequence comparison (%) of CK/CH/HD/171018 and reference IBV strains

图3 IBV分离株CK/CH/HD/171018株基因组Simplot重组分析Fig.3 Simplot analyses of the complete genomic sequence of IBV strain CK/CH/HD/171018
本研究测定了IBV分离株CK/CH/HD/171018的全部基因组序列,从分子水平上分析了病毒基因组的分子特性,丰富了IBV的生物信息数据库,为进一步从分子水平研究IBV的流行情况、变异机制及致病特征等奠定了基础。由于QX型IBV强毒株已经成为国内优势基因型,我们必须对其进行持续的流行病学监测,同时尽快评价现有IB疫苗对此类变异株的免疫效力,从而制定更有效的防控策略。
