聪耳通窍剂干预豚鼠庆大霉素耳毒性聋作用的机制探讨
2019-01-14李羴唐俊波韦瑀龙陈壮宣毅陈思仲宣伟军
李羴唐俊波韦瑀龙陈壮宣毅陈思仲宣伟军,2*
1广西中医药大学第一临床医学院耳鼻咽喉头颈外科(南宁530023)
2广西中医药大学瑞康临床医学院耳鼻咽喉头颈外科(南宁530011)
3广西中医药大学瑞康临床医学院制药厂(南宁530011)
4 School of engineering,Tufts university,USA(Medford MA02155)
最近研究表明[1-3],中药复方健耳剂具有显著对抗C57BL/6J小鼠老年性耳蜗毛细胞、螺旋神经节神经元凋亡及保护听力的作用,中药聪耳通窍剂系中药复方健耳剂侧重健脾补肾药的同方同量但不同比例姐妹方,为了解其干预庆大霉素(gentamycin,GM)耳毒性聋影响作用与药效机制,我们以豚鼠GM耳、肾毒性损害作为模型,通过观察耳蜗毛细胞、听性脑干反应(Auditory Brainstem Response,ABR)测听、肾组织切片、血尿素氮(BUN)和肌酐(Cr)浓度、耳蜗超氧化物歧化酶1(Superoxide dismutase-1,SOD1)以及肾组织的细胞凋亡信号调节激 酶 -1(apoptosis signal regulating kinase-1,ASK-1)、硫氧还蛋白(Thioredoxin,Trx)、caspase-3表达等变化情况,了解该中药对GM耳、肾毒性的防护作用,探讨抑制活性氧簇(Reactive oxygen species,ROS)分子作用途径,以及通过护肾,达到护耳的作用机制,同时揭示以中医健脾补肾理论为主指导防聋治聋的科学意义。
1 材料与方法
1.1 动物
选择健康无中耳疾患,耳廓反射灵敏,体重平均300g,2月龄杂色豚鼠60只,雌雄不拘,由昆明市艾尼莫实验动物养殖中心提供,清洁级别一级,通过动物实验伦理审核,动物合格证号:SCXK(滇)K2012-0002。
1.2 药物
聪耳通窍剂主要由黄芪、葛根、骨碎补、女贞子等组成。按照中成药胶囊药物提取技术和方法,经过水煮、浓缩、烘干、反复粉碎和过筛等流程,制成每克药粉相当于6.63克生药材制剂。按照《中药药理研究方法学》(4)实验动物用量换算法得出单倍剂量0.9985g/kg·d,经初步研究对比最终设定该药的豚鼠实验用量为3.994/kg·d。硫酸庆大霉素注射液80mg/支,由贵州天地药业有限公司提供(批号:15062403B)。乌拉坦1000g/瓶,由都莱生物科技有限公司提供(批号:20160701)。戊巴比妥钠0.5g/瓶,由德国Merck提供(批号:20161201)。
1.3 试剂及仪器
琥珀酸钠25g/瓶,由天津科密欧化学试剂有限公司提供(批号:20150110)。氯化硝基四氮唑蓝250mg/瓶,由amresco提供(批号:20151112gl)。尿素氮、肌酐试剂盒购自南京建成生物工程研究所;分光光度计由上海奧析科学仪器有限公司提供(型号:UV-1901PC)。mRNA合成单链扩增逆转录试剂盒购自大连宝生物工程有限公司;荧光定量PCR引物设计在NCBI数据库查找相关序列,由北京六合华大基因科技股份有限公司合成;Gold-View I型核酸染色剂购于上海索莱宝生物科技有限公司;总RNA抽提试剂盒由美国Axygen公司提供;中强度RIPA裂解液(产品号:FD008)、蛋白酶抑制剂混合物(产品号:FD1001)、100 mM PMSF(产品号:FD100)、蛋白磷酸酶抑制剂混合物(产品号:FD1002)、BCA蛋白定量试剂盒(产品号:FD2001)均由弗德生物公司提供;5*蛋白上样缓冲液(产品号:AR1112)由博士德公司提供;Tris-base(产品号:V900483)由Vetec公司提供;甘氨酸(产品号:G800880)、过硫酸铵(产品号:A801035)、N.N-甲叉双丙烯酰胺(产品号:N813086-100g)均由Macklin公司提供;PDVF膜(产品号:IPVH00010)由Millipore公司提供;预染蛋白标志物(产品号:26616)由Fermentas公司提供;SDS(产品号:0227)由Amresco公司提供;一抗Anti-ASK1Antibody(产品号:ab45178)、Anti-TRX antibody(产品号:ab109385)、Anti-Caspase-3 antibody(产品号:ab13847)均由Abcam公司提供;二抗Hrp-Goat Anti-Rabbit IgG(产品号:111-035-003)、HRP-Goat Anti-Mouse IgG(产品号:111-035-003)均由Jackson公司提供。采用美国Bio-Rad实时定量PCR检测系统-MyiQ5 Real Time PCR Detection System;听性脑干反应测试仪采用美国TDT公司的TDT-III型听觉生理检测系统及BioSigRP软件;电磁屏蔽箱由上海电子器械厂提供;多功能酶标仪(型号:DG5033A)由南京华东电子集团医疗装备有限责任公司提供;电泳仪(型号:DYY-7C)由北京六一仪器厂提供。
1.4 动物分组及给药
将60只动物随机分为正常对照组、庆大霉素对照组(GM对照组)、聪耳通窍剂+庆大霉素组(中药+GM组)各20只,其中GM对照组按200mg/kg·d剂量,每天注射2次,两侧大腿及腹腔交替注射,连续9天,第11天终止饲养;GM+中药组预先连续服用聪耳通窍剂10天,然后在继续服用中药同时开始注射GM,GM用量和方法同GM对照组,连续9天同时停药,第11天终止饲养;正常对照组则按常规饲养至11天。中药+GM组每天剂量的1/2用于人工灌服,1/2溶入自吸水瓶中,供豚鼠同时自动饮用,在没有其它水源供应的实验条件下,实验动物因生理需要而必须每天摄取足够的饮水,因而也就保证了实验豚鼠每天都能摄取到规定的药物剂量。
1.5 观察指标及检测方法
每组各取6只动物用于检测ABR,观察听功能变化。第11天期满后每组各取6只动物耳蜗应用Real Time PCR(RT-PCR)技术检测SOD1表达;8只动物取耳蜗应用耳蜗铺片技术,琥珀酸脱氢酶染色方法,观察毛细胞形态学变化;取心脏血应用分光光度计检测BUN、Cr,观察肾功能变化;取右侧肾脏用于肾组织切片,应用HE染色,观察肾组织病理变化,其中每组6只动物左侧肾脏用于westernblot检测肾组织ASK-1、Trx、caspase-3蛋白。
1.6 ABR检测
戊巴比妥钠用无菌生理盐水配成1%浓度,按30mg/Kg对豚鼠进行腹腔注射,深度麻醉后移入测听室内的电磁屏蔽箱进行ABR检测,其中豚鼠颅顶正中皮下插入参考电极,耳廓后缘皮下插入测试电极,接地电极横向安放在鼻尖处,测试电极阻值小于1k欧,ER-10C耳机固定在受测豚鼠的外耳道口,然后进行短声刺激,以21次/秒为重复率,强度范围在10-110dBSPL,叠加1024次,在带通滤波300-3000Hz,共扫描时间10ms,由BioSigRP软件汇总记录数据,计算III波反应阈值。取正常对照组ABR阈值分别与GM对照组、中药+GM组第5、7、9天的ABR阈值进行比较,观察不同时间的听力改变情况。
1.7 耳蜗毛细胞形态学观察
用无菌生理盐水将乌拉坦配成20%,按1.5g/Kg经腹腔注射麻醉,心脏抽吸血液用于肾功能指标检测,然后迅速断头,打开听泡取耳蜗用于耳蜗铺片或RT-PCR检测,同时取肾脏用于肾组织切片。供RT-PCR用动物耳蜗浸泡于RNA保护液中,置-80℃冰箱保存备用。肾脏浸入10%中性福尔马林固定,置4℃冰箱保存备用。豚鼠耳蜗铺片技术采用前期琥珀酸脱氢酶染色成功经验[1],主要方法是将动物蜗尖钻孔并摘除镫骨同时打开园窗,向耳蜗内灌入琥珀酸脱氢酶染色液,由0.2M琥珀酸钠、0.2M磷酸盐缓冲液、0.1%氯化硝基四氮唑蓝配制而成,在37℃恒温箱内作用40分钟到60分钟,然后将耳蜗浸入10%中性福尔马林固定液固定24小时,常规脱钙后分离取出全耳蜗基底膜,移入载玻片上的甘油滴中,盖上盖玻片,中性树胶封固。在标记单位长度为0.01 mm刻度的光学显微镜下,分别放大100、200、400倍镜观察各组实验动物全耳蜗铺片各回基底膜上毛细胞形态变化情况,然后分别截取每组每个样本耳蜗各回同等部位三排外毛细胞,在同等单位距离内计数,其中正常对照组、中药+GM组选择形态正常外毛细胞纳入统计范围,GM对照组凡能够辨认出有形细胞体也纳入统计范围,最后应用SPSS统计软件进行统计分析。
1.8 RT-PCR对耳蜗SOD1mRNA检测
选择PCR参考引物序列ACTB(5'-3'):上游GAAGAGCTATGAGCTGCCTGA;下游GCAGCAAAGTAGTAACAGTCCG;长度(bp)441。PCR目标引物序列SOD1上游5’-AAGCACGGATTCCATGTCCA-3';下 游 5'-TTGCCCAGGTCATCTGGTTT-3';长度(bp)260。
将耳蜗移至预冷的研钵中,研磨成粉末。按照总RNA小量制备试剂盒步骤提取总RNA。按照反转录反应试剂盒说明进行反转录PCR反应合成cDNA。加入引物,在实时定量PCR仪检测系统中,反应条件为95℃预变性10min,然后经过95℃15s,60℃1min,共40个循环,60℃延伸1min,测出内参基因ACTB和目的基因SOD1在不同样本中扩增的Ct值,2-△△Ct法计算基因表达量差异倍数值。
1.9 分光光度计检测BUN、Cr
血液离心,取上清液作为样品。按照试剂盒说明书操作方法,配置标准加样,分别做成标准管、标准空白管、测定管,其中BUN检测条件,各管37h水浴10分钟,640nm波长测定各管吸光度值。Cr检测条件,各管37℃孵育5分钟,546nm波长测定A1、A2各管吸光度值。最后按照公式计算出尿素氮、Cr终值,即:

1.10 肾组织切片染色
肾脏经10%中性福尔马林固定后,常规梯度乙醇脱水、二甲苯透明、石蜡包埋。取5µm切片,二甲苯脱蜡,梯度乙醇水化,苏木素染色,盐酸乙醇分色,最后伊红染色。光学显微镜分别在100、200、400等放大倍数下观察肾小球、肾小管及细胞等病理改变情况并作对比。
1.11 Western blot检测肾组织 ASK-1、Trx、caspase-3蛋白
取每组6个动物肾组织同部位等量小块,加入含有蛋白酶抑制剂的RIPA裂解液冰上彻底匀浆,匀浆液转移至离心管,振荡,冰浴30min,移液器反复吹打,致细胞完全裂解,离心,收集上清,即为总蛋白溶液。根据BCA蛋白定量试剂盒说明操作,按标准曲线计算出样品蛋白浓度,加入适当体积的蛋白上样缓冲液进行沸水浴,分灌分离胶、浓缩胶,加电泳液,上样电泳(浓缩胶75V,分离胶120V),经甲醇活化的PVDF膜转膜(200mA,1h),室温下脱色摇床上用0.5%TBST配制的5%的脱脂牛奶封闭1h,加入TBST溶解的5%脱脂牛奶(或TBST溶解的5%BSA)稀释一抗,4℃过夜,在室温下脱色摇床上TBST复洗,加入稀释二抗,室温下孵育30min后,在室温下脱色摇床上TBST复洗。常规化学发光显色法进行染色和显色,最后显影和定影,拍照,将胶片进行扫描存档,Image J软件处理系统计算和分析目标带的灰度值。
1.12 统计学方法
应用SPSS16.0软件进行统计分析。计量资料以xi s表示,两两比较用LSD-t检验法。P<0.05为差异有统计学意义。
2 结果
ABR检测结果显示(表1),第5天,GM对照组与正常对照组比较,ABR阈值差异具有显著意义(P<0.05),与中药+GM组比较尚无显著性差异(P>0.05),而中药+GM组与正常对照组比较,则差异无显著意义(P>0.05)。第7天,GM对照组ABR阈值继续增高,与中药+GM组比较开始出现显著性差异(P<0.05),第9天平均阈值已超过90dBSPL,听力几乎丧失,与其它两组比较,短期差异继续扩大(P<0.01)。第9天中药+GM组与前期听力比较仍保持无显著性差异(P>0.05),但与正常对照组比较开始出现差异具有显著性意义(P<0.05)。
各组动物第11天全耳蜗铺片结果显示(图1),正常对照组各回三排外毛细胞以及内毛细胞形态正常,数量完整,排列有序,清晰可辨(图1.A1-A3)。GM对照组三排外毛细胞损毁严重,绝大部分细胞出现严重崩解不全,或凋亡缩小,但内毛细胞仍基本存在,清晰可辨(图1.B1-B3)。中药+GM组三排外毛细胞正常数量虽然不如正常对照组多,但除少量而且散在崩解不全外,大多仍存留可辨,形态如常,内毛细胞仍保持完整,清晰可辨(图3.C1-C3)。各组各回三排外毛细胞统计如表2所示,其中GM对照组第1回与第3回比较差异显著(P<0.01),与正常对照组、中药+GM组对应第1、2、3回之间比较,差别均有显著性意义(P<0.01)。中药+GM组各回与正常对照组比较,差别也有显著性意义(P<0.01)。
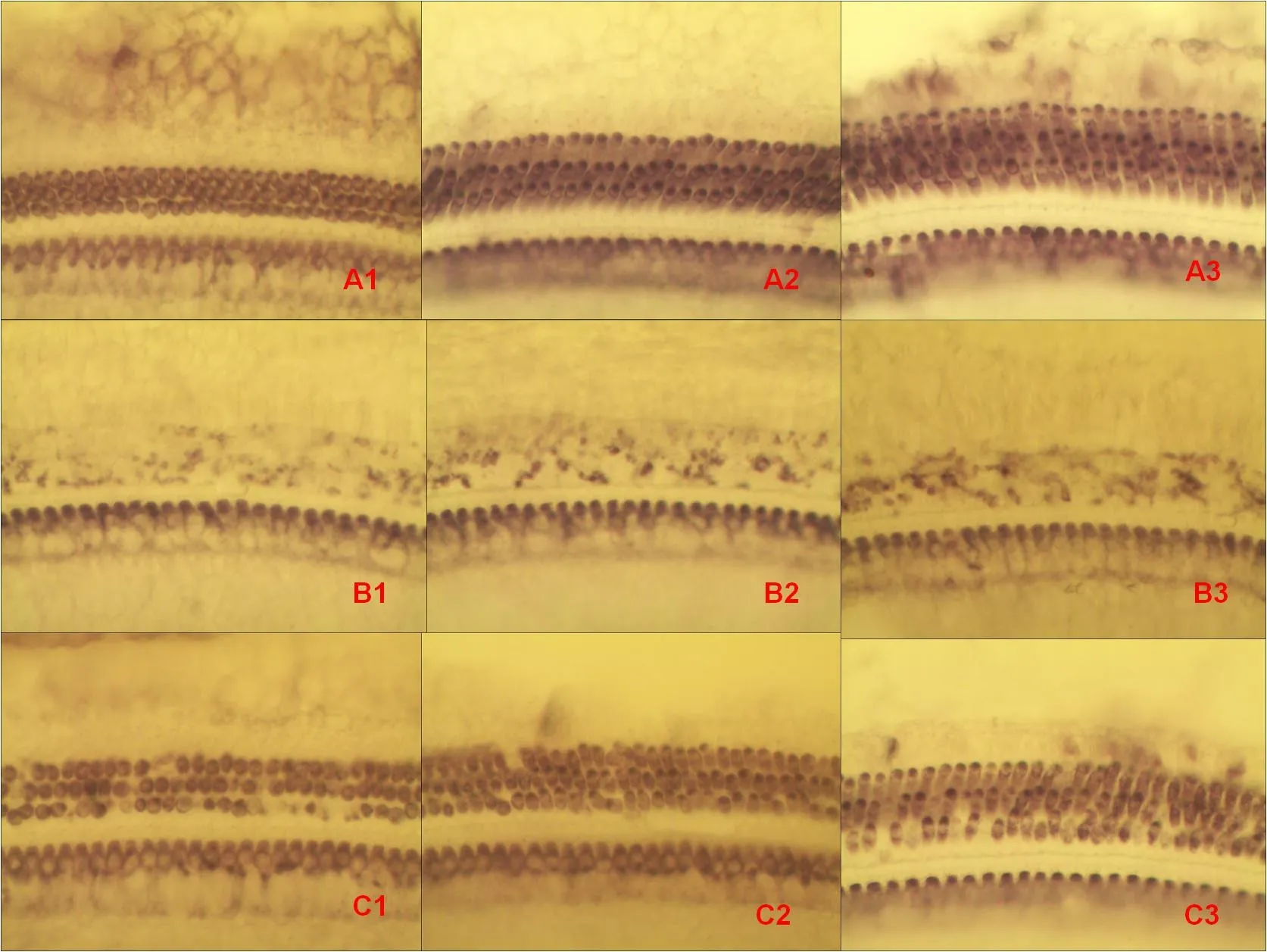
图1 耳蜗基底膜铺片:A为正常对照组;B为GM对照组;C为中药+GM组(注:1、2、3分别表示所在耳蜗第1、2、3回位置。琥珀酸脱氢酶染色。放大倍数:10X40)Fig.1 Stretched preparations of cochlear basement membrane:A as the normal control group,B as the GM control group,C as the CH+GM group(Note:1,2,3 respectively indicate to be located in the first turn,second turn and third turn in cochlea.Succinate dehydrogenase stain.Magnification:10X40)

表1 三组动物ABR阈值比较(dBSPL,xi SD)Table 1 Comparison ofABR thresholds in three groups of animals(dBSPL,x±SD)
各组动物耳蜗组织SOD1mRNA、血清BUN和Cr检测结果显示(表3),中药+GM组无论耳蜗组织SOD1mRNA,或与正常对照组或GM对照组比较差异均具有显著性或非常显著性意义(P<0.01,P<0.05),即明显高于其它两组,而其血清BUN和Cr与GM对照组比较也具有非常显著性差异(P<0.01),即明显低于GM对照组,但其Cr与正常对照组比较,两组差异具显著性意义(P<0.05)。GM对照组血清BUN和Cr与正常对照组比较,差异均具有非常显著性意义(P<0.01),即明显高于正常对照组。
肾脏切片染色结果显示(图2),正常对照组肾皮质、髓质无改变,肾小管结构正常,肾小球毛细血管网略充血,余无异常(图A1-2)。GM对照组呈肾皮质增厚,肾小球弥漫性增大,毛细血管网充血,肾小球内细胞数目明显增多,提示增生改变,部分球囊腔闭锁,或肾球囊及毛细血管间质内可见纤维素及白细胞样渗出物,近曲小管上皮细胞明显浊肿(图B1-2)。中药+GM组肾皮质、髓质无明显改变,仅极少数肾小球有所偏大,或轻度充血,其内细胞数目稍增多,部分肾小管上皮细胞轻度浊肿,余也未见明显改变(如图C1-2)。
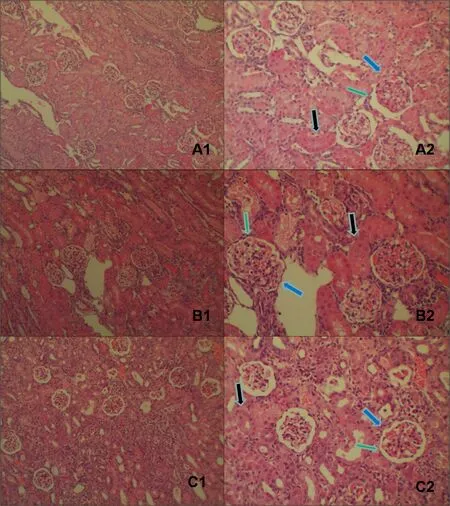
图2 肾组织切片:A为正常对照组;B为GM对照组;C为中药+GM组(注:1、2分别为放大倍数10x20,10x40。蓝色箭头示肾小球;绿色箭头示肾小球囊腔;黑色箭头示肾小管。HE染色)Fig.2 Slices of nephridial tissue:A as normal control group;B as GM control group;C as CH+GM group(Note:1,2 respectively indicate magnification of 10 X 20,10 X 40).The blue arrow indicates the glomerulus;the green arrow indicates the glomerular sac;and the black arrow indicates the renal tubule.HE stain)
Western blot检测各组动物肾组织ASK-1、Trx、caspase-3蛋白统计结果显示(表4),GM对照组与正常对照组比较,其中ASK-1、caspase-3高于正常对照组和中药+GM组,Trx则低于正常对照组和中药+GM组,它们的差异均具有显著性意义(P<0.05)。而中药+GM组与正常对照组比较,除对Trx、ASK-1的表达两者差别无显著性意义外(P>0.05),对caspase-3表达则高于正常对照组(P<0.05)。
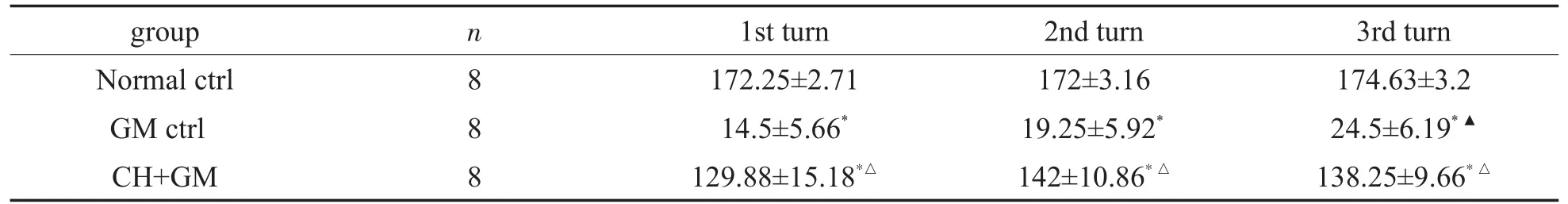
表2 三组动物耳蜗各回三排外毛细胞统计比较(个/0.05mm,xi SD)Statisticalcomparisonofthreerowsofouterhaircellsfromcochleareachturninthreegroupsofanimal(sNumber/0.05mm,x±SD)
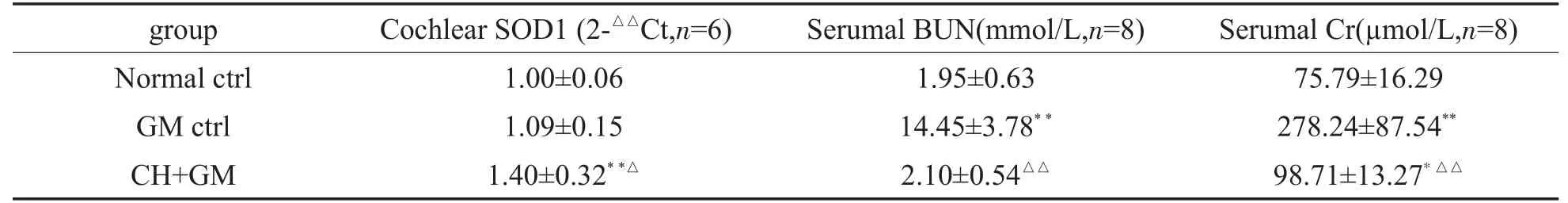
表3 三组动物SOD1mRNA、BUN、Cr含量统计比较(xi SD)Table 3 Statistical comparison of SOD1 mRNA,BUN and Cr contents in three groups of animals(x±SD)
3 讨论
传统中医理论认为,耳属清窍,脾主升清降浊,清阳出上窍,“脾为孤脏,…其不及则令九窍不通”(《素问·玉机真藏论》),而“阳明为诸脉之海,故胃中空则宗脉虚,宗脉虚则阳气不升而下流,下流则上竭,轻则为鸣,重则为聋矣”(《类经·十八卷·疾病类·口问十二邪之刺》);“肾主耳,在窍为耳”(《素问·阴阳应象大论》),“肾气通于耳,肾和则能闻五音矣”(《灵枢·脉度篇》),肾主藏精,“精脱者耳聋”(《灵枢·决气篇》)。故耳的生理功能有赖于脾、肾正常功能的维系,若脾、肾不足则易致耳窍失聪,耳与脾、肾生理和病理关系密切。古代中医文献记载的以健脾为主的“益气聪明汤”(《证治准绳》),以补肾为主的“耳聋左慈丸”(《重订广温热论》)即是治疗耳聋耳鸣的脾、肾理论代表方剂。聪耳通窍剂方组以黄芪、葛根、骨碎补、女贞子为主,则是取黄芪等健脾益气,葛根等升清降浊,骨碎补、女贞子等补肾益精,互相配伍,相得益彰,寓脾肾兼施为主之意。现代药理研究表明,黄芪具有广泛的药理影响作用,其中可提高红细胞膜Na+,K+-ATP酶活性,可使红细胞超氧化物歧化酶(SOD)活性显著升高,促进抗氧化作用,延长组织细胞寿命,促进核酸蛋白质代谢;提高血清cAMP含量,抑制血小板功能,扩张外周血管,改善微循环,强心和抗心肌缺血,提高组织细胞耐缺氧能力。对肾衰大鼠,黄芪可改善肾组织病理变化,明显降低血清BUN、Cr等。葛根具有显著改善脑微循环障碍、抗氧化与清除自由基、抗缺氧、抗凝血和解痉等广泛药理作用。骨碎补则能提高组织中酸性磷酸酶活性,促进蛋白多糖合成;改善软骨红细胞的功能,推迟细胞推迟性变,尤其是对卡那霉素、链霉素所致耳毒副反应也有一定的预防作用。女贞子同样具有明显提高机体SOD活性,增强清除自由基;调节机体免疫功能;抗应激,提高组织细胞缺氧耐受力[5]。
GM属于临床广为使用的第一线氨基甙类抗生素(aminoglycoside antibiotics,AmAn),众所周知,无论GM或其它AmAn,若误用或滥用,由此产生耳毒性和肾毒性副作用也随之增加。本次研究显示,GM对照组听力伴随着GM日益累积而不断下降,至第9天ABR平均阈值已超过90dBSPL,说明听力几乎丧失,与正常对照组和中药+GM组比较,差别显著,并且不断扩大,说明短期内听力急剧下降,听力破坏严重,而中药+GM组前后ABR阈值则无统计学差别,说明听力保护较好。第11天毛细胞形态学显示,GM对照组耳蜗各回外毛细胞成片状毁损严重,这与GM流经单位面积同等浓度相关,而内毛细胞基本不受影响,说明GM主要选择性破坏外毛细胞。外毛细胞损害底回较顶回明显,可能与GM流经耳蜗途径先后和储蓄不同有关。同时,肾小管和肾小球也受到严重损害,血清BUN、Cr浓度明显增加,与正常对照组比较,差别显著,表明肾组织病理改变明显,肾功能明显障碍。中药+GM组无论耳蜗外毛细胞和听力,还是肾组织和肾功能则损害较轻,与GM对照组比较差别显著,其外毛细胞损害呈散在性,可能与中药对抗药理作用不均有关,但与正常对照组比较,第9天ABR阈值与第11天耳蜗外毛细胞计数统计两者结论相符,也有显著性差别。由此表明,以健脾补肾为主的该中药制剂具有较好保护GM耳、肾毒性作用,但未能达到完全保护效果。其护耳与护肾关键作用机制与其抑制氧化应激反应,干预ROS介导的细胞死亡径路有关,而通过护肾,促进GM排泄,是其间接护耳的重要机制。
通过护肾,促进GM排泄途径,间接保护耳蜗。AmAn体内代谢动力学,几乎是从肾脏排除到体外,对肾脏可构成直接损害,可导致急性肾衰竭,而耳神经毒性又是其主要并发症,因此临床应用时认为监测患者的肾功能状况很重要[6],换言之,肾功能不全或衰竭势必影响GM的正常排泄,加剧耳蜗GM储蓄,进而加重耳蜗外毛细胞的破坏。有临床资料报道[7,8],肾病患者,由于肾功能不全或衰竭,应用AmAn导致耳毒性损害的危险性和发病率明显增加。有学者应用血清肌酐、脑干电位和耳蜗铺片研究卡那霉素肾毒性与耳毒性的关系时,发现用药期间,在出现耳毒作用之前首先出现肾毒作用,听功能的改变出现较迟,因此认为肾功能的变化是耳中毒的先兆,提出应用卡那霉素过程中,监测肾功能的改变,在发现肾功能损害时及早停用抗生素,可以防止或减轻中毒性耳聋的发生的观点[9]。本次研究表明,GM对照组肾组织受损严重,肾功能障碍指标血清BUN和Cr的含量明显增加,而聪耳通窍剂能够显著降低豚鼠GM肾毒性损害模型的血清BUN和Cr的含量,防护肾小管和肾小球等肾组织的病理改变,提示该中药具有较好的保护肾组织和肾功能的作用,其护肾作用将有利于保障GM从肾脏排泄,减轻耳蜗GM储蓄,进而缓解GM耳毒性损害。有关护肾机制,近来有报道证实[10],通过GM导致大鼠肾毒性损害研究表明,与正常对照组比较,GM可显著升高血清BUN和Cr、肾组织ROS和MDA水平,减少肾谷胱甘肽酶(GSH)、超氧化物歧化酶(SOD)活性,而口服抗氧化剂水飞蓟素和褪黑激素后,前述指标结果则与GM对照组相反,说明GM肾毒性损害机制与ROS产生,触发系列细胞凋亡密切相关,利用某些抗氧化剂可起到有效保护肾脏作用。本次研究表明,中药+GM组耳蜗SOD1表达明显高于正常对照组和GM对照组,先前研究显示[2,3],聪耳通窍剂同组合不同侧重的姐妹方复方健耳剂具有显著降低耳蜗氧自由基产物丙二醛(MDA)含量与下调Caspase-3表达的药效作用,本次针对肾组织研究还表明,中药+GM组肾组织Caspase-3表达明显低于GM对照组,提示该复方中药通过降低GM导致的机体细胞ROS产生,从而有效对抗Caspase介导的细胞凋亡的发展进程,因此认为这是聪耳通窍剂护肾药效关键分子作用机制之一。

表4 三组动物肾组织western blot测定蛋白结果统计比较(灰度值,xi SD)Table 4 Statistical comparison of renal tissues proteinic.Results measured by western blot in three groups of animals(gray value,x±SD)
通过SOD-ROS径路,清除自由基,直接保护耳蜗。AmAn耳毒性机理复杂,其中氧化应急反应、自由基损伤学说则被认为是其重要原因[11,12]。AmAn通过诱导活性氧簇(Reactive oxygen species,ROS),破坏细菌细胞内线粒体DNA结构,则是其间接抑制细菌蛋白质合成或直接杀菌的重要机制之一[13,14],但超细胞水平的过量ROS将导致机体蛋白质、核酸、脂质、膜和细胞器广泛损坏,或激活细胞死亡通路,导致细胞凋亡[15]。因此,AmAn所诱导产生的ROS既是其杀菌的有利机制方面,同时又成为可以损害细胞的不利机制因素。研究表明[12,16],AmAn耳毒性毛细胞损害是属于由ROS介导Caspase通路,或激活c-Jun氨基末端激酶(JNK)和p38丝裂原活化蛋白激酶(MAPK)通路,启动细胞死亡级联程序,从而诱导的细胞凋亡。AmAn所产生和累积的ROS构成了对宿主耳蜗毛细胞内线粒体DNA的直接损害,引起伴随着耳蜗毛细胞和神经元的退化的永久性双侧重度高频感音神经性听力损失和临时性前庭功能低下,形成铁-氨基甙类复合物,或线粒体钙转运代谢异常则被认为是促使ROS介导的耳蜗内细胞损害病理过程的重要环节[17,18]。新近报道[19],在大鼠耳蜗柯替氏器体外培养MG损害毛细胞模型中,加入一种产自日本的强抗氧化剂药物Hangesha-shin-to(TJ-014),通过毛细胞计数,免疫组化法检测TJ-014对Caspase-3、8-羟基-2'-脱氧鸟苷(8OHDG)的影响等方法,发现其具有保护耳蜗毛细胞的作用,并证实其作用机制与其阻止ROS触发Caspase介导的细胞凋亡,保护线粒体膜有关。之前也有类似文献报道[20],利用一种由松果体分泌的、被认为具有强大直接和间接抗氧化剂特性的褪黑激素,在MG导致大鼠耳蜗椭圆囊毛细胞损害模型实验中,发现其作为抗氧化剂同样具有保护耳蜗毛细胞作用,并通过荧光探针法评估ROS、检测Caspase-3,研究结果表明褪黑激素通过抑制ROS产生和Caspase-3活性达到对抗GM诱导的大鼠毛细胞损失的作用。因此,应用抗氧化剂防治AmAn耳毒性已成为研究热点之一。结合本次研究与既往研究[2,3],聪耳通窍剂具有显著提高耳蜗SOD1表达,其来源方复方健耳剂具有显著降低耳蜗MDA含量与下调Caspase-3表达的药效作用,提示该中药制剂可能作为一种抗氧化剂,通过促进机体抗氧化酶活性,清除ROS,从而阻止ROS触发的系列介导细胞凋亡途径,最终减轻耳蜗细胞的损害,保护听功能的作用。
通过Trx-ROS径路,减轻氧化应激损伤,直接保护耳蜗和肾脏。硫氧还蛋白(Thioredoxin,Trx)与硫氧还蛋白还原酶(thioredoxin reductase,TrxR)和烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate ,NADPH)一起共同组成Trx系统,即TrxR在NADPH催化下,促使氧化型Trx变为还原型Trx,还原型Trx为核糖核苷酸还原酶、蛋白蛋氨酸硫氧还酶、Trx依赖性过氧化物酶、酪氨酸磷酸酶提供氢电子,将H2O2还原成H2O,进而发挥重要的抗氧化作用[21,22]。因此,他是清除ROS,维持细胞氧化还原平衡,减轻氧化应激反应的体内重要氧化还原系统。此外,Trx还可通过Cys-32、35的巯基与凋亡信号调节激酶1(ASK-1)的N-末端的管理域结合,抑制ASK1活性,从而阻止ASK1依赖的细胞凋亡[23,24]。近期应用RT-PCR进行的聪耳通窍剂来源方复方健耳剂干预豚鼠GM耳毒性研究显示[25],该中药能够促进耳蜗Trx-1、Trx-2高表达,同时抑制ASK-1表达。本次利用western blot对聪耳通窍剂干预豚鼠GM肾毒性研究中进一步表明,肾组织中,中药+GM组Trx表达明显高于GM对照组,而对ASK-1、Caspase-3表达则明显低于GM对照组,与耳蜗研究结论一致,由此提示,聪耳通窍剂防治豚鼠GM耳、肾毒性损害另外一个关键作用机制可能是通过调控Trx系统,维持细胞内氧化还原平衡和抗氧化功能,促进H2O2转化为H2O,清除细胞内ROS,抑制氧化应激反应,阻止MAPK径路中ASK-1激发引起Caspase家族介导的细胞程序性死亡。
聪耳通窍剂以中医脾肾立论,选择具有补肾健脾为主的中草药组成,对GM耳毒性聋具有防护作用,无疑从一个侧面揭示了数千年传统中医“肾主耳”,“肾开窍于耳”,“肾不及则耳聋”;“清阳出上窍”,“脾主升清”,“脾不及则耳聋”等相关理论的一定科学依据。
