早期听觉衰老小鼠在110dB白噪声暴露下听力损害特征及机制研究
2019-01-14丁同慧柳柯阎艾慧
丁同慧 柳柯 阎艾慧*
1中国医科大学附属第一医院耳鼻咽喉头颈外科(沈阳110001)
2首都医科大学附属北京友谊医院耳鼻咽喉头颈外科(北京100050)
随着现代社会城市化水平的发展,人们遭受噪声暴露的机会大大增加,噪声污染已成为一个影响人类健康的重大课题[1]。相对于高强度噪声(120dB以上)而言,中等偏强的噪声刺激一般不会导致听阈的永久改变,受暴露者的听阈变化多可在数天至半月内得到恢复[2-4]。但是,这些结论都是在相对较为年轻的动物实验中获得的,因而只能用于推断青壮年人群接受类似噪声暴露的情况。对于中年人群或者接近老年的那部分人群,如果他们遭受同等强度的噪声暴露会出现哪些听功能方面的改变,目前尚缺乏相关的研究证据。
目前世界上越来越多的国家均步入老年化社会,由于中老年人整体损伤修复能力下降,我们推测他们对于噪声暴露后的听觉损伤修复能力也会随之下降。为了验证这个假设,本研究计划采用听功能老化早期的6月龄C57小鼠作为实验对象,采用110dB白噪声对小鼠进行暴露,并分别于暴露后不同时间点观察其听功能变化情况;进一步,本研究还将观察小鼠耳蜗毛细胞、带状突触以及毛细胞中线粒体损伤情况,以进一步阐明听功能变化的分子病理机制。
1 材料与方法
1.1 实验动物及分组
1.1.16 月龄小鼠实验:选择6月龄SPF级标准的雄性C57BL/6J小鼠,实验前检查小鼠外耳,排除有外耳及中耳炎症小鼠。并对余下小鼠行听力检测,听力正常者做为本研究的实验及对照组小鼠。本研究将小鼠随机分成4组,3个实验组和1个对照组,每组4只,共计16只。实验组按照暴露后时间分为暴露后1天组(P1)、噪声暴露后7天组(P7)和噪声暴露后14天组(P14),未接受噪声暴露组作为对照。
1.1.2 2月龄小鼠实验:本月龄小鼠听力检测、动物数量、分组及噪声暴露方法均与六月龄小鼠相同。
本实验研究通过首都医科大学伦理委员会批准,并严格按照动物实验伦理规定进行,实验动物购自北京维通利华公司。
1.2 噪声暴露
声音文件由Cool Edit Pro软件(Adobe Systems,USA)合成。 通过音箱(JBL KP6000,PROFESSIONAL by HARMAN,USA)输出110dB SPL宽频带白噪声对各实验组小鼠进行噪声暴露,暴露持续2小时。暴露时将小鼠置于自制的鼠笼中,鼠笼空间尽可能狭小,本研究采用的小鼠笼尺寸为4cm 4cm 16cm。扬声器置于鼠笼之上,为了确保鼠笼之内声音强度误差在1dB之内,实验前我们应用标准声级计对声音进行校准,以确保鼠笼中声音强度符合实验标准。
1.3 听力检测
本研究采用美国TDT测听设备(TDT,Alachua,Florida,USA),Biosig测听软件对小鼠进行ABR阈值检测。测听在隔声屏蔽室内进行,测听前使用10%水合氯醛(O.005ml/g,腹腔注射)对小鼠进行麻醉。麻醉满意后,将记录电极置于小鼠两侧耳廓前缘连线中点皮下,参考电极置于测试耳耳后皮下,接地电极置于对侧耳耳后皮下,发声喇叭距外耳道口约0.5cm。此外,将麻醉好的小鼠置于保温热水袋上维持体温。实验采用短声(Click)和短纯音(Toneburst,Rise/Fall time:1 ms;Durmion:4 ms)作为刺激声,带通滤波为300~3000Hz,叠加次数为1024次,扫描时间10ms。声音强度自90dB开始,以10dB逐渐递减,直至检测不出重复的ABR波形,再向上递增5dB,直至能检测出重复的ABR波形,此刺激声强度即为小鼠的听阈。
1.4 耳蜗基底膜取材
各组小鼠测听完成后即以颈椎脱臼法处死,断头并去除脑组织,分离颞骨与耳蜗,去除蜗壳,将耳蜗置入4%多聚甲醛的培养皿中。在显微镜下使用显微镊戳破蜗顶,前庭窗和蜗窗,灌注多聚甲醛,4h C冰箱过夜。第二天标本用10%EDTA溶液脱钙12h。脱钙完成后置于PBS培养皿中,缓慢剥去软化的蜗壳,前庭膜及盖膜,随后分离蜗轴和基底膜,按顶、中、底回分为三段[5]。
1.5 免疫荧光染色
应用配置好的Triton100-X打孔30min,含有PBS缓冲液的5%的山羊血清封闭1小时,漂洗充分后加入一抗(小鼠来源CtBP2,1∶200,abcam;兔来源GluA2,1∶200,milipore,CA;小 鼠 来 源 8-OHdG,1∶300,abcam)后4hC孵育一晚上,次日用PBS漂洗3遍,每次5min,随后加入二抗(羊抗小鼠488抗体1∶300、羊抗兔 568 抗体 1∶300/羊抗小鼠 568 抗体 1∶300,abcam),毛细胞的纤毛染色染色时(anti-phalloidin),直接加入phalloidin 488抗体(1∶300,thermo)室温避光孵育1h,随后漂洗3次每次5min,用含DAPI的封片剂封片避光保存。
1.6 激光共聚焦显微镜
使用Leica正置共聚焦显微镜(TCS SP5 II;Leica Microsystems,Wetzlar,Germany),使用 63 倍油镜,选择405nm、488nm以及568nm波长的激发光对标本进行层扫,层厚0.35um/层,荧光激发下分别显示蓝色、绿色和红色。以信号出现时开始层扫,以信号消失时结束,将所有图片叠加后形成最终的结果图片。
1.7 耳蜗带状突触计数
在激光共聚焦显微镜下(63X),在中回上分别以三个内毛细胞核为一个计数矩形视野,每个视野中将所有突触标记信号选中包括突触前信号(红)、突触后信号(绿)和叠加信号(橙),三种信号总数计数信号分别除以3得到每个内毛细胞平均突触标记物数量,每个标本随机选取5个视野,共计4个标本(20个视野),最后统计出每组动物带状突触数量(均数i标准差)。
1.8 统计学方法
采用SPSS 18.0统计分析软件处理,噪声暴露前后各组ABR阈值总体比较采用单因素方差分析,各组组间比较采用Dunnet或LSD法检验。带状突触计数结果应用独立样本t检验比较各时间点与暴露前的差别,P<0.05差异具有统计学意义。
2 实验结果
2.1 听功能检测
2.1.1 6月龄小鼠听功能检测
本研究中噪声暴露前小鼠ABR阈值(dB)分别为:37.5i 6.9(click)、50.0i 7.8(4K)、40.0i 5.5(8K)、72.5i 6.9(16K)和84.2i 4.9(24K);噪声暴露后1天,小鼠ABR阈值为54.2i 11.2(click)、65.8i 5.9(4K)、53.3i 9.3(8K)、85.0i 7.1(16K)和89.2i 2.1(24K),在各检测频率阈值均显著上升(P<0.05),且低频听力损失也较为严重(P<0.01);噪声暴露后第7天,小鼠听阈为50.0i 10.0(click)、64.2i 10.7(4k)、50.0i 10.2(8k)、80.0i 9.49(16K)和89.2i 2.1(24k),除16K频率外其它频率阈值仍显著高于对照组(P<0.05),表明此时听力损害仍较严重;暴露后第14天,听阈检测结果为48.3i 6.8(click)、55.0i 4.8(4K)、48.7i 6.8(8K)、79.2i 9.7(16K)以及 88.2i 1.4(24K),此时click、8k以及24k频率上ABR阈值仍显著高于对照组(P<0.05),而其它频率的ABR阈值则和对照组无显著性差异(P>0.05),表明小鼠在暴露两周仅有部分频率的听阈得到了恢复,见图1A。
2.1.2 2月龄小鼠听功能检测
我们采用同等条件的噪声对2月龄C57BL/6J小鼠进行暴露,并分别在暴露前和暴露后1天、7天及14天检测小鼠ABR阈值,结果如下:暴露前阈值为 17.2i 2.6(click)、35.0i 2.3(4K)、24.5i 2.4(8K)、26.7i 2.6(16K)、30.6i 3.6(24K)和53.0i 6.1(32K);暴露后1天阈值23.2i 4.2(click)、40.4i 4.1(4K)、31.3i 4.5(8K)、32.3i 3.5(16K)、43.2i 7.8(24K)和68.3i 10.2(32K),低频及高频阈值上升显著,但幅值较6月龄鼠小;暴露后7天仅有24K和32K存在统计学差异,其阈值为38.8i 4.1(24K)和64.6i 8.2(32K);暴露后14天,小鼠各频率阈值完全恢复(P>0.05),见图1B。
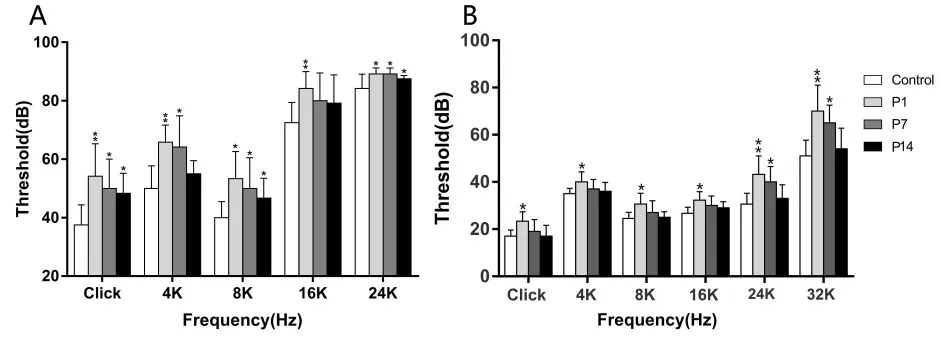
图16 月龄和2月龄C57BL/6J小鼠在110dB噪声暴露下ABR阈值变化Fig.1 Hearing detection after 110dB noise exposure in 6-month-old and 2-month-old C57BL/6J mice
2.2 带状突触标记及计数
为了进一步观察小鼠听力损害的机制,我们对6月龄小鼠耳蜗毛细胞及耳蜗带状突触进行了免疫标记和计数。此实验中,我们标记了突触前特异结构RIBEYE/CtBP2(红色荧光)和突触后谷氨酸受体GluA2(绿色荧光),两者叠加后的标记物(呈现橙色)则代表了一个完整突触结构。本实验中完整突触计数结果为12.4i 0.9/IHC(对照)、5.8i 1.8/IHC(P1)、7.6i 0.9/IHC(P7)和9.8i 1.0/IHC(P14)。结果表明暴露后1天突触数量减少显著(P<0.01),P7的突触数量有所增加;P14时尽管数量继续增加,但仍少于对照组(P<0.05),表明6月鼠龄C57小鼠在噪声暴露14天后,其耳蜗带状数量仍不能完全恢复(图2A&B)。为了比较6月龄和2月龄小鼠在听功能受损程度上是否存在区别,我们对2月龄C57小鼠在同样实验条件下进行了突触数量计数。突触数量分别为为16.4i 1.0/IHC(对照)、10.6i 1.6/IHC(P1)、13.7i 1.4/IHC(P7)和15.5i 1.4/IHC(P14),与6月龄小鼠相比,2月龄小鼠暴露后突触数量恢复情况较6月龄鼠明显,且P14时,2月龄小鼠耳蜗带状突触数量和对照组相比无显著差异(P>0.05)。
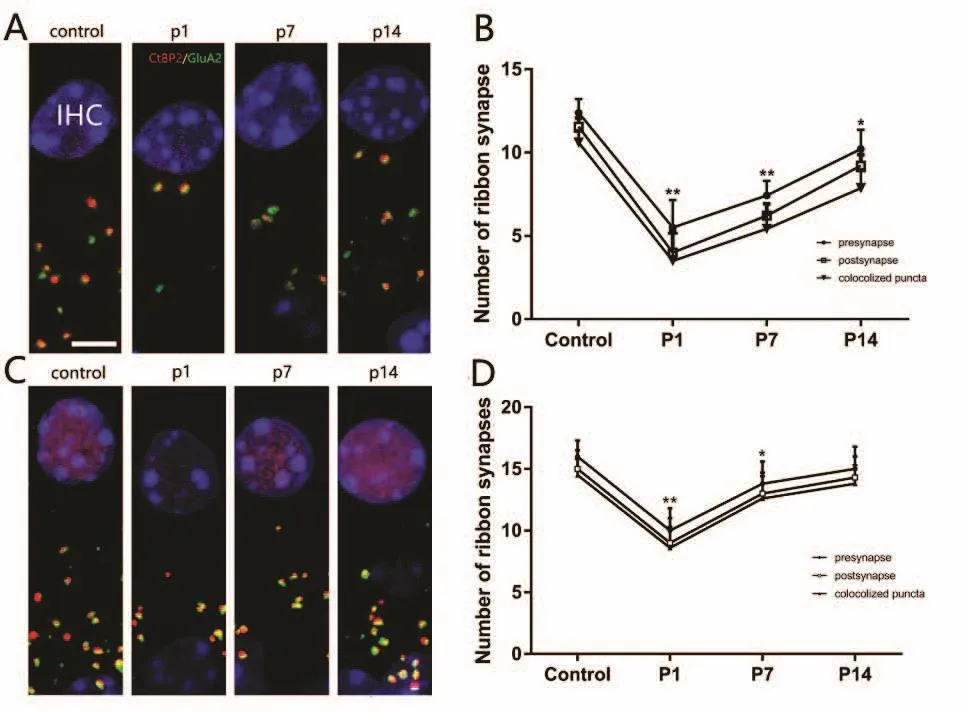
图2 6月及2月龄小鼠在110dB白噪声暴露后耳蜗带状突触数量变化Fig.2 Immunostaining detections of cochlear ribbon synapses in 6&2-month-old mice exposed to 110dB noise exposure.
2.3 110dB白噪声暴露对耳蜗毛细胞线粒体损害观察
本研究同时发现,中等强度白噪声暴露后6月龄C57小鼠耳蜗内外毛细胞数量及排列未发生明显变化。我们标记了中回区域内外毛细胞细胞核的数量和排列,以及进行了毛细胞的纤毛染色,结果显示三排外毛细胞和一排内毛细胞排列整齐,无明显缺失和错排,纤毛染色也十分完整,说明小鼠噪声暴露后听力下降并非是由于毛细胞丢失和纤毛受损导致的(图3)。尽管在共聚焦显微镜观察下在中回区域可见少数外毛细胞丢失情况,但此现象不足以导致听力发生明显损害。
前面的观察已经表明,此种噪声暴露可以导致6月龄小鼠耳蜗带状突触数量的减少,因而推测其可能是听觉损害的发生原因。进一步,我们试图发现是什么导致了突触减少呢?我们进而对毛细胞内的线粒体进行了观察,我们通过观察8-OHdG染色变化情况来评估线粒体DNA的损伤情况。我们发现对照组几乎看不到8-OHdG表达。而在噪声暴露后1天、7天和14天,耳蜗内、外毛细胞胞浆中8-OHdG染色均表现出较高水平。其中内毛细胞的胞浆8-OHdG染色表达水平更高。即使在P14,内外毛细胞仍可见较高的8-OHdG染色信号(图3),此结果表明噪声暴露导致的听力损失与突触损伤可能和耳蜗毛细胞线粒体DNA的损伤可能有关。

图3 110dB白噪声暴露对耳蜗内外毛细胞、毛细胞纤毛及线粒体的影响Fig.3 Changes of cochlear OHCs,IHCs,hair cell cilia,and mitochondria DNAafter 110dB noise exposure.
3 讨论
我们生活中存在很多环境噪声,比如汽车、飞机和施工机械发出的声响[6]。与高强度脉冲式噪声不同,该中等偏强的噪声频率范围较广隐性危害较大[7,8]。很长的时间内,其被认为是安全的或者危害较小。然而近年来的研究表明,这种噪声暴露依然可以对听觉功能造成损害[9,10]。
本实验室之前的研究表明,此种白噪声可以导致动物出现暂时性阈移,经历这种类型噪声暴露后动物ABR阈值在暴露后数天一般可恢复[11,12];同时小鼠耳蜗带状突触数量也可以恢复[3,11]。本实验中上述结果再次得到验证。
然而在这种条件下,听觉老化早期小鼠则显示了不尽相同的听力学表现:我们发现6月龄小鼠在暴露后2周ABR听阈仍显著高于对照组,说明此时小鼠的听功能没有完全恢复。而在石林等的研究中,小鼠鼠龄介于6-8周之间,这个范围的小鼠较为年轻且听觉系统发育已成熟,并且完全没有出现年龄相关性听力损失。说明听觉系统发育成熟且较为年轻的小鼠对噪声损害的代偿能力较强,其升高的ABR阈值可以得到恢复。而处于听觉老化早期的C57小鼠(6月鼠龄)对相同噪声暴露的代偿能力则显著降低。进一步,本实验中发现6月龄小鼠低频听力下降较重而高频听力下降相对较轻,和Liberman实验室有区别,可能是由于本课题组采用的白噪声覆盖的频率范围广,因而高频区能量较低导致听力损失程度较轻,而低频区能量提高导致低频听力损失程度加重[14]。
很多研究表明,噪声暴露后动物耳蜗组织内产生过量的自由基如活性氧自由基(Reactive oxygen species,ROS)。ROS可直接引起脂质过氧化反应和DNA过氧化反应,持续对细胞造成伤害,从而导致毛细胞功能状态受损和听力下降,甚至导致毛细胞凋亡[15,16]。线粒体是细胞内能量代谢和ROS生成的主要场所[17]。噪声暴露产生的ROS可攻击线粒体DNA导致其突变,产生特异性的标志物8-OHdG。我们的研究发现,噪声暴露后,各组6月龄小鼠耳蜗内外毛细胞均出现了明显的8-OHdG表达升高,这表明了这种强度噪声可以对耳蜗毛细胞线粒体造成损害。
本研究显示噪声暴露后CtBP2和GluA2数量明显下降,而在中回区域内未见内外毛细胞明显的大量丢失,尽管存在少量毛细胞缺失现象,但是这种缺失尚难以引起听力的显著损害,说明了本实验的噪声通过损害耳蜗带状突触进而损害动物听力。我们发现6月龄鼠噪声暴露后突触数量不能完全恢复,同时6月鼠龄C57小鼠在突触受损的同时发生了耳蜗毛细胞线粒体的损害。有研究表明,神经细胞中约有1/3线粒体用来供给突触活动所需能量和维持突触稳定性[18]。本研究发现耳蜗大部分区域(顶中回)毛细胞数量和纤毛均无明显变化,但是内外毛细胞线粒体DNA受损(8-OHdG标记物表达水平升高),可能是带状突触的数量难以恢复的原因,同时线粒体供能下降和带状突触的缺失可能是听力难以恢复的原因。这些说明噪声暴露可与听觉老化作用相互叠加,使听力损害程度显著加重,以上结果可能揭示了噪声对6月龄C57小鼠听功能损害的分子机制。
总之,本实验发现听觉老化早期的6月龄C57小鼠对该110dB噪声暴露更加敏感。尽管小鼠实验不能完全等同于人类的研究,但本研究仍对人类老年性聋具有重要的参考意义:对于那些已出现听力损失的中老年人群,噪声暴露仍具有一定的危险性,此类人群也需要避免频繁接触噪声环境,对于已经发生了噪声性听力损害的中老年人则需要采取更加积极的治疗措施。
