青花菜乙烯反应传感蛋白基因BoERS的克隆与表达分析
2019-01-09张志仙张慧娟陈孝赏尹龙飞
蒋 明 张志仙 张慧娟 管 铭 陈孝赏 尹龙飞 刘 洁
(1台州学院生命科学学院,浙江椒江 318000;2台州市农业科学研究院,浙江临海 317000)
植物在与病原微生物协同进化(co-evolution)过程中形成了独特的防御机制,当受到病原物入侵时,植物激活一系列防卫反应,引起基因表达和生理生化的改变,以抵御病原菌的进一步侵染和扩张[1]。在植物抗病反应中,水杨酸(salicylic acid,SA)、茉莉酸(jasmonic acid,JA)和乙烯(ethylene,ET)等激素在复杂的信号转导网络中起着十分重要的作用,并能针对不同的病原菌对信号分子进行精确调控,以减少或消除病原物侵染对植物造成的伤害[2-5]。SA依赖的抗病信号途径由活体营养型病原菌(biotrophic pathogens)触发,如霜霉菌 (Hyaloperonospora parasitica)、芸薹根肿菌(Plasmodiophora brassicae)、十字花科白粉菌(Erysiphe cruciferarum)等[6-8]。另一种抗病信号途径则由JA/ET介导,主要针对死体营养病原菌(necrotrophic pathogens)的侵染,这些病原菌包括核盘菌(Sclerotinia sclerotiorum)和灰葡萄孢菌(Botrytis cinerea)等[9-10]。此外,JA/ET还介导非病原菌引发的诱导性系统抗性(induced systemic resistance,ISR),如荧光假单胞菌WCS417r菌株可诱导产生ISR,以抵御丁香假单胞菌番茄致病变种(Pseudomonas syringaepv.tomato)的侵害[11-15]。
乙烯介导的抗病信号传递途径中,位于内质网膜上的乙烯受体起着感受和结合乙烯的作用[16]。乙烯受体在植物中以小家族形式存在,在拟南芥中共有5个成员,分别是 ETR1(ethylene resistant/ethylene receptor 1)、ETR2、ERS1(ethylene response sensor 1)、ERS2 和 EIN4(ethylene insensitive 4)[16-19];番茄(Lycopersicon esculentum)中至少有6个成员,分别为LeERT1、LeERT2、NR、LeERT4、LeERT5、LeERT6[20-21]。组成型三重反应(constitutive triple response 1,CTR1)是乙烯信号转导途径的重要组分,乙烯受体与乙烯结合导致下游组分CTR1失活,并诱发后续的一系列信号转导[22-23]。
青花菜(Brassica oleraceavar.italica)为十字花科芸薹属一年或二年生草本植物,是我国一种重要的蔬菜作物[24-25]。目前有关ERS的报道仅见于拟南芥(Arabidopsis thaliana)、石斛属(Dendrobium)、万代兰属(Vanda)和绿竹(Bambusa oldhamii)等少数植物[26-29],ERS在青花菜中的研究尚未见报道。近年来,随着青花菜种植面积的不断扩大,菌核病、根肿病等病害的发生日趋严重,但由于青花菜种质资源的匮乏,限制了抗病种质的创制,而寻找优质的靶标基因用于分子育种,是解决这一难题的重要途径之一[30-31]。本研究以青花菜为材料,在克隆BoERS的基础上,研究核盘菌和根肿菌侵染下的表达模式,以期为BoERS基因的功能鉴定和青花菜分子育种奠定一定的理论基础。
1 材料与方法
1.1 试验材料及处理
将青花菜材料Bo0112种植于人工气候箱中(16 h光照/8 h黑暗),培养至两叶一心期时接种核盘菌和根肿菌,并采集健康叶片用于DNA的提取。核盘菌的菌核收集于浙江临海上盘青花菜基地,菌核先用无菌水冲洗,在超净工作台上用0.1%HgCl2浸泡8 min,无菌水冲洗5次,然后用无菌滤纸吸干后,利用洁净的手术刀片将菌核切成小块,接种至马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)上,再置于 22℃条件下恒温培养,待菌丝长满整个培养基表面时,用5 mm打孔器切取菌落边缘的琼脂块,接种至叶片正面,对照接种 PDA 培养基。 分别采集处理 0、6、12、24、36、72 h时的叶片,液氮速冻后置于-80℃保存备用。根肿菌采自浙江温岭青花菜栽培基地,根部肿块用自来水冲洗干净后,无菌水浸泡30 min。根肿块用无菌滤纸吸干后在研钵中研碎,再用多层纱布过滤,最后用无菌水稀释成3×108cfu·mL-1的菌液。接种处理参照张小丽等[31]的方法,对照用等量的无菌水,分别于接种0、5、10、15、20、25 d 时采集病根,无菌水快速洗净后用于RNA的提取。
1.2 方法
1.2.1 DNA、RNA的提取及cDNA的合成 称取0.5 g叶片,液氮研磨成粉末后,用DNA快速提取试剂盒(北京鼎国昌盛生物技术有限责任公司)法提取基因组DNA,按照说明书进行操作;RNA的提取采用TRIzol法[32],分别以对照、病原菌处理的叶片和根为材料,cDNA第一链的合成采用TaKaRa(日本)公司提供的PrimeScriptTM1st Strand cDNA Synthesis Kit试剂盒,反转录的操作根据说明书进行操作。
1.2.2 基因的克隆 根据NCBI数据库甘蓝型油菜的ERS基因(登录号:XM_013864976.1),利用Primer Primer 5.0设计PCR引物。上游引物为5′-ATGTTAA ACACATTGTTAGTTCACGGTCT-3′,下游引物为 5′-TTA CTGACGCCAATGACCGTTAC-3′。 PCR 采用 25 μL 的反应体系,分别以叶片DNA和cDNA为模板进行扩增。 在 PCR 管中依次加入2.5 μL 10×缓冲液、0.5 μL 2 U·μL-1的Taq聚合酶、0.5 μL 10 mmol·L-1的 dNTP mix(上海生工生物工程股份有限公司)、20 μmol·L-1上/下游引物各 0.4 μL、35 ng模板,最后加无菌ddH2O至终体积25 μL。PCR反应程序:94℃预变性5 min;94℃ 变性 40 s,56.6℃ 退火 65 s,72℃ 延伸 2.5 min;72℃延伸 10 min,4℃保存。
PCR产物经电泳后,切割含目的条带的胶块,利用江苏碧云天生物技术研究所提供的DNA凝胶回收试剂盒回收。连接体系为10 μL,包括5 μL快速连接缓冲液(2 ×)、1 μL pGEM-T easy 载体(Promega,USA)、3 μL回收产物和1 μL连接酶。 将反应物置于4℃冰箱中连接过夜,42℃水浴热激90 s,然后将连接产物转入DH5α大肠杆菌感受态细胞(北京全式金生物技术有限公司)。经平板涂布、37℃培养、蓝白斑筛选、挑单菌落和PCR检测,各挑选4份阳性菌液进行测序。
1.2.3 表达分析 根据测序结果设计实时荧光定量PCR引物,上/下游引物分别为5′-ATGTCCCATTTGCT CTCCGGC-3′和 5′-GTCTTCTTACTCAGCATAAACTCA CG-3′;以肌动蛋白基因为内标,上/下游引物分别为5′-TCTCGATGGAAGAGCTGGTT-3′和 5′-GATCCTTAC CGAGGGAGGTT-3′。 PCR 反应在 Roche LightCycler®96实时荧光定量PCR仪(Roche,Switzerland)上进行,在 20 μL 反应体系中,分别加入10 μL 2 × Master Mix、上/下游引物(20 μmol·L-1)各 0.25 μL、1 μL cDNA 和8.5 μL ddH2O。 PCR 程序:95℃ 预变性 10 min;95℃变性 15 s,55℃退火15 s,72℃延伸30 s,共40 个循环,设3次生物学重复,基因相对表达量(倍数)采用2-△△Ct法[33]计算。
1.2.4 生物信息学分析 BoERS的同源蛋白序列下载自NCBI,这些序列来自甘蓝型油菜(CDX86641.1)、白菜(Brassica rapa)(XP_009111113.1)、萝卜(Raphanus sativus)(XP_018447750.1)、盐芥(Eutrema salsugineum)(ESQ36494.1)、荠菜(Capsella rubella)(EOA39884.1)、玉山筷子芥(Arabis lyratasubsp.lyrata)(EFH68467.1)、拟南芥(ANM61043.1)和亚麻荠(Camelina sativa)(XP_010457474.1)等作物。
在线工具ProtParam(http://web.expasy.org/protparam/)用于预测分子量、等电点、原子组成和总平均亲水性系数(grand averageof hydropathicity,GRAVY);DNAMAN 5.2.2软件用于蛋白质的翻译;SMART在线工具(http://smart.embl-heidelberg.de)用于预测编码蛋白的结构域;Clustal X 1.81软件用于对齐BoERS及同源蛋白序列分析。采用Mega 3.1构建系统发育树,方法为邻接法(Neighbor-Joining),自举检测次数为1 000。
2 结果与分析
2.1 BoERS基因的序列分析
测序结果表明,BoERS的基因组 DNA全长为1 928 bp,在1 684~1 750 bp处有一个长度为68 bp的内含子,内含子符合GT-AG规则;编码区全长为1 860 bp,编码619个氨基酸(图1)。
利用NCBI数据库进行BLAST比对,发现BoERS与甘蓝型油菜ERS(XM_009112865.2)序列的相似性最高,达99%,仅在8个碱基上存在差异;与白菜ERS(XM_009112865.2)的差异相对较大,相似性为95%;与萝卜ERS(XM_018592248.1)的相似性较低,仅89%。
经在线工具ProtParam预测,BoERS的理论等电点为8.12,分子量为 68.2 kDa,分子式为 C3030H4878N824O889S35,GRAVY值为0.135,是一种疏水蛋白。利用SMART在线工具预测编码蛋白的结构域,结果表明,BoERS共有6个结构域,分别位于序列的6~23、53~75、82~104、124~146、189~350和376~443处,其中 4个为跨膜结构域,另外2个分别为GAF结构域与HisKA结构域(图2)。

图1 青花菜BoERS的编码区及推导的氨基酸序列Fig.1 Coding sequence and the deduced amino acid sequence of BoERS from broccoli
2.2 BoERS及同源蛋白的多重比对
利用Clustal X软件对蛋白质序列进行多重比对,结果表明,BoERS与同源蛋白的相似性为77%~97%,与甘蓝型油菜(CDX86641.1)的相似性最高,与白菜(XP_009111113.1)次之,相似性为95%,与萝卜(XP_018447750.1)的相似性相对较低,为91%,与拟南芥(ANM61043.1)同源蛋白的相似性最低,仅为77%。TM2和TM4序列完全一致,TM3中仅3个位点存在差异,分别处于+2、+18和+22位,但TM1之间的差异相对较大,除观察到氨基酸的变异外,还存在插入/缺失现象(图3)。GAF结构域中,中部序列的变异相对较大,出现大量的氨基酸变异和插入/缺失现象,而两侧的序列比较保守。与BoERS相比,白菜GAF上有4个氨基酸(SGGP)的插入,而在萝卜GAF中,有5个氨基酸残基(PGGGP)的缺失和5个氨基酸(PSSSR)的插入现象(图4)。
2.3 系统发育分析
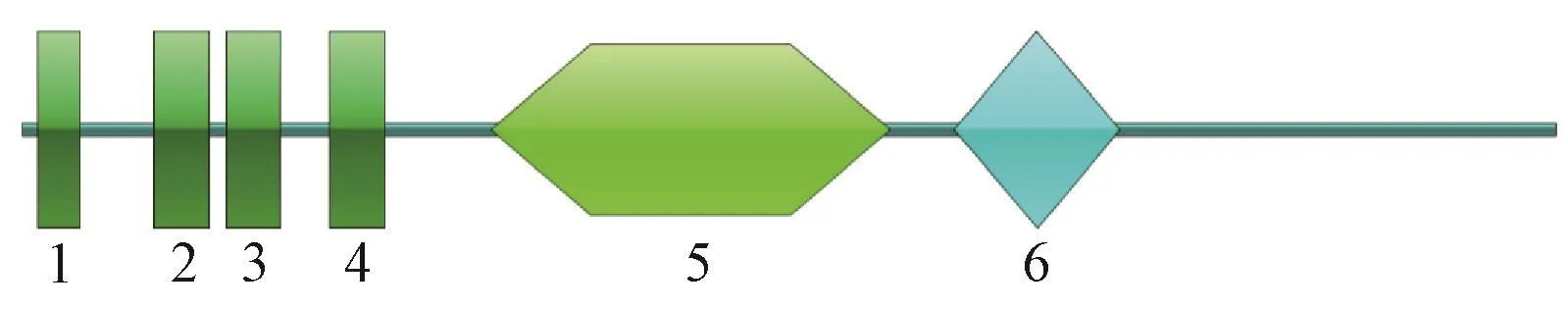
图2 BoERS的结构域Fig.2 Domains of BoERS
利用MEGA软件构建BoERS及其同源蛋白的系统发育树,发现9种植物ERS序列的平均遗传距离为0.137,其中萝卜与荠菜 ERS之间的遗传距离最大,为0.197,甘蓝型油菜和青花菜的ERS之间最小,为0.009。BoERS与其他8种十字花科植物ERS之间的遗传距离为0.009~0.1900;其中与拟南芥ERS的遗传距离最大,为 0.190,其次为玉山筷子芥,为0.186;与甘蓝型油菜 ERS的遗传距离最小,仅为0.009。9种植物的ERS在系统发育树上可分为5组,荠菜和亚麻荠ERS聚为一组(Ⅰ),支持率为99%,玉山筷子芥与拟南芥 ERS聚为一组(Ⅱ),支持率达100%,而盐芥 ERS与它们的关系稍远,单独成组(Ⅲ),青花菜BoERS与白菜、甘蓝型油菜ERS聚为一组(Ⅴ),支持率为100%;萝卜ERS则单独成组(Ⅳ)。

图3 BoERS及同源序列的跨膜结构域Fig.3 Transmembrane domains of BoERS and its homologous sequences
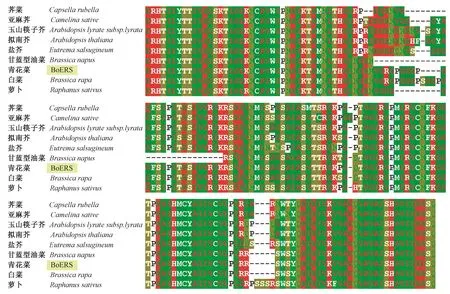
图4 BoERS及同源序列的GAF结构域Fig.4 The GAF domains of BoERS and its homologous sequences
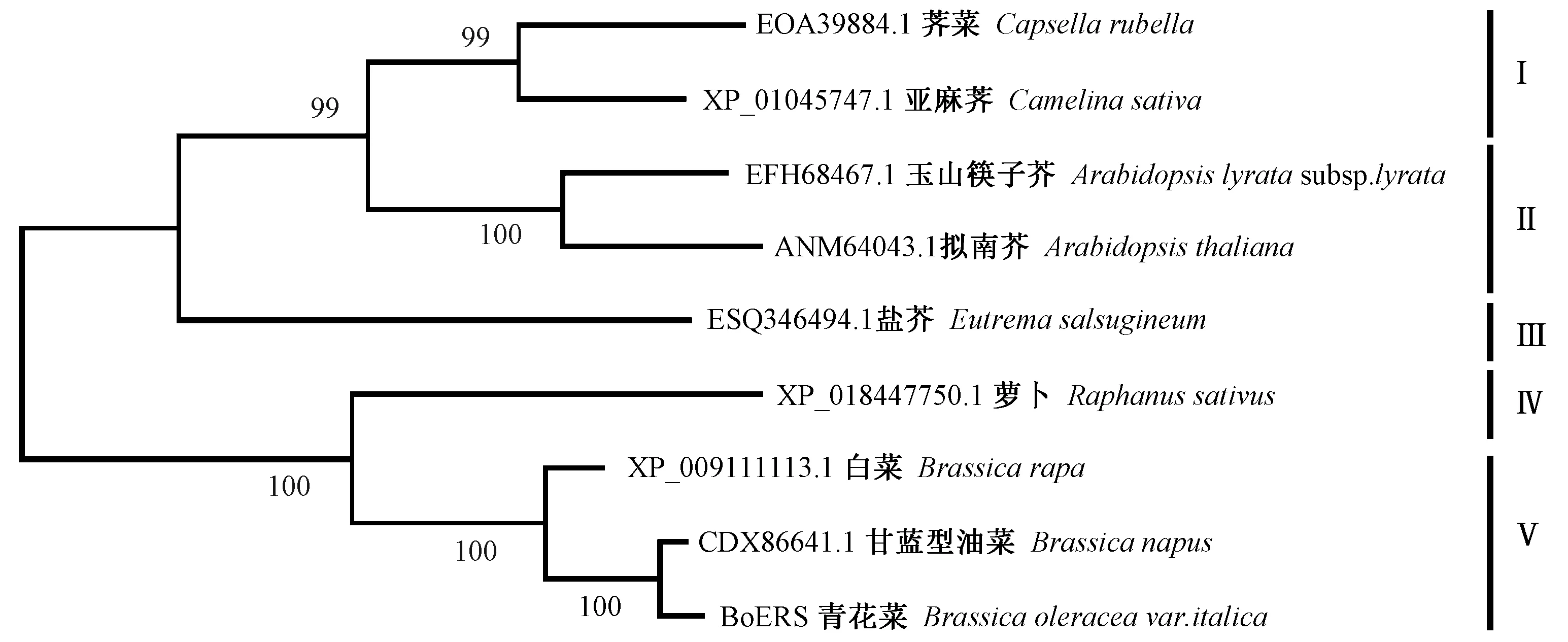
图5 BoERS及同源序列的系统发育树Fig.5 Phylogenetic tree of BoERS and its homologous sequences
2.4 基因表达分析
根据测序结果设计实时荧光定量PCR引物,以肌动蛋白基因为参照。由图6可知,BoERS的表达受核盘菌的诱导,与0 h相比,接菌6 h和12 h时的相对表达量无显著差异;但在接种24~72 h时,相对表达量显著增加,为CK的2.17~3.54倍,36 h时的相对表达量最大,24 h次之,为对照的2.25倍。BoERS的表达不受根肿菌的诱导,接种5~25 d时的表达量与CK相比均无显著差异。
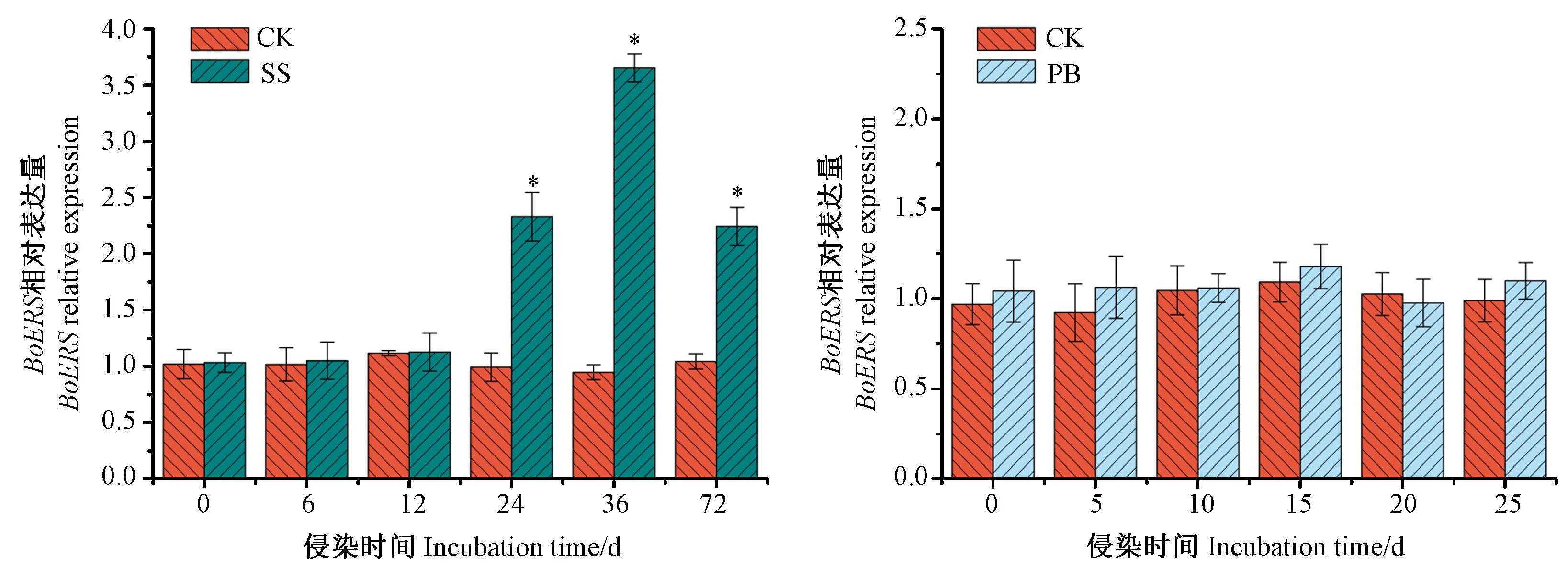
图6 BoERS在2种病原菌侵染下的表达Fig.6 Expression of BoERS gene after inoculated by two pathogens
3 讨论
在模式植物拟南芥中,乙烯信号转导途径为C2H4→乙烯受体(ERS1、ETR1、ETR2、EIN4 和 ERS2)→CTR1→EIN2→EIN3→ERF→乙烯反应,其中的EIN2(ethylene insensitive 2)是乙烯反应的正调控因子,它可被位于其上游的CTR1磷酸化,导致EIN2驻留在内质网上,乙烯信号传递终止;在乙烯浓度较高的情况下,乙烯与乙烯受体结合,造成CTR1无法被受体激活,后续的信号传递得以顺利进行,从而引发乙烯反应[34-35]。近年来,已从多种植物中分离或鉴定到乙烯受体基因,但有关ERS的研究并不常见。研究表明,拟南芥ERS基因的编码区全长为1 938 bp,编码645个氨基酸;石斛品种‘Pompadour’的ERS编码区长度为1 869 bp,编码622个氨基酸[27];绿竹ERS基因的编码区全长为1 899 bp,编码632个氨基酸[29]。绿豆(Vigna radiata)ERS基因的编码区全长为1 911 bp,编码636个氨基酸[36]。本研究中,BoERS的编码区全长1 860 bp,编码619个氨基酸,编码区全长短于上述植物的ERS基因。BoERS具有1个内含子,数量与拟南芥ERS基因相同,但与水稻ERS不同,水稻ERS基因具有4个内含子[37];BoERS的内含子较短,长度仅68 bp,与拟南芥ERS基因的内含子长度接近(72 bp)。ERS序列在十字花科植物中十分保守,暗示它们具有相似的功能。
研究表明,拟南芥的ERS有4个跨膜结构域、1个GAF结构域和1个HisKA[38],与乙烯受体 ETR2和EIN4相比,ERS受体缺失接收结构域(receiver domain),该区域可能参与乙烯的修饰[39]。本研究中,BoERS的跨膜结构域、GAF结构域和HisKA结构域的数量与拟南芥ERS一致。此外,BoERS的羧基端没有接收结构域,符合ERS蛋白的特征。Lokkamlue等[28]对兰科植物石斛属(Dendrobium)、文心兰属(Oncidium)、小兰屿蝴蝶兰(Phalaenopsis equestris)和万代兰属(Vanda)植物ERS的序列结果表明,位于N端的跨膜结构域十分保守,仅个别氨基酸残基存在差别,而GAF结构域中部的变异较大,两端则十分保守。本研究中,9种十字花科植物GAF结构域的保守性与4种兰科植物相似,即中间多变两端保守,但第一个跨膜结构并不像兰科植物那样保守,序列中存在大量的变异、插入/缺失现象。
乙烯是一种气态的植物激素,在响应生物或非生物胁迫中起着重要作用,如干旱、冷害、高温和某些病原菌等,乙烯传感蛋白ERS在这些生物和非生物胁迫起着重要作用,其编码基因的表达受诸多因素(如盐、低温、干旱)的诱导[40]。拟南芥ERS在叶片中的表达量较小,但经5 μL·L-1乙烯处理12 h后,ERS基因的表达量急剧上升,而ERS突变体对乙烯不敏感[41]。番茄乙烯受体基因LeETR4的表达受番茄疮痂病菌(Xanthomonas campestrispv.vesicatoria)的诱导,而反义植株对该菌的敏感性增加[20]。直根酸模(Rumex thyrsiflorus)ERS的表达受低氧环境的诱导,在O2浓度为3%时,RtERS的表达量显著增加[42]。水稻(Oryza sativa)ERS基因OsERS的表达受乙烯诱导,但表达量较低[37]。低温处理鳄梨(Persea americana)和西洋梨(Pyrus communis)果实的ERS基因表达量均显著增加[43-44]。本研究中,BoERS的表达受核盘菌的诱导,表达量在接种36 h时达最大值,但该基因的表达不受根肿菌的影响,与比照相比,表达量无显著差异。核盘菌为死体营养病原菌,其抗病信号途径受JA/ET介导,植物与核盘菌相互作用,细胞内乙烯合成增加,导致ERS基因的表达量增加,而根肿病菌为活体营养菌,其抗病反应采用SA途径,在此过程中没有乙烯的合成,因此青花菜在根肿菌侵染下,不影响乙烯反应[45-46]。
4 结论
本研究以青花菜为材料,克隆到一个乙烯反应传感蛋白基因,命名为BoERS。BoERS具1个内含子,编码区全长为1 860 bp,编码619个氨基酸,该编码蛋白具有4个跨膜结构域、1个GAF结构域和1个HisKA结构域。序列比对结果表明,BoERS与芸薹属ERS序列的差异最小,与萝卜属、盐芥属等植物的ERS差异较大。实时荧光定量PCR结果表明,BoERS的表达受核盘菌的诱导,但不受根肿菌诱导。本研究为进一步开展BoERS基因的功能鉴定和应用研究奠定了基础。下一步将分别构建RNAi和过量表达载体,研究该基因在抗病反应中的功能。
