利用SSR标记和SNP芯片对小麦EMS突变体进行真实性鉴定
2019-01-09耿皆飞蒋宏宝刘录祥许喜堂魏红升王成社谢彦周
耿皆飞 王 娜 蒋宏宝 刘录祥 许喜堂 魏红升王成社 谢彦周
(1西北农林科技大学农学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100;2中国农业科学院作物科学研究所,北京 100081)
1928年美国科学家Stadler[1]首次报道了X射线对大麦具有诱变效应,开启了植物诱发突变研究。据统计,截至2017年12月,世界上已有60多个国家利用诱发突变技术在170多种植物上育成和推广了3 200个突变品种,其中包括286个小麦品种。目前诱发突变技术已广泛应用于农作物新材料创制和优良新品种培育,在解决世界粮食安全与营养供给方面发挥了重要作用,但对于突变体的真实来源和应用价值也引起了越来越多的质疑[2]。如Caldecott等[3]认为很多选择的突变体可能只是田间异源花粉杂交的后代而不是由于辐射诱变产生的真正突变。Knott[4]认为突变尤其在数量性状方面的突变在作物育种中的价值并不高。此外,诱发突变后代的结实率通常会显著下降,即使像小麦这样严格的自花授粉作物,也难以避免受串粉造成的天然异交混杂,且诱变后代通常难以做到严格套袋自交,只要能产生优良变异,在一定程度上可以不区分突变体变异的来源。但对于遗传研究而言,必须区分突变体的变异来源,因此,对诱变后代进行遗传变异评价,区分真实突变体和假突变体,对于更好地发挥突变体在遗传改良和功能基因组研究中的作用具有重要意义。
研究表明,利用表型鉴定通常难以鉴定诱变后代突变体的真实性,而利用SSR标记分析可以有效排除诱发突变体中的假突变体。如Fu等[5]利用236~340个SSR位点对亲本材料及γ射线诱变产生的突变体进行检测,发现亲本与突变体之间不存在多态性。李瑞清等[6]利用分布于水稻12条染色体上的144个SSR标记分析了突变体G9和亲本广占63S,也未发现二者之间存在差异,说明该突变体是由诱发突变而来。但SSR标记会受方法和位点数量的限制,无法从全基因组水平上对突变体进行高通量的真实性鉴定[7]。单核苷酸多态性(single nucleotide polymorphism,SNP)是普遍存在于生物基因组中的一种新型分子标记,具有在基因组中数量最多、分布密度高、无需电泳、可高通量自动化检测等特点[8-9],是继SSR标记之后最有前途的第三代分子标记。陈竹锋等[10]利用Illumina Infinium iSelect SNP(50 K)芯片检测技术比较水稻品种黄华占及其突变体osms55之间的SNP位点差异,发现突变体与亲本黄华占不同的纯合位点仅有6个,由此判断该突变体的遗传背景与黄华占一致,突变体材料来源于黄华占。
小麦(Triticum aestivumL.)是最重要的粮食作物之一,随着小麦基因组测序的迅猛发展[11-13],诱发突变技术制备的突变体在小麦遗传改良和功能基因组学研究中发挥着重要作用[14-19]。目前国内外已经构建了多个小麦甲基磺酸乙烷(ethane methyl sulfonate,EMS)突变体库。并对突变体的分子变异进行了评估,但关于利用分子标记对小麦突变体进行真实性鉴定的报道并不多见。吕兴娜等[7]利用21对核心SSR标记对小麦品种兰天15和郑麦9023的航天诱变后代的抗条锈突变体进行鉴定,发现兰天15的航天诱变衍生系可能存在异花授粉导致的遗传重组,郑麦9023的航天诱变衍生系可能来自航天诱变。目前,小麦中已经开发9 K[20]、90 K[21]、660 K[22]等 SNP 芯片,但利用SNP芯片对小麦EMS突变体进行真实性鉴定尚未见报道。西北农林大学旱区作物逆境生物学国家重点实验室前期利用EMS处理小麦品系H261种子并构建了突变体库。本研究利用SSR标记和90 K SNP芯片对其中3个突变体的真实性进行鉴定,以期为更好地发挥小麦突变体在遗传改良和功能基因组研究奠定一定的理论基础。
1 材料与方法
1.1 材料
LF2010、LF2099和 LF2100是小麦品系 H261经过EMS诱变获得的,经过连续多代自交后已遗传稳定。其中,LF2010为类病斑突变体,与H261相比,其主要农艺性状严重下降[23];LF2099为叶片早衰突变体,其主要农艺性状也严重下降;LF2100为无芒突变体,其主要农艺性状与亲本相差不大(图1)。所有材料均种植于西北农林科技大学北校区小麦试验田。
1.2 试验方法

图1 H261及其EMS突变体的表型Fig.1 The phenotype of H261 and EMS mutants
1.2.1 DNA的提取 待植株长至二叶一心时,取小麦叶片,按照CTAB法[24]提取基因组DNA,用0.8%琼脂糖电泳和NanoDrop One分光光度计(Thermo,USA)检测DNA质量和浓度。
1.2.2 SSR标记分析 用小麦染色体上特异性和稳定性较好的21对核心SSR引物[25]对突变体及其亲本进行检测。SSR引物由生工生物工程(上海)股份有限公司合成。PCR反应体系为 10 μL,含 10×PCR buffer 1 μL,10 mmol·L-1dNTP 0.15 μL,1.25 μmol·L-1引物 2 μL,2 U·μL-1Taq DNA 聚合酶 0.25 μL,10 ng·μL-1模板 DNA 3 μL,超纯水 3.6 μL。 其中 10×PCR buffer、dNTP和TaqDNA聚合酶均购自上海赛默飞世尔科技(中国)有限公司。反应程序:94℃预变性5 min;94℃变性 30 s,55℃退火 30 s,72℃延伸 30 s,36个循环;72℃终延伸10 min,4℃保存。PCR产物经6%聚丙烯酰胺变性凝胶电泳分离,以2 000 V电压电泳1.0~1.5 h。凝胶染色采用简化硝酸银染色法[26]。
1.2.3 SNP芯片分析 委托北京康普森生物技术有限公司,利用美国Illumina公司和美国堪萨斯州立大学共同开发的小麦90 K基因芯片对突变体及其亲本材料进行检测,其多态性分析采用Genomestudio v1.0软件进行分析。
2 结果与分析
2.1 突变体的SSR检测
SSR分析结果表明,H261与CS的差异标记为14个,多态性比例高达66.67%。H261与 LF2010和LF2099的差异SSR标记均为0个,但与LF2100的差异SSR标记为10个,多态性比例为47.62%(表1)。参照小麦纯度检测标准[27],差异标记≥3表示与亲本遗传相似性低,存在异花授粉或机械混杂的可能性。LF2100与亲本H261差异标记为10个,由此推测LF2100是天然异交或机械混杂产生的假突变体,LF2010和LF2099与亲本H261的差异标记均为0(图2),说明LF2010和LF2099 2个突变体与亲本H261的遗传背景高度一致,是H261经过EMS诱变的后代。
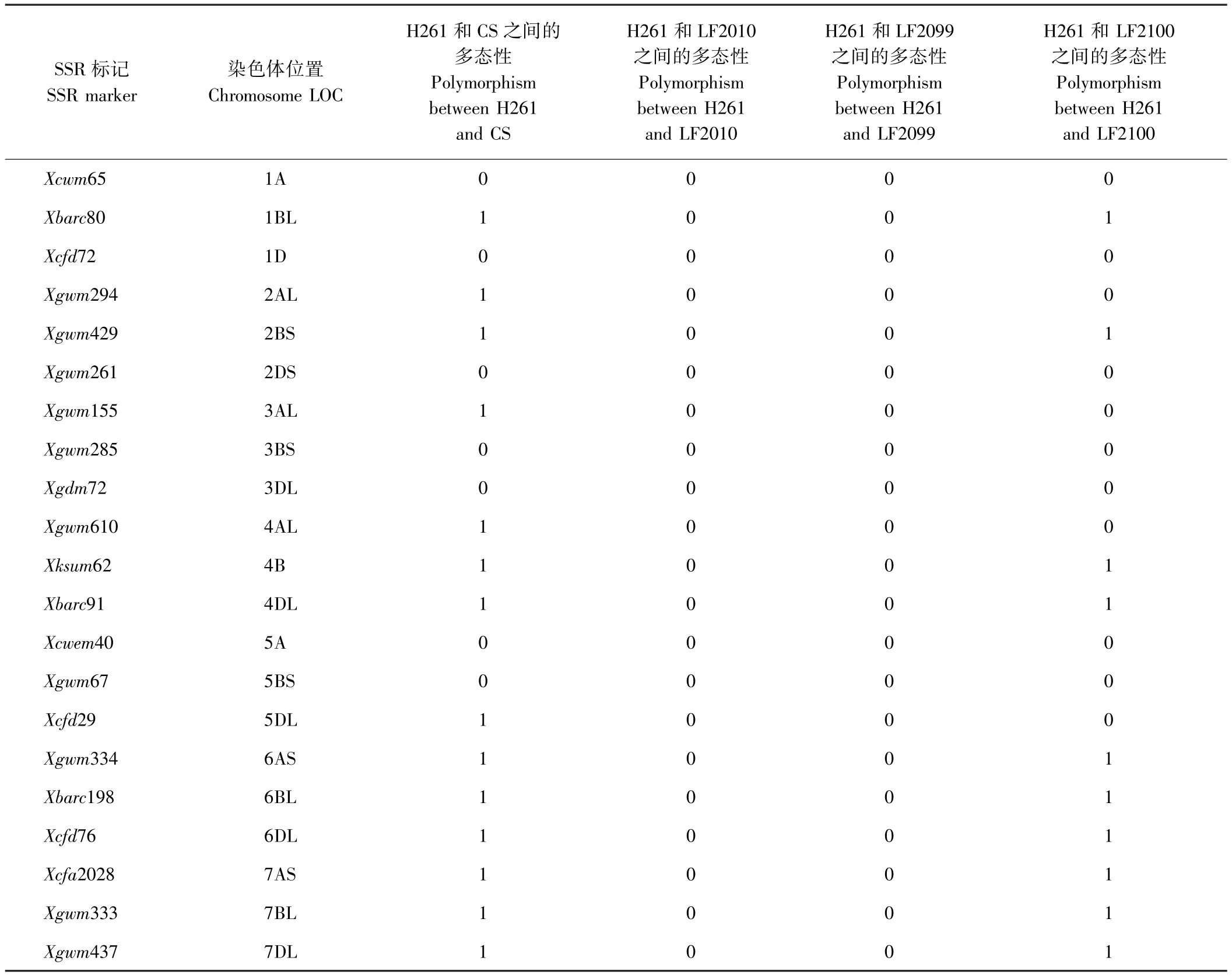
表1 小麦亲本材料与突变体之间的21个SSR标记多态性检测Table1 Polymorphism of 21 SSR markers between parent lines of wheat and mutant
2.2 突变体的SNP检测
为了进一步探究突变体的遗传背景与亲本的关系,利用90 K基因芯片的81 597个SNP标记对H261及其衍生的突变体进行多态性分析。结果表明,H261与CS的差异位点仅3 481个,占总数的4.266 1%,纯合差异 SNP为1 469,占总数的 1.800 3%;H261与LF2010和LF2099之间的差异位点分别为66和12个,这些差异SNP随机分布于除2D、4D和6D以外的染色体上,分别占总数的0.080 9%和0.014 7%,2个突变体与H261的纯合差异SNP均为0;而H261与LF2100之间的差异位点为 2 846个,占总数的3.487 9%,二者之间纯合差异SNP为784,占总数的0.960 8%(表2)。上述结果从分子水平上进一步证明了突变体 LF2010和 LF2099的真实性,且说明LF2100与亲本H261的遗传背景不一致,不是H261经过EMS诱变的后代。
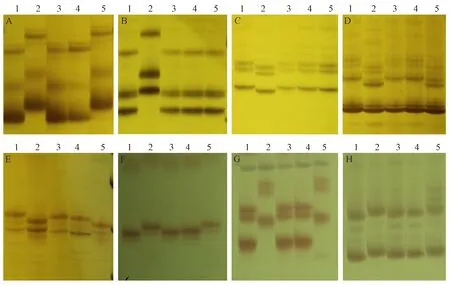
图2 部分核心SSR引物在亲本材料及其突变体的电泳图Fig.2 Electrophoretic map of some core SSR primers in parent materials and their mutants
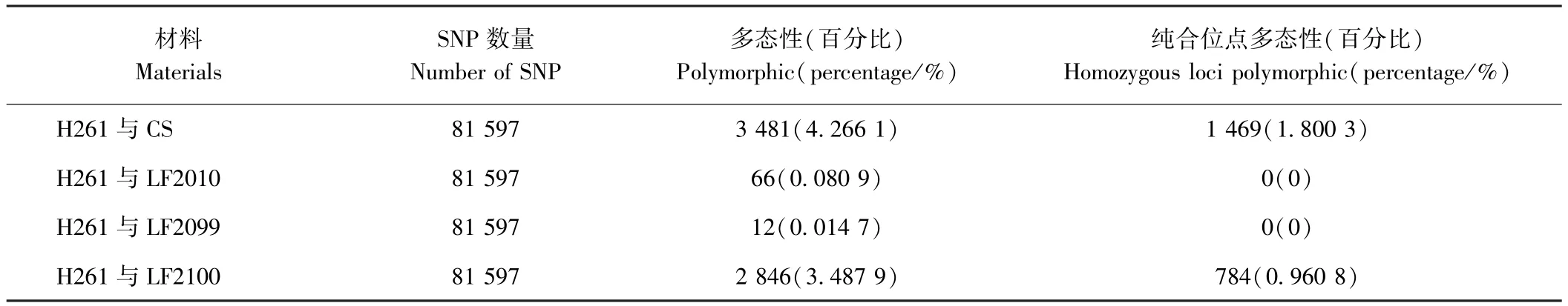
表2 小麦亲本材料与突变体之间的SNP标记多态性检测Table2 Polymorphism of SNP marker between wheat mutant and parent lines
3 讨论
王立新等[25]研究表明,不同的小麦品种之间核心SSR标记具有较高的多态性。本研究结果表明,在H261和中国春(CS)之间的多态性比例高达66.67%。吕兴娜等[7]利用21对核心SSR引物对小麦品种兰天15和郑麦9023的航天诱变后代中筛选出抗条锈病突变体进行检测,结果表明兰天15的航天诱变衍生系与亲本间差异标记数量较多,推测可能存在异花授粉导致的遗传重组,而郑麦9023的航天诱变衍生系与亲本差异标记数量均不超过2个,推测成株期抗病性变异可能来自航天诱变。本研究利用相同的21对核心SSR引物对H261及其EMS突变体进行检测,结果发现,诱发突变体与亲本之间,不存在SSR标记多态性,与前人研究并不一致,其原因可能是本研究中的诱发突变体和亲本之间并未检测出任何SSR位点的差异,也有可能是所用标记数量较少导致的。但Fu等[5]关于水稻的研究发现,利用236~340个SSR位点进行检测,亲本材料及γ射线诱变产生的突变体之间未发现多态性。因此,本研究利用这21个核心SSR标记可以有效地排除小麦诱变突变体中由于各种原因造成的假突变体。
小麦EMS诱变产生的突变类型主要是点突变和部分缺失突变,Krasilev等[16]研究发现,六倍体小麦每个EMS突变系平均含有5 351个EMS类型突变;而六倍体小麦基因组的大小为17 Gb,即17×109bp,突变频率为315×10-9。本研究仅采用21对SSR引物,引物总长度为879 bp,在任何一个突变体中检测到某一个突变的概率约为2.77×10-4。此外,根据SSR标记的原理,即使突变位点发生在SSR引物结合位点,该突变位点也不一定能被SSR标记检测出来。从理论上解释了本研究未能找到突变体与亲本的多态性的原因。然而,在其他小麦EMS诱变后代的SSR标记检测结果中,亲本与突变体之间却可以轻易检测出多态性[28-30],这暗示这些突变体可能是由于各种原因产生的假突变体,当然,也存在突变位点导致SSR位点变化的可能,但这种可能性较低。
由于利用SSR标记难以鉴定突变体和亲本材料之间的差异,本研究尝试利用小麦90 K高通量SNP分析芯片对H261及其衍生的EMS突变体进行分析。结果表明,突变体LF2010和LF2099与亲本H261之间的差异位点极少,多态性比例分别为0.080 9%和0.014 7%,且纯合的差异位点均为0,进一步证明了LF2010和LF2099是由H261诱变而来。SNP芯片克服了SSR无法从全基因组水平上进行高通量分析的缺点,在未来的研究中可以逐步代替SSR标记,用于检测小麦突变体的真实性,尤其是在利用高通量测序技术对突变体进行深入研究之前,突变体真实性鉴定显得尤为重要[7-8]。
4 结论
本研究结果表明,LF2010和LF2099突变体与亲本H261的遗传背景高度一致,是H261经过EMS诱变的后代,而LF2100是天然异交或机械混杂产生的假突变体。SSR标记和SNP芯片2种方法均可以有效鉴定EMS突变体的真实性,SNP芯片由于可以进行高通量和全基因组水平的分析,在小麦突变体的真实性鉴定方面显示出更大的应用潜力。本研究结果为更好地发挥小麦突变体在遗传改良和功能基因组研究中的作用奠定了一定的理论基础。
