巴哈雀稗PnDREB2基因克隆及时序表达图谱构建
2019-01-09张宇君王普昶赵丽丽曾庆飞
张宇君 王普昶 赵丽丽 曾庆飞 张 雄 陈 超 董 瑞
(1贵州大学动物科学学院草业科学系,贵州贵阳 550025;2贵州省农业科学院草业研究所,贵州贵阳 550006;3贵州省农业科学院畜牧兽医研究所,贵州贵阳 550005)
巴哈雀稗(Paspalum notatum)为禾本科雀稗属多年生草本植物,又称百喜草,具有抗干旱、耐贫瘠、覆盖性好等优点[1]。巴哈雀稗被广泛运用于水土流失治理、荒山荒坡绿化、果园覆盖、饲草料等[2],同时因其适应性广、抗逆性强等特点可作为研究牧草抗逆机理的理想材料,但目前关于巴哈雀稗抗逆机制的相关研究尚未见报道。
植物主要通过信号传导和转录因子对一系列抗逆相关基因的网络进行调控以抵御逆境胁迫。转录因子是指能够与基因启动子区中的顺式作用元件发生特异性结合的蛋白质[3],其能通过与顺式作用元件及其他有关蛋白的互相协调作用调控下游一系列基因的转录[4]。目前,已发现的转录因子种类较多,其中脱水反应元件结合蛋白(dehydration responsive element binding proteins,DREB)是一类植物特有的与非生物胁迫密切相关的转录因子,主要分为DREB1和DREB2两类,隶属于AP2/EREBP转录因子家族[5]。DREB类转录因子能够与抗性相关基因启动子中的DRE/CRT(C-repeat)干旱应答元件特异性结合,并激活下游逆境诱导基因的表达,从而增强植物对逆境胁迫的耐受性[6]。Liu等[7]首次在拟南芥(Arabidopsis thaliana)中克隆鉴定获得DREB类转录因子之后,国内外研究者对DREB植物转录因子相继开展了广泛的研究[8-10]。现已从玉米(Zea mays)[11]、小麦(Triticum aestivum)[12]、水稻(Oryza sativa)[13]等多种作物中鉴定分离出DREB/CBF基因,证实了DREB/CBF基因受干旱、盐碱、温度、激素等非生物胁迫的诱导表达。杨凤萍[14]将CBF1基因转入高羊茅(Festuca elata),DREB1B转入黑麦草(Lolium perenneL.)中,成功获得了抗旱性增强的转基因高羊茅和黑麦草。Li等[15]将拟南芥CBF1/DREB1b基因以35S为启动子转入到中华结缕草(Zoysia sinicaHance)中,明显提高了其转基因植株的抗寒性。上述研究表明,通过基因工程技术培育抗逆性较高的草坪草或牧草在生产上具有重要的意义。
本试验采用RNA-Seq、RT-PCR结合实时荧光定量PCR方法,以巴哈雀稗为材料克隆获取DREB2基因序列,并对其在高盐、干旱、高温、低温、脱落酸、赤霉素等逆境胁迫下的表达模式进行分析,以期为阐明雀稗属植物DREB类转录因子基因家族的作用机理,为进一步通过转基因技术改良巴哈雀稗栽培种的抗逆性提供一定的理论依据。
1 材料与方法
1.1 材料
野生巴哈雀稗,由贵州省农业科学院草业研究所提供。
1.2 方法
1.2.1 胁迫处理 将大小均匀一致、籽粒饱满的巴哈雀稗种子灭菌消毒后,置于垫有两层滤纸的灭菌培养皿中发芽,待胚根全部长出且达到种子的二分之一长度后,选取发芽一致的种子播于带孔的发芽床上恒温培养(光照14 h/黑暗10 h,温度25±2℃)至三叶一心时进行处理。利用 E-36L植物培养箱(美国PERCIVAL公司)分别进行高温(40℃)和低温(4℃)处理 2、4、6、8、10、12、24、48、72 h;在常温(25℃)下,分别用含有 300 mmol·L-1NaCl、20%PEG-6000、100 μmol·L-1脱落酸(abscisic acid,ABA)和100 μmol·L-1赤霉素(gibberellin,GA)的1/2 Hoagland培养液分别处理 2、4、6、8、10、12、24、48、72 h。 以未进行任何胁迫,仅用1/2 Hoagland培养液培养的幼苗为对照(CK)。每处理均设3次生物学重复。待巴哈雀稗培养至孕穗期后,剪取生长良好的根、茎、叶和幼穗组织,结穗期获取籽粒饱满的种子,以上组织均在剪取时用液氮速冻,-80℃保存备用。
1.2.2 总RNA提取及 cDNA第一链合成 采用TRIzol法[16]提取经 NaCl、PEG-6000、高温、低温、ABA、GA胁迫处理下10个不同处理时间段的巴哈雀稗幼苗组织样品的总RNA,RNA完整性采用琼脂糖凝胶电泳鉴定,260/280 nm吸光值测定RNA浓度和纯度。采用RevertAidTMFirst Strand cDNA Synthesis反转录试剂盒(北京明阳科华生物科技有限公司)对检测合格的RNA样品进行逆转录。
1.2.3 转录组测序 为获取巴哈雀稗基因全序列,将未经胁迫、正常生长至三叶一心时期的巴哈雀稗幼苗叶片组织RNA样品送至上海生工生物工程有限公司,采用Illumina HiSeqTM2000进行转录组双末端测序。
1.2.4 巴哈雀稗DREB2基因CDS区克隆 将巴哈雀稗转录组测序获取的Unigene结果与GenBank中已上传的高粱(Sorghumbicolor)、小麦、割手密(Saccharum spontaneum)等物种的DREB2基因序列进行BLAST比对分析,初步筛选出巴哈雀稗DREB2基因全序列,并以此为依据设计巴哈雀稗DREB2基因CDS区扩增引物。利用RT-PCR技术,以巴哈雀稗cDNA为模板扩增DREB2基因CDS区,进一步验证转录组测序结果。
克隆扩增体系共 20 μL,包括 2×TaqPCR Master Mix 10 μL,上下游引物(10 μmol·L-1)各 1 μL,cDNA模板1 μL,ddH2O 7 μL。 PCR 反应程序:94℃预变性2 min。 94℃变性 30 s,退火温度(详见表1)30 s,72℃延伸30 s,共35个循环;72℃终延伸2 min。将切胶纯化回收产物与pMD18-T载体进行连接,采用热激法将载体转入至DH5α感受态细胞中,恒温(37℃)培养12~16 h后在Amp+平板挑取阳性菌落到含氨苄液体培养基中,培养 15 h(260 r·min-1,36.5℃)后进行菌体PCR鉴定。合格扩增产物样送上海生工生物工程技术服务有限公司测序。
1.3 生物信息学分析
通过在线软件ProtParam(http://web.expasy.org/protparam/)对PnDREB2蛋白质理化性质进行分析;采用(http://web.expasy.org/protscale/)预测目的蛋白质疏水性;采用 SWISS-MODLE(http://swissmodel.expasy.org/)预测目的蛋白的三级结构;采用NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)在线软件预测目的蛋白的磷酸化位点;采用Tmpred(http://www.ch.embnet.org/software/TMPRED_form.html)分析目的蛋白的跨膜结构;采用TargetP(http://www.cbs.dtu.dk/services/TargetP/)分析目的基因的亚细胞定位。不同物种DREB2基因氨基酸序列的同源关系采用DNAMAN 6.0软件分析;应用MEGA 5.1软件构建不同物种间的系统进化树。
1.4 巴哈雀稗DREB2基因实时荧光定量分析
采用RT-qPCR检测巴哈雀稗DREB2基因在不同组织以及不同胁迫处理下叶片组织样品的表达差异水平。反应条件:2×UltraSYBR Mixture(With ROX)10 μL,上、下游引物(10 μmol·L)各 0.4 μL,cDNA 1 μL,用灭菌水补充至总体积为20 μL。反应程序:95℃预变性3 min;95℃变性10 s,退火温度(详见表1)30 s,72℃延伸30 s,共40个循环;退火与荧光采集同时进行,时间为 5 s,温度范围为 60~95℃,台阶温度为0.5℃。对标准品cDNA和待测样品均设置3次生物学重复,采用2-ΔΔCt法[16]计算基因的相对表达量。
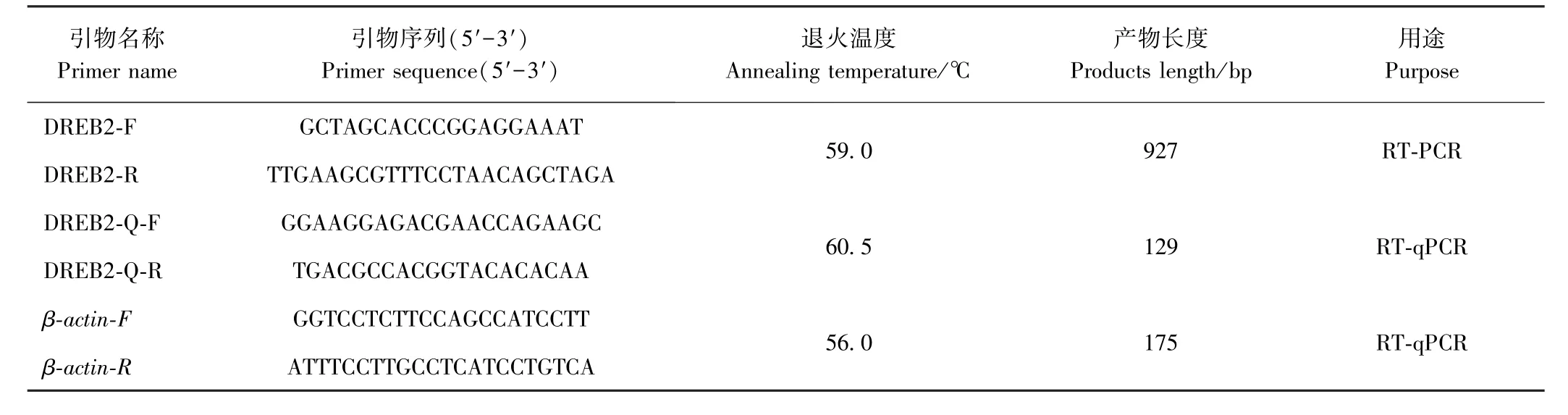
表1 试验引物序列Table1 Primers sequence used in the study
2 结果与分析
2.1 巴哈雀稗转录组数据组装分析
采用Illumina HiSeqTM高通量测序技术对未经胁迫处理的巴哈雀稗幼苗叶片进行转录组测序,共获得42 844 132个reads片段和6.42 GB的序列信息。采用Trimmomatic进行数据处理,获得40 006 430 Clean reads。进一步对序列进行组装,获得 99 235个Unigene,平均长度为641.96 bp。
2.2 巴哈雀稗PnDREB2基因克隆鉴定
基于转录组测序结果设计巴哈雀稗DREB2基因CDS区扩增引物,经PCR扩增及1%琼脂糖凝胶电泳检测(图1),获得单一特异性良好的克隆片段,测序结果与转录组数据相符。
2.3 生物信息学分析
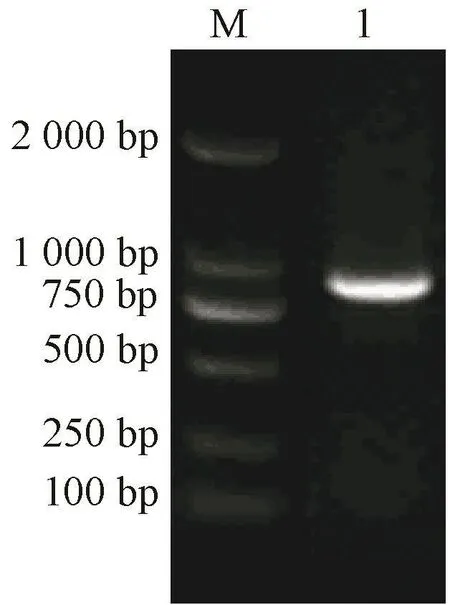
图1 PnDREB2的RT-PCR扩增Fig.1 RT-PCR amplification of PnDREB2
2.3.1PnDREB2基因及蛋白序列分析PnDREB2基因含有一个连续完整的开放阅读框,全长774 bp,编码257个氨基酸,命名为PnDREB2(登录号:MH150946)。蛋白分子式为C1210H1916N354O401S8,分子量为28.09 kD,等电点为5.25,谷氨酸(Glu)、丙氨酸(Ala)和甘氨酸(Gly)在氨基酸序列组成中出现频率较高,分别占 11.3%、10.1%和 9.7%。巴哈雀稗DREB2蛋白含有DREB基因家族典型的AP2结构域(图2)。蛋白磷酸化位点预测结果显示,巴哈雀稗DREB2蛋白共含有26个磷酸化位点,分别是13个丝氨酸(Ser)磷酸化位点、8个苏氨酸(Thr)磷酸化位点和5个酪氨酸(Tyr)磷酸化位点(图3)。疏水性分析结果表明,巴哈雀稗DREB2蛋白的稳定性系数为46.64,是不稳定蛋白;总平均亲水性为-0.694,说明蛋白质亲水区域多于疏水区域,为亲水性蛋白(图4)。由Signal P 4.1 server软件预测可知,该蛋白信号肽平均值较小,无切割位点和信号肽,属非分泌蛋白,说明该蛋白在细胞质中合成后不能被转运。巴哈雀稗DREB2蛋白亚细胞定位于细胞质中,不具有入核功能,推测其可能主要参与细胞质内各种蛋白的运输与组装。三级结构预测结果显示,巴哈雀稗DREB2蛋白含有α螺旋结构和β折叠结构,相互螺旋,分别位于氨基和羧基末端,折叠为“沟状”结构,与目的蛋白结合良好(图5)。
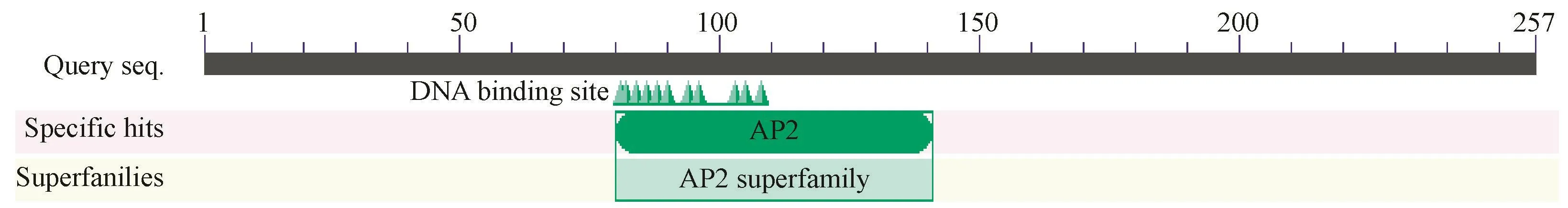
图2 PnDREB2基因保守域Fig.2 Conservative domain of PnDREB2
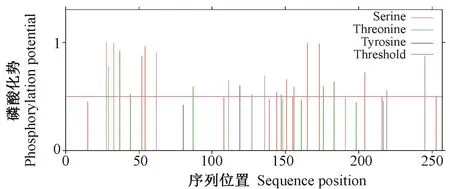
图3 巴哈雀稗DREB2蛋白氨基酸序列翻译后磷酸化修饰位点预测Fig.3 Prediction of phosphorylation site modification in amino acid sequence of Paspalm notatum DREB2 protein
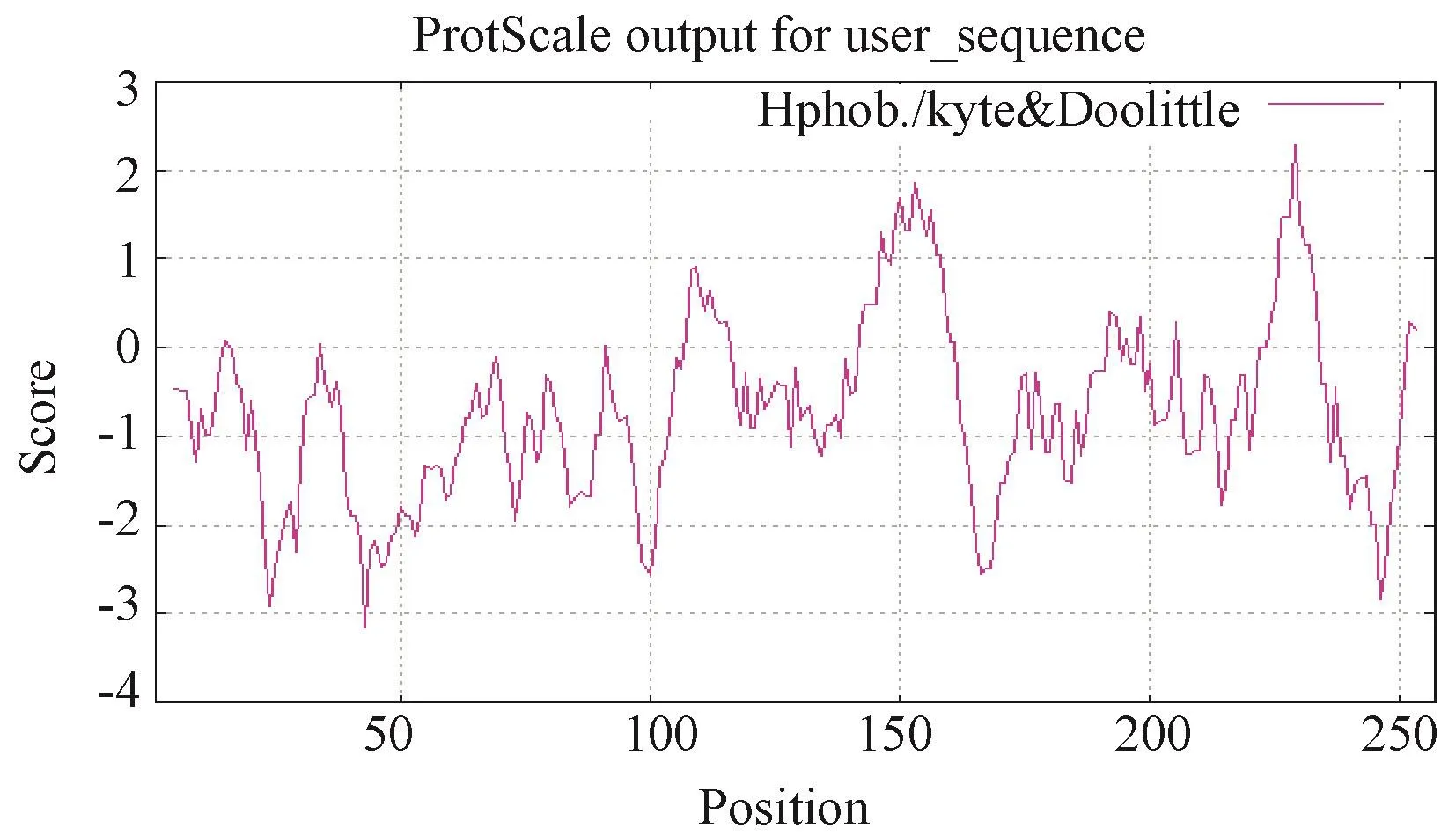
图4 巴哈雀稗DREB2蛋白的亲水性/疏水性预测Fig.4 Hydrophobicity/hydrophilicity prediction of Paspalm notatum DREB2 protein
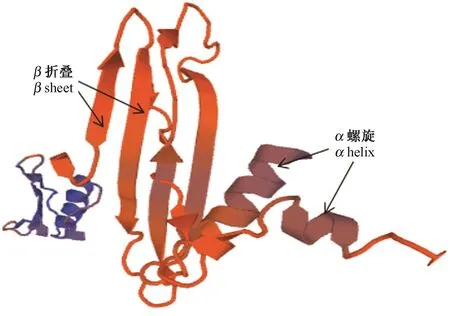
图5 巴哈雀稗DREB2蛋白质三级结构Fig.5 Tertiary structure analysis of Paspalm notatum DREB2 protein

图6 巴哈雀稗与其他物种DREB2氨基酸序列比对Fig.6 Comparison of amino acid sequences of DREB2 between Paspalum notatum and other species
2.3.2 巴哈雀稗DREB2氨基酸序列比对及构建系统进化树 将巴哈雀稗DREB2蛋白与高粱、割手密、谷子(Setaria italica)、牛鞭草(Hemarthria compressa)、玉米5个具有DREB2同源保守区的物种基因进行多序列比对,结果表明不同物种的DREB2氨基酸序列存在高度的保守区(图6)。利用MEGA5.1构建进化树发现,巴哈雀稗DREB2与高粱、割手密、谷子、牛鞭草及玉米位于同一进化分枝上,说明其亲缘关系较近,氨基酸序列相似度分别为 91.10%、89.50%、87.6%、87.6%和 88.2%(图 7),与梭梭(Haloxylon ammodendron)、拟南芥亲缘关系较远。
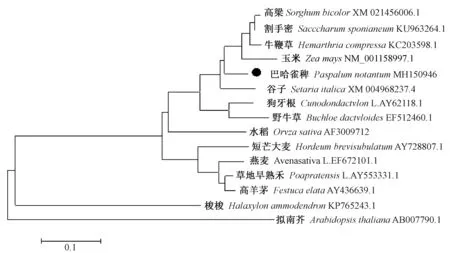
图7 巴哈雀稗PnDREB2氨基酸与其他物种的系统进化树分析Fig.7 Phylogenetic tree analysis of PnDREB2 of Paspalum notatum and other plants
2.4 PnDREB2基因在不同组织中的表达特性分析
以穗期的巴哈雀稗为材料,利用RT-qPCR技术对PnDREB2基因在巴哈雀稗中的根、茎、叶、幼穗和种子5种组织的基因表达进行分析,由图8可知,PnDREB2基因在巴哈雀稗的根、茎、叶、幼穗和种子5种组织中均有表达,但各组织的表达量差异显著,其中在茎中的表达量最高,显著高于其他组织中的表达量,在幼穗和种子中的表达量均显著高于根和叶中的表达量,且在叶中的表达量最低,显著低于其他组织。
2.5 不同胁迫处理下PnDREB2基因时序表达分析
由图9可知,在不同胁迫处理条件下PnDREB2基因均能够被诱导表达,且均随着胁迫时间的延长总体呈先升高后降低趋势,其中,在NaCl胁迫处理8 h时PnDREB2基因表达量达到峰值,较CK显著增加了315.00%,24 h与48 h时 表达量较CK分别显著降低了73.66%和73.89%;在PEG-6000胁迫处理12 h时PnDRER2表达量最高,较CK显著增加了295.00%,且其他处理时间的表达量均显著高于CK;40℃高温胁迫处理10 h时PnDREB2表达量最高,较CK显著增加了390.83%,且其他处理时间的表达量时间的表达量均显著高于CK;4℃低温处理6 h时PnDREB2表达量最高,与CK相比显著增加了298.33%,除72 h表达量与CK差异不显著外,其他处理时间的表达量均显著高于CK;ABA诱导处理10 h时PnDREB2表达量最高,较 CK显著增加了190.83%,除胁迫8 h时表达量与CK差异不显著外,其他处理时间的表达量均显著高于CK;GA诱导处理24 h时PnDREB2表达量最高,较CK显著增加了181.11%,除72 h时表达量与CK差异不显著外,其他处理时间的表达量均显著高于CK。
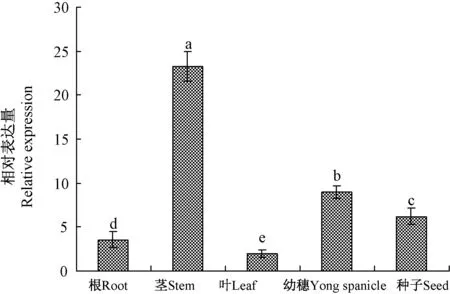
图8 PnDREB2基因在巴哈雀稗不同组织中的特性表达Fig.8 Relative expression analysis of PnDREB2 gene in different tissues of Paspalum notatum
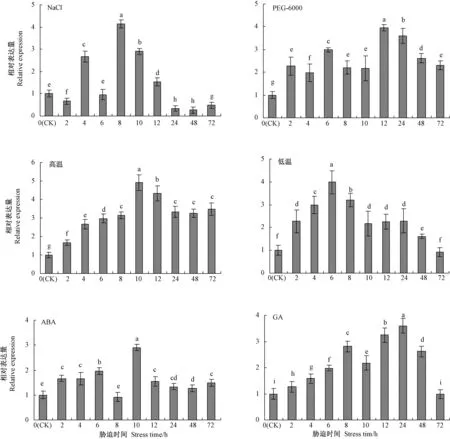
图9 PnDREB2的非生物胁迫及激素诱导差异表达Fig.9 Abiotic stresses and hormone induction of PnDREB2 differential expression profiles
3 讨论
Liu等[7]于1998年在拟南芥中首次采用酵母单杂交的方法克隆得到5个DREB类转录因子(DREB1A、DREB1B、DREB1C、DREB2A和DREB2B),并表明DREB2A在拟南芥中被干旱和高盐胁迫强烈诱导表达。近年来,大量研究表明,DREB转录因子与植物抗逆性密切相关,尤其在调节植物对非生物胁迫的防御过程中发挥着重要作用[17-19]。本研究采用RNASeq结合RT-PCR的方法,从巴哈雀稗中成功克隆得到一个DREB家族成员,命名为PnDREB2,同源性和进化树结果分析表明,PnDREB2基因的氨基酸序列与高粱、割手密、谷子、牛鞭草以及玉米中DREB2蛋白的氨基酸序列同源性较高,均在87%以上,但与梭梭、拟南芥的同源性较低,进一步证明了不同科属植物的DREB2基因存在着结构多样性。
蛋白序列结构分析表明,PnDREB2转录因子含有一个典型的AP2结构域,而且具有结构域中第14个位点是缬氨酸、第19个位点为谷氨酸的一级结构。第14、第19位氨基酸是AP2结构域中非常保守的两个位点,对于DREB类转录因子与DRE顺式作用元件的特异性结合具有十分重要的作用。另一方面,生物信息学分析显示,巴哈雀稗DREB2蛋白含有多个α螺旋和β折叠相互结构,而且亚细胞定位于细胞质中,不具有入核功能。这与肖雄[20]报道的同属禾本科的紫大麦草中DREB转录因子定位于细胞核中的研究结果并不一致。结构不同,亚细胞定位不同,预示着其生理代谢功能也存在差异[21]。根据张志飞等[22]对仅含一个AP2/ERF结构域转录因子的分类标准,结合推导的氨基酸序列,PnDREB2转录因子应属于DREB2-A2亚类中的亚型1(DREB2A-subtype 1),因此,该蛋白是一种可调控逆境应答相关基因表达的蛋白质。
Liu等[7]研究认为,在响应逆境胁迫的信号转导过程中,AtDREB2A是一类参与不依赖ABA诱导的信号转导的转录因子,能够响应干旱、高盐、低温等逆境的胁迫诱导。而本研究中的基因诱导表达测定结果显示,PnDREB2AmRNA表达水平除受干旱、高温、高盐和低温的显著诱导外,同时也受到ABA不同程度的诱导。因而可以推测,在PnDREB2A转录因子对基因的表达调控过程中,存在着不依赖于ABA诱导的信号转导和ABA依赖型表达调控2种途径。已有研究证实,ABA信号途径对DREB2A的转录调控主要表现在胁迫条件下对DREB2A启动子的调控,说明ABA依赖信号途径和非ABA依赖信号途径在植物受到胁迫时不是单独发挥作用的,在条件需要时可以协同参与调控过程[23]。此外,蛋白磷酸化位点预测结果显示,巴哈雀稗DREB2蛋白的磷酸化位点为26个,推测磷酸化也可能是PnDREB2转录后水平上的调控途径之一。蛋白磷酸化是动植物在逆境胁迫下,提高自我免疫和信号响应的一种重要的自我保护机制。磷酸化作用可以负调控蛋白质对 DNA的结合活性,磷酸化的DREB2不能结合DRE元件,而去磷酸化能够激活下游靶基因的表达[24],因此,PnDREB2转录因子通过内部的磷酸化与去磷酸化作用参与巴哈雀稗在逆境胁迫下生长应答的信号转导途径。
植物在逆境胁迫条件下,其相关转录因子的高效表达能激活多个下游基因的转录和表达,从而起到调节多个功能基因的作用[25]。魏晓玲等[26]研究表明,在干旱、高温等逆境胁迫下,DREB类转录因子能通过与逆境信号途径中下游基因启动子区域的DRE或CRT顺式作用元件结合,激活脱水基因(responsive to dehydration,RD)/冷调节基因(cold regulated,COR)类基因的表达,进而增强植物的抗逆性。本研究中,PnDREB2基因的表达量在非生物胁迫和激素诱导处理中随着处理时间的延长均表现为先增加后降低的趋势,与谢登雷等[27]对高粱的研究结果一致,说明该基因在植物生长过程中参与了逆境胁迫的信号转导途径,这与将PnDREB2基因归于DREB转录因子A2亚族的结论相符[28]。组织表达结果显示,PnDREB2基因在巴哈雀稗的茎中表达量最高,说明该基因在植物生长过程中可能与物质运输相关。吴国栋等[29]研究大豆DREB基因时发现,GmDREBc仅在根中受诱导表达;李章磊等[30]对蒙古沙冬青AmDREB2.1基因研究发现,该基因主要参与干旱胁迫应答反应,且仅在根中积极响应诱导表达;而本研究中PnDREB2基因主要在茎中强烈表达,与前人研究不一致,其原因可能是不同植物对逆境的感知及在缓解胁迫过程中的响应机制存在差异[31]。目前已有研究报道,在植物DREB的启动子区域中还分布有与光、温度、ABA、GA、茉莉酸、乙烯等相关的顺式作用元件,这些元件与对应的反式作用元件发生作用,共同调控DREB基因表达水平[32]。综上,在DREB转录因子中,不同成员间对不同逆境胁迫的应答存在差异,同时还具有组织特异性表达特征。
4 结论
本研究从巴哈雀稗中克隆获得一个的PnDREB2基因,其开放阅读框全长774 bp,可编码257个氨基酸,含 DREB基因家族典型的 AP2结构域,属于DREB2类转录因子基因A类中 A2亚类的亚型1。PnDREB2基因在根、茎、叶、幼穗和种子中均有表达,以茎中的表达量最高,表达产物定位于细胞质中,并具有26个磷酸化位点。根据生物信息学和RT-qPCR分析结果推测,PnDREB2基因参与ABA依赖信号途径和非ABA依赖信号途径的协同调控,并受到磷酸化蛋白加工水平的调控,参与高盐、干旱、高温、低温等逆境因子的非生物胁迫响应过程。本试验结果为阐明巴哈雀稗不同组织DREB类转录因子在逆境胁迫响应中的作用机理与功能提供了一定的理论依据。
