一种新型二氢吡喃并[2,3-c]吡唑类衍生物的体外抑瘤作用及机制
2019-01-08高梦诗郑敏子叶心怡施国邦阙祥洁张隆超孙漩嵘
高梦诗,郑敏子,叶心怡,施国邦,阙祥洁,张隆超,孙漩嵘
(浙江工业大学长三角绿色制药协同创新中心,浙江杭州 310014)
含氮杂环化合物具有毒性低、内吸附性高等优点,因具有类似体内生物碱(如嘌呤和嘧啶等)的结构,对靶标具有高度的专一性,常被用做医药和农药的结构组成单元。现有研究表明,含氮杂环化合物在抗肿瘤[1-2]、消炎[3-4]、抗菌[5-6]、抗病毒[7]等方面表现出良好的生物活性。目前常采用不同的修饰基团对含氮杂环化合物进行修饰,以期发现可以作为候选药物的先导化合物,促进新药开发和研究。
二氢吡喃并[2,3-c]吡唑类化合物(图1)作为一类重要的含氮杂环化合物,可作为细胞周期检查点激酶1(cell cycle checkpoint kinase 1,Chk1)抑制剂,具有潜在的抗肿瘤活性[8]。2016年,徐丽[9]将4-二甲氨基吡啶(4-dimethylaminopyridine,DMAP)催化合成得到的12个二氢吡喃并[2,3-c]吡唑衍生物对人乳腺癌细胞MCF-7进行了体外抗肿瘤实验,结果表明具有一定的抑瘤作用。
Fig.1 Structural skeleton of dihydropyran [2,3-c]pyrazole compound.
2016年,苏为科教授课题组[10]通过多组分一锅法制备得到多种新型二氢吡喃并[2,3-c]吡唑类衍生物,本研究对其中第36号衍生物(后称36号化合物,结构式见图2)的体外抑瘤作用和可能的作用机制进行探讨,旨在为进一步的结构优化和体内抗肿瘤活性研究等提供实验依据。
1 材料与方法
1.1 药品、试剂和主要仪器
36号化合物分子式为C23H22N4O,相对分子质量370.45,熔点为149~151℃。以二甲亚砜(DMSO)制备36号化合物母液(100 g·L-1),4℃保存,临用时用含10%胎牛血清和1%青-链霉素溶液的RPMI 1640培养基稀释至所需浓度。
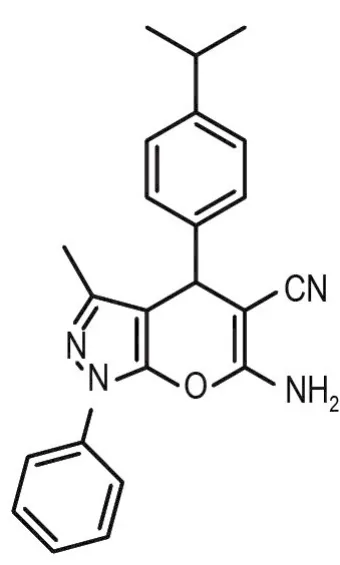
Fig.2 Molecular structure of No.36 dihydropyran[2,3-c]pyrazole derivative(No.36 Compound)
RPMI 1640培养基、0.5%胰酶细胞消化液、基因组RNA提取试剂盒(K0731)和逆转录试剂盒(K1622)购自赛默飞世尔(苏州)仪器有限公司;胎牛血清购于浙江天杭生物技术股份有限公司;磷酸缓冲盐溶液购于美国HyClone公司;四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)购自西格玛奥德里奇(上海)贸易有限公司;青-链霉素溶液购于吉诺生物医药技术有限公司;SYBR Green qPCR Mix(2×)、AnnexinⅤ-FITC细胞凋亡检测试剂盒、细胞周期与细胞凋亡检测试剂盒和JC-1线粒体膜电位(mitochondrial membrane potential,MMP)检测试剂盒购自碧云天生物技术有限公司;其余试剂均为分析纯。
倒置生物显微镜TS100-F购自尼康株式会社,BB150 CO2培养箱和Veriti 96 PCR仪购自赛默飞世尔(苏州)仪器有限公司,TGL-20000cR高速台式冷冻离心机购于上海安亭科学仪器厂,D3024高速微量离心机购自大龙兴创实验仪器(北京)有限公司,ACEA NovoCyte流式细胞仪购自艾森生物(杭州)有限公司,FlexStation多功能酶标检测仪购自美谷分子仪器(上海)有限公司,细胞培养板购于无锡耐思生物科技有限公司。
1.2 细胞培养
人乳腺癌细胞Bcap-37和MCF-7及人肺癌细胞A549均由浙江省人民医院隋梅花教授馈赠。用含10%胎牛血清和1%青-链霉素溶液的RPMI 1640培养基在37℃,5%CO2培养箱中常规培养,0.5%胰酶消化传代。本实验所用细胞均为对数生长期细胞。
1.3 MTT法检测细胞存活
上述3种细胞以每孔1×104细胞分别接种于96孔板,将细胞分为正常对照组和给药组,另设空白对照组(不含细胞),每组设3复孔,实验重复3次。待细胞生长至>50%融合度时,弃去培养基,分别加入含终浓度为0(正常对照组),1,5,12.5,25,50和100 mg·L-1的36号化合物培养液,孵育48 h,而后每孔加入MTT(5 g·L-1)10 μL,继续培养4 h后弃上清,每孔加入DMSO 150 μL,振荡至结晶完全溶解,酶标仪测定波长570 nm处的吸光度(A570nm)值。细胞存活率(%)=(给药组A570nm-空白对照组A570nm)/(正常对照组A570nm-空白对照组A570nm)×100%。根据不同浓度36号化合物作用下的细胞存活率,用SPSS 22.0进行Probit回归得其体外抑制各肿瘤细胞增殖的半数抑制浓度(IC50)。
1.4 反转录荧光定量PCR检测凋亡相关基因mRNA表达水平
将Bcap-37细胞以每孔5×105细胞接种于6孔板,分为正常对照组和给药组。分别加入终浓度为0和50 mg·L-1的36号化合物培养液,孵育48 h后,胰酶消化收集细胞。参照基因组RNA提取试剂盒说明书提取细胞总RNA,移取总RNA 1 μL并参照逆转录试剂盒操作步骤进行逆转录得到cDNA,反应条件为:25℃,5 min;45℃,60 min;70℃,5 min。严格按照PCR仪Veriti 96说明书操作,并根据SYBR Green qPCR Mix(2×)说明书进行凋亡相关基因p21,p53,Bax和NF-κB的扩增,以β肌动蛋白作为内参。设置PCR反应程序,预变性:95℃,2 min;变性:95℃,15 s;退火/延伸:60℃,30 s;共40 个循环。熔解曲线分析:95℃,15 s。每一样本同时设3复孔,输出数据为复孔Ct值的平均值,待测基因mRNA相对表达水平用2-ΔΔCt表示。引物序列见表1。

Tab.1 Sequence of primers
1.5 流式细胞术检测细胞周期
将Bcap-37细胞以每孔5×105细胞接种于6孔板,将细胞分为给药组和正常对照组,每组设2复孔,实验重复3次。根据MTT实验所得IC50,分别加入含终浓度为0和25 mg·L-1的36号化合物的培养液,孵育36 h后,胰酶消化细胞。按细胞周期与细胞凋亡检测试剂盒操作说明向细胞悬浮液中加入PI染色液,37℃避光温育30 min,于流式细胞仪上检测细胞周期,艾森NovoExpress流式软件处理得细胞周期分布图。
1.6 流式细胞术检测细胞凋亡
将Bcap-37细胞以每孔5×105细胞接种于6孔板,细胞分为正常对照组和给药组,每组设2复孔,实验重复3次。待细胞生长至>80%融合度时,分别加入终浓度为0,25和50 mg·L-1的36号化合物培养液,孵育36 h后,胰酶消化细胞。按细胞凋亡检测试剂盒操作说明向细胞悬浮液中加入AnnexinⅤ-FITC和PI染色液,室温避光孵育20 min,于流式细胞仪上检测细胞凋亡,艾森NovoExpress流式软件处理得凋亡散点图。
1.7 JC-1探针检测线粒体膜电位
将Bcap-37细胞以每孔5×105细胞接种于6孔板中,细胞分为正常对照组和给药组,另设阳性对照组〔细胞凋亡诱导剂羰基氰化物间氯苯腙(carbonyl cyanide m-chlorophenylhydrazone,CCCP),10 μmol·L-1〕,每组设3 复孔。分别加入含终浓度0,10,25和75 mg·L-136号化合物的培养液,孵育24 h后,按照JC-1 MMP检测试剂盒说明书操作。采用荧光酶标仪检测相应荧光通道的发射荧光强度值(fluorescence intensity,FI)。检测JC-1单体时,设置激发波长为485 nm,发射波长为538 nm(绿色荧光);检测JC-1聚合物时,设置激发波长为544 nm,发射波长为590 nm(红色荧光)。以FI红/FI绿比值反映线粒体膜电位的变化。
1.8 统计学分析
实验结果数据以±s表示,采用SPSS 22.0软件进行统计分析,多样本均数间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD法。以P<0.05为差异具有统计学意义。
2 结果
2.1 36号化合物对Bcap-37,MCF-7和A549细胞存活率的影响
如图3所示,36号化合物对Bcap-37,MCF-7和A549细胞存活均表现出抑制作用,且随浓度的增加,抑制细胞存活的作用增强。作用48h,抑制3种肿瘤细胞存活的IC50分别为22.4±0.8,35.7±1.2和(30.1±2.9)mg·L-1。选取存活率受36号化合物影响最大的Bcap-37细胞作为后续实验细胞,初步探索36号化合物可能的作用机制。
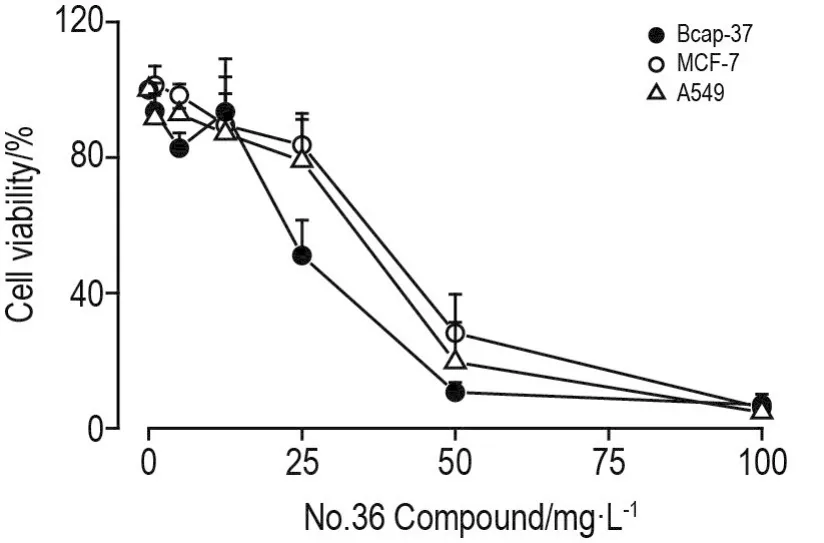
Fig.3 Effect of No.36 Compound on viability of Bcap-37,MCF-7 and A549 cells by MTT assay.Cells were treated with No.36 Compound 1,5,12.5,25,50 and 100 mg·L-1for 48 h,respectively.Cell viability(%)=(A570 nmof experimental group-A570 nmof blank group)/A570 nmof normal control group-A570 nm of blank group)×100%.±s,n=3.
2.2 36号化合物对Bcap-37细胞凋亡相关基因mRNA相对表达水平的影响
RT-PCR结果(图4)显示,与正常对照组相比,36号化合物50 mg·L-1组Bcap-3细胞凋亡相关基因p21,p53,Bax和NF-κBmRNA相对表达水平均显著提高(P<0.05,P<0.01)。
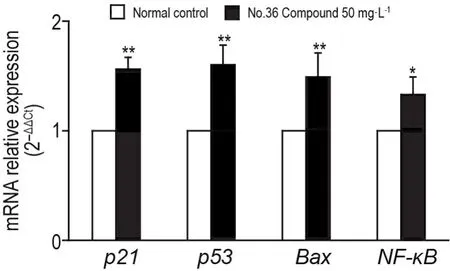
Fig.4 Effect of No.36 Compound on mRNA relative expression of apoptosis-related genes p21,p53,Bax and NF-κ B in Bcap-37 cells detected by RT-PCR.Bcap-37 cells were treated with No.36 Compound 50 mg·L-1for 36 h.±s,n=3.*P<0.05,**P<0.01,compared with normal control group.
2.3 36号化合物对Bcap-37细胞周期的影响
细胞周期检测结果(图5)表明,相对于正常对照组,36号化合物25 mg·L-1组细胞G1期比例显著增加(P<0.01),S期和G2期比例均有所下降。推测其可诱导Bcap-37细胞周期阻滞于G1期,抑制DNA合成,从而抑制细胞增殖。
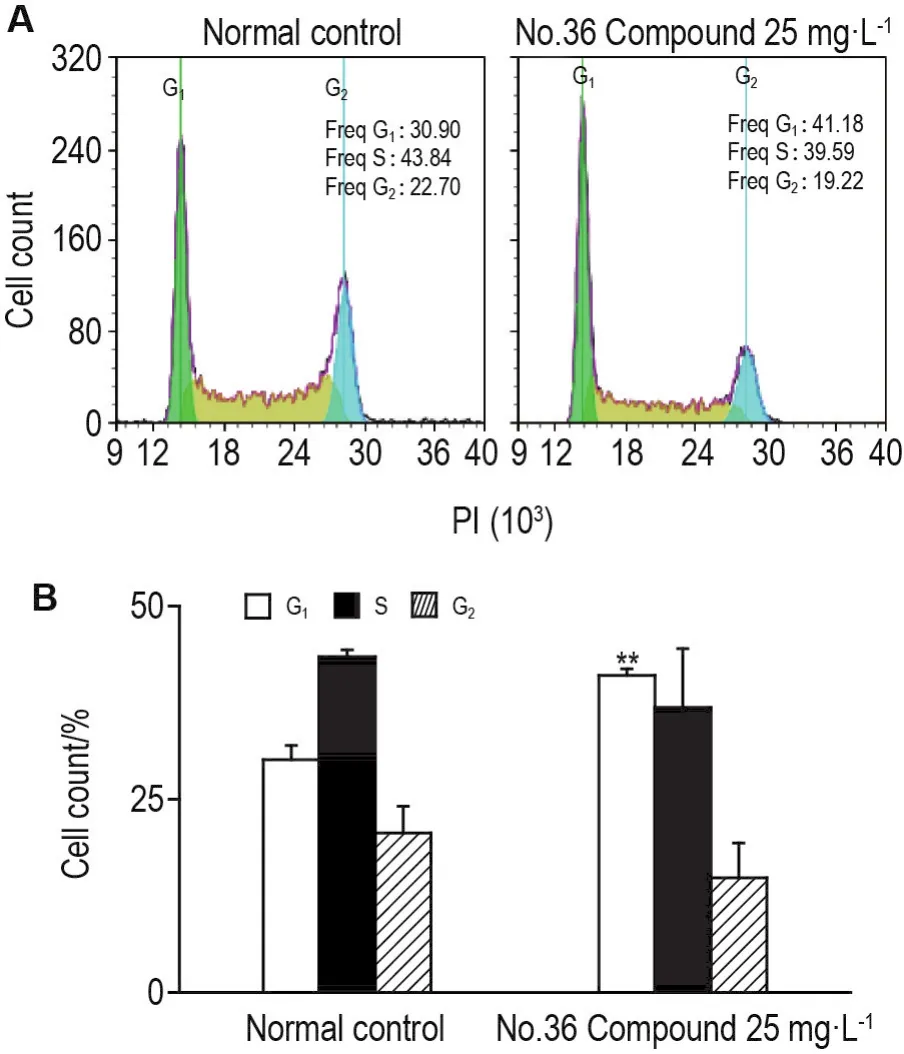
Fig.5 Effect of No.36 Compound on cell cycle of Bcap-37 cells detected by flow cytometry.Bcap-37 were treated with No.36 Compound 25 mg·L-1for 36 h.B was the semi-quan⁃titative result of A.±s,n=3.**P<0.01,compared with normal control group.
2.4 36号化合物对Bcap-37细胞凋亡的影响
图6和表2结果显示,与正常对照组相比,36号化合物25和50 mg·L-1处理细胞36 h后,各组细胞均出现明显凋亡,且随化合物浓度的增加,早期凋亡和晚期凋亡/坏死细胞比例显著增加(P<0.01)。
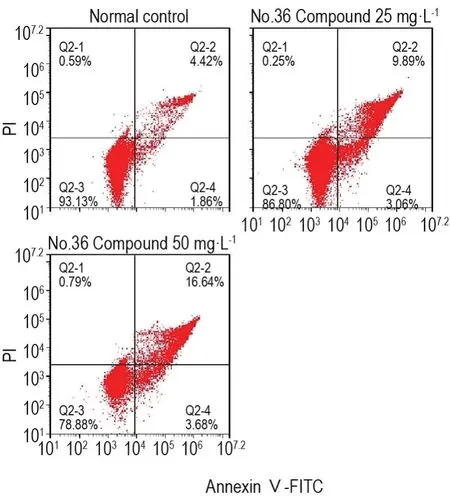
Fig.6 Effect of No.36 Compound on apoptosis of Bcap-37 cells by flow cytometry.Bcap-37 cells were treated with No.36 Compound 25 and 50 mg·L-1for 36 h.
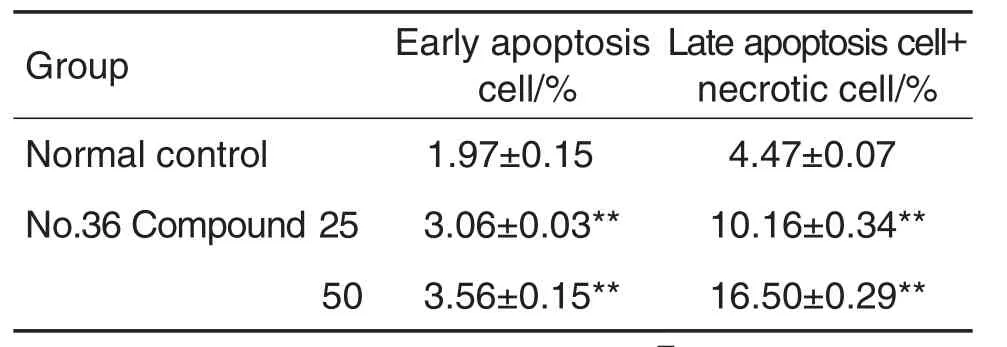
Tab.2 Effect of No.36 Compound on apoptotic propor⁃tion of Bcap-37 cells
2.5 36号化合物对Bcap-37细胞线粒体膜电位的影响
如图7所示,36号化合物10,25和75 mg·L-1处理细胞24 h后,随浓度增加,FI红/FI绿较正常对照组显著下降(P<0.05,P<0.01),提示 MMP 降低。与CCCP组相比,36号化合物75 mg·L-1组Bcap-37细胞MMP显著降低(P<0.05)。
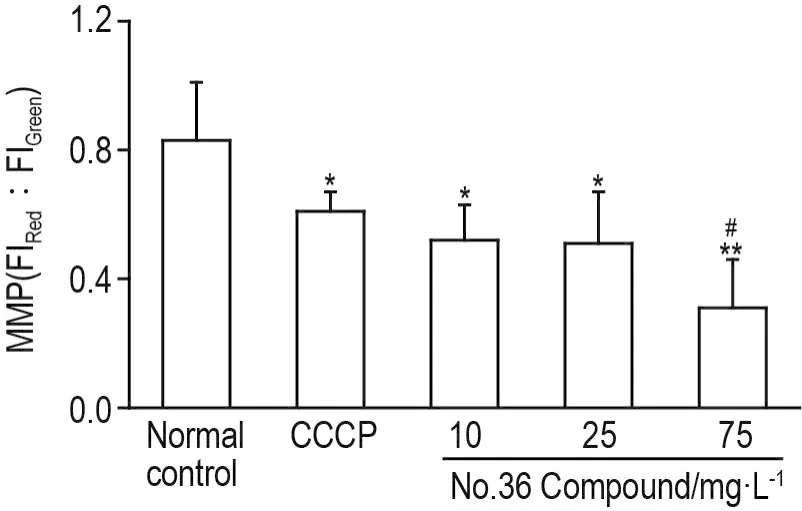
Fig.7 Effect of No.36 Compound on mitochondrial membrane potential(MMP)of Bcap-37 cells by JC-1 fluorescent probe.Bcap-37 cells were treated with No.36 Compound 10,25 and 75 mg·L-1or carbonyl cyanide m-chloro⁃phenylhydrazone(CCCP)10 μmol·L-1for 24 h,respectively.FI:fluorescence intensity.±s,n=3.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,compared with CCCP group.
3 讨论
本研究结果发现,新型二氢吡喃并[2,3-c]吡唑类衍生物——36号化合物可抑制人乳腺癌细胞Bcap-37的体外增殖,表明其具有一定的细胞毒性。p53是人体内最重要的抑癌基因之一,具有阻滞细胞周期、诱导细胞凋亡等作用[11]。其产物P53蛋白能与特异性DNA序列结合并激活转录,同时调控下游多个参与细胞周期和细胞凋亡的基因的表达[12]。Bax是Bcl-2基因家族中最主要的细胞凋亡促进基因之一,被认为是p53直接的早期应答基因[13]。Bax蛋白可与Bcl-2形成异源二聚体,起到促进细胞凋亡的作用[14]。p21基因是p53最重要的下游基因之一,细胞受损时,P53激活p21基因表达,进而降低细胞周期蛋白E(cyclin E)-周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)复合物的活性,导致成视网膜细胞瘤蛋白(retinoblasto⁃ma protein,RB)磷酸化水平降低[15-17],从而使细胞阻滞在G1期。RT-PCR结果证实,在36号化合物作用下,Bcap-37细胞中促凋亡基因p53,p21和BaxmRNA相对表达水平显著增加。而NF-κB作为一种重要的转录因子,其调控机制多样,在不同调节下可表现出抑癌或促癌作用[18-20]。研究表明,NF-κB,特别是其P65(RelA)亚基,在P53介导的凋亡信号通路中发挥着重要作用,NF-κB失活或活性降低可减弱P53诱导的凋亡[21]。本研究发现,在36号化合物作用下,Bcap-37细胞中NF-κBmRNA相对表达水平增加,起到促进细胞凋亡和抑制肿瘤生长的作用。细胞周期和凋亡检测结果进一步说明,36号化合物可阻滞Bcap-37细胞于G1期,抑制DNA合成,引起细胞早期凋亡。
Hengartner[22]认为,MMP 下降是早期凋亡的标志性事件,正常细胞中线粒体通透性转变通道(mitochondrial permeablity transition pore,mPTP)存在周期性开放以维持细胞稳态,而在凋亡阶段,mPTP过度开放导致膜间隙的正离子不断进入基质,破坏原有的离子浓度梯度,使得膜电位下降或消失,严重影响呼吸链脱偶联和ATP合成等正常生理活动,进一步促进凋亡诱导因子等的释放。促凋亡基因Bax受到凋亡刺激后可从细胞质转位到线粒体上[23],引发细胞色素c的释放,激活胱天蛋白酶级联反应[24-25],引起细胞凋亡。本研究发现,不同浓度36号化合物使Bcap-37细胞膜电位显著下降,且具有浓度依赖性;与凋亡诱导剂CCCP作用效果相比,膜电位下降明显。推测在36号化合物刺激下,Bcap-37细胞mPTP过度开放,通过细胞内线粒体途径引起细胞凋亡,该结果与流式细胞术检测细胞凋亡得到的结果相吻合,即36号化合物可诱发Bcap-37细胞早期凋亡。
综上所述,该新型二氢吡喃并[2,3-c]吡唑类衍生物对体外培养的Bcap-37细胞具有显著的抑制作用,其引起的癌细胞早期凋亡可能由细胞内线粒体通路和细胞外凋亡信号通路共同介导,具有潜在的抗肿瘤活性,可作为先导化合物进行结构优化,但该化合物的体内抑瘤作用和具体作用靶点等还有待进一步研究。
