钙蛋白酶抑制剂calpeptin对丙烯酰胺所致神经丝磷酸化及相关激酶异常表达的拮抗作用
2019-01-08苏本玉管强东于素芳
刘 宁,苏本玉,管强东,于素芳
(山东大学公共卫生学院职业与环境健康学系,山东济南 250012)
丙烯酰胺(acrylamide,ACR)广泛应用于各工业生产活动中,如化妆品制造、污水净化、油气开采、矿物洗选、染料合成、制浆造纸和防水管道内涂层等[1-3]。大量的动物实验研究结果表明,ACR具有神经毒性、致癌性、遗传毒性和生殖毒性[4-7]。相关临床资料及人群流行病学调查资料显示,神经系统中毒症状是ACR中毒的主要表现[5]。职业人群长期暴露于ACR,则发生ACR慢性中毒,以周围神经系统损伤为主,发生感觉-运动型周围神经病,表现为四肢无力、肌痛、深反射减弱或消失及手足套袜型感觉障碍[5]。ACR神经毒性的机制与细胞骨架蛋白神经丝(neurofilament,NF)磷酸化密切相关[8-9]。NF是神经元的中间丝,直径10 nm,呈柔性且缠绕紧密绳状聚合物,由3个亚基的多肽构成,高相 对 分 子质量 NF(high neurofilament,NF-H,200 ku)是NF中主要的亚基。蛋白激酶A(protein kinase A,PKA)和PKC在NF磷酸化修饰中发挥重要作用[10]。钙蛋白酶(calpain)是一种依赖钙离子(Ca2+)激活的蛋白水解酶,其作用受体主要包括蛋白激酶、磷酸酶和细胞骨架蛋白等[11]。本课题组研究表明,ACR中毒时,神经元内的Ca2+浓度升高,钙蛋白酶的蛋白活性和含量均相继升高,磷酸化的NF发生异常改变[12-14]。本研究观察钙蛋白酶抑制剂calpeptin(CP)对ACR中毒的神经干细胞(neural stem cells,NSC)PKA,PKC和磷酸化NF-H(phos⁃phorylated NF-H,p-NF-H)蛋白表达的变化,探讨CP对ACR所致NF磷酸化相关激酶表达异常的拮抗作用。
1 材料与方法
1.1 主要试剂和仪器
ACR(纯度99.9%,美国Sigma-Aldrich公司);胎牛血清(天津灏洋生物制品科技有限责任公司);DMEM/F12 1∶1细胞培养基(美国Hyclone公司);钙蛋白酶抑制剂CP和兔抗大鼠p-NF-H抗体(德国Merck Millipore公司);兔抗大鼠神经元特异性烯醇化酶(neuron specific enolase,NSE)抗体和兔抗大鼠PKA抗体(美国Abcam公司);兔抗大鼠胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体、兔抗大鼠巢蛋白(nestin)抗体、兔抗大鼠PKC抗体和FITC标记山羊抗兔IgG二抗(武汉博士德生物工程有限公司);BCATM蛋白定量试剂盒(美国Pierce Biotechnology公司);维生素A(上海晶纯生化科技公司);抗甘油醛-3-磷酸脱氢酶(GAPDH)和辣根过氧化物酶标记的山羊抗兔IgG二抗(北京中杉金桥生物科技有限公司)。
M200PRO酶标仪(瑞士Tecan集团公司);移液器(德国Eppendorf公司);Nikon ECLIPSE Ti-U奥林巴斯显微镜(日本Nikon公司);DYY-2C转移电泳仪、DYY-Ⅲ28A垂直电泳槽及DYY-Ⅲ40B转移电泳槽(浙江省宁波市新芝生物科技有限公司);Canoscan 9000F型扫描仪(日本CanoScan公司);D37520型低温超速离心机(德国Thermo公司);VORTEX-5漩涡混合器和TS-8型转移脱色摇床(中国Qilinbeier公司)。
1.2 原代细胞制备和培养
新生24 h内的Wistar乳大鼠,由山东大学动物中心提供,动物许可证号:SCXK(鲁)20130009。将乳大鼠置于75%乙醇中浸泡15 min进行麻醉消毒。用无菌眼科剪剪破其头颈部皮肤,沿脊柱方向剪开背部皮肤,充分暴露椎骨。将暴露椎体外侧隐窝中的脊髓背根神经节(dorsal root ganglion,DRG)用显微镊逐个摘取(尽量剔除DRG表面筋膜),用DMEM/F12 1∶1细胞培养基进行NSC原代培养[15]。每天在光学显微镜下观察NSC细胞生长、分裂和增殖。
1.3 原代NSC鉴定
采用免疫荧光染色法测定NSC特异性标志物巢蛋白。经维生素A诱导NSC分化后,采用免疫荧光染色法分别测定神经元特异性NSE和神经胶质细胞特异性GFAP的表达[15]。
1.4 细胞分组和处理
原代NSC培养至第4天,将其分为4组:细胞对照组(仅完全培养基)、CP组(CP 4 μmol·L-1)、ACR 染毒组(ACR 760 μmol·L-1)和 ACR+CP 组(ACR 760 μmol·L-1及 CP 4 μmol·L-1),处理时间为48 h。弃培养基,洗涤3次(去除培养液和非细胞成分),每个培养皿中加入细胞裂解液150 μL,冰上裂解30 min,刮取细胞置于EP管。
1.5 Western蛋白印迹法测定NSC中PKA,PKC和p-NF-H蛋白表达
根据目的蛋白质相对分子质量选择不同的分离胶(PKA为 40 ku,PKC 为80 ku,GAPDH 为37 ku,p-NF-H为200 ku)。相对分子质量<100 ku,选用10%分离胶;相对分子质量>100 ku,选用7.5%分离胶。PKA,PKC和p-NF-H每组蛋白质上样量分别为30,40和80 μg。在100 V恒压条件下,电泳1.5 h。将PVDF膜在甲醇中浸泡3~5 min,电泳结束后,在100 mA恒流条件下,将目的蛋白转印至PVDF膜上。转印后,将PVDF膜置于2%脱脂奶粉封闭缓冲液中封闭30 min,弃去封闭液,倒入TBST(含吐温-20的Tris缓冲液)中洗涤3次,每次5 min。将PVDF膜分别放于抗PKA,PKC,p-NF-H和GAPDH抗体溶液中(抗体稀释倍数均为1∶1500),室温放置1 h,置于冰箱中4℃孵育过夜。从一抗溶液中取出PVDF膜,置于TBST中洗涤3次,加入辣根过氧化物酶标记山羊抗兔IgG二抗,室温放置2 h。在暗室中取出PVDF膜,加入适量ECL发光液发光,使用Canoscan9000F扫描仪进行胶片扫描,将图像保存后,使用捷达凝胶分析系统分析杂交条带的积分吸光度(integrated absorbance,IA),以目标蛋白条带与内参GAPDH条带IA的比值表示目标蛋白相对表达水平[15]。
1.6 免疫荧光法观察PKA,PKC和p-NF-H在NSC的分布和表达
将各组细胞去除完全培养基,加入PBS 3 mL置于摇床上冲洗盖玻片3次,每次5 min。取出盖玻片,加入4℃预冷丙酮,置于4℃冰箱中固定20 min。弃去丙酮,取出盖玻片重新放置于12孔板中,用PBS冲洗3次。加入适量0.3%Triton X-100处理细胞20 min。PBS冲洗后,用2%BSA溶液封闭15 min。弃去BSA,滴加PKA,PKC和p-NF-H一抗(用PBS按照1∶1000比例稀释),同时用PBS作为阴性对照,置于4℃冰箱中湿盒孵育过夜。次日,取出盖玻片置于12孔板中,加入PBS冲洗3次,滴加FITC标记山羊抗兔IgG二抗(用1%BSA 1∶32稀释),37℃避光孵育45 min。用PBS冲洗后,滴加适量DAPI(4′,6-二脒基-2-苯基吲哚),染色2 min。用缓冲甘油(20%甘油+80%PBS)封片,在荧光显微镜下观察拍照[15]。
1.7 统计学分析
实验结果数据用±s表示。由SPSS 21.0软件进行统计学分析,多组比较采用方差齐性检验和单因素方差分析(one-way ANOVA),组间两两比较采用Dunnettt检验。P<0.05认为差异有统计学意义。
2 结果
2.1 原代NSC鉴定
制备的原代NSC体外培养24 h后可贴壁,贴壁后,生长旺盛,6~7 d长满100 cm2细胞培养平皿底部。图1所示为培养第1~6天的NSC,表明细胞整体生长状态良好。免疫荧光染色显示,NSC巢蛋白免疫反应阳性,且NSC纯度>90%(图2)。经维生素A诱导,该原代细胞显示NSE阳性和GFAP阳性,表明所制备的NSC具有分化为神经元和神经胶质细胞的潜能,可应用于后续实验。

Fig.1 Culture of rat primary neural stem cells(NSCs).The primary NSCs from the spinal dorsal root ganglion of Wistar rats within 24 h after birth were prepared and cultured in complete medium for 1-6 d.After being cultured for one day,the cells adhered to the culture plates.On the 3rdday(d3),the cells entered a high-speed growth period.The cells were synaptically connected and interwoven into a network lasted until d6.

Fig.2 Identification of primary cultured rat NSCs(Immu⁃nofluorescence staining).Nestin expession was positivein NSCs cultured for 48 h only with complete medium.NSCs were cultured in complete medium for 24 h followed with vitamin A 1 μmol·L-1for 7-10 d,and the homologous cells were induced to differentiate into neuron specific enolase(NSE)-positive neurons and glial fibrillary acidic protein(GFAP)-positive glial cells.
2.2 CP对ACR致NSC中PKA,PKC和p-NF-H蛋白表达水平的影响
如图3所示,与细胞对照组相比,ACR组NSC中PKA蛋白表达下降41.6%(P<0.05),PKC蛋白表达下降29.4%(P<0.05),而p-NF-H蛋白表达升高66.4%(P<0.05);CP组三者均无明显变化。与ACR组相比,ACR+CP组的PKA蛋白表达升高68.9%(P<0.05),PKC蛋白表达升高34.4%(P<0.05),而p-NF-H蛋白表达下降18.6%(P<0.05)。与CP组相比,ACR+CP组PKA,PKC和p-NF-H蛋白表达无明显变化。
2.3 CP对ACR致NSC中PKA,PKC和p-NF-H分布和表达的影响
图4和图5所示,与细胞对照组相比,CP组NSC中PKA和PKC荧光强度变化不明显;ACR组NSC数量减少,形态异常,NSC中PKA和PKC荧光强度减少且分布不均匀。与ACR组相比,ACR+CP组NSC数量增多,形态趋于正常,NSC中PKA和PKC荧光强度升高且分布均匀。与CP组相比,ACR+CP组PKA和PKC变化不明显。

Fig.3 Effect of calpeptin(CP)on protein content of protein kinase A(PKA)(A),PKC(B)and phosphory⁃lated high neurofilament(p-NF-H)(C)in primary cultured rat NSCs induced by acrylamide(ACR)detected with Western blotting.The primary NSCs were cultured for 4 d and cultured with CP 4 μmol·L-1,ACR 760 μmol·L-1or CP 4 μmol·L-1+ACR 760 μmol·L-1for another 48 h.A2,B2 and C2 was the semiquantitive results of A1,B1 and C1,respectively.IA:integrated absorbance.±s,n=10.*P<0.05,compared with cell control group;#P<0.05,compared with ACR group.
图6所示,与细胞对照组相比,CP组NSC中荧光强度相近,且p-NF-H主要分布于胞体核周部位;ACR组荧光强度增加,轴突中亦有分布。与ACR组相比,ACR+CP组荧光强度减弱,轴突中少量存在。与CP组相比,ACR+CP组荧光强度相近,轴突中亦有少量分布。

Fig.5 Effect of CP on distribution and expression of PKC in primary cultured rat NSCs induced by ACR(Immunofluorescence staining).See Fig.3 for the cell treat⁃ment.In cell control group,PKC was uniformly distributed within the NSCs(▲).In CP group,PKC was uniformly distributed within the NSCs(▲).In ACR group,the number of NSCs decreased and the morphology was abnormal.The fluorescence intensity of PKC in NSCs was decreased and unevenly distributed(■).In ACR+CP group,the number of NSCs was increased and the morphology tended to be normal.The fluorescence intensity of PKC in NSCs was increased and evenly distributed(★).
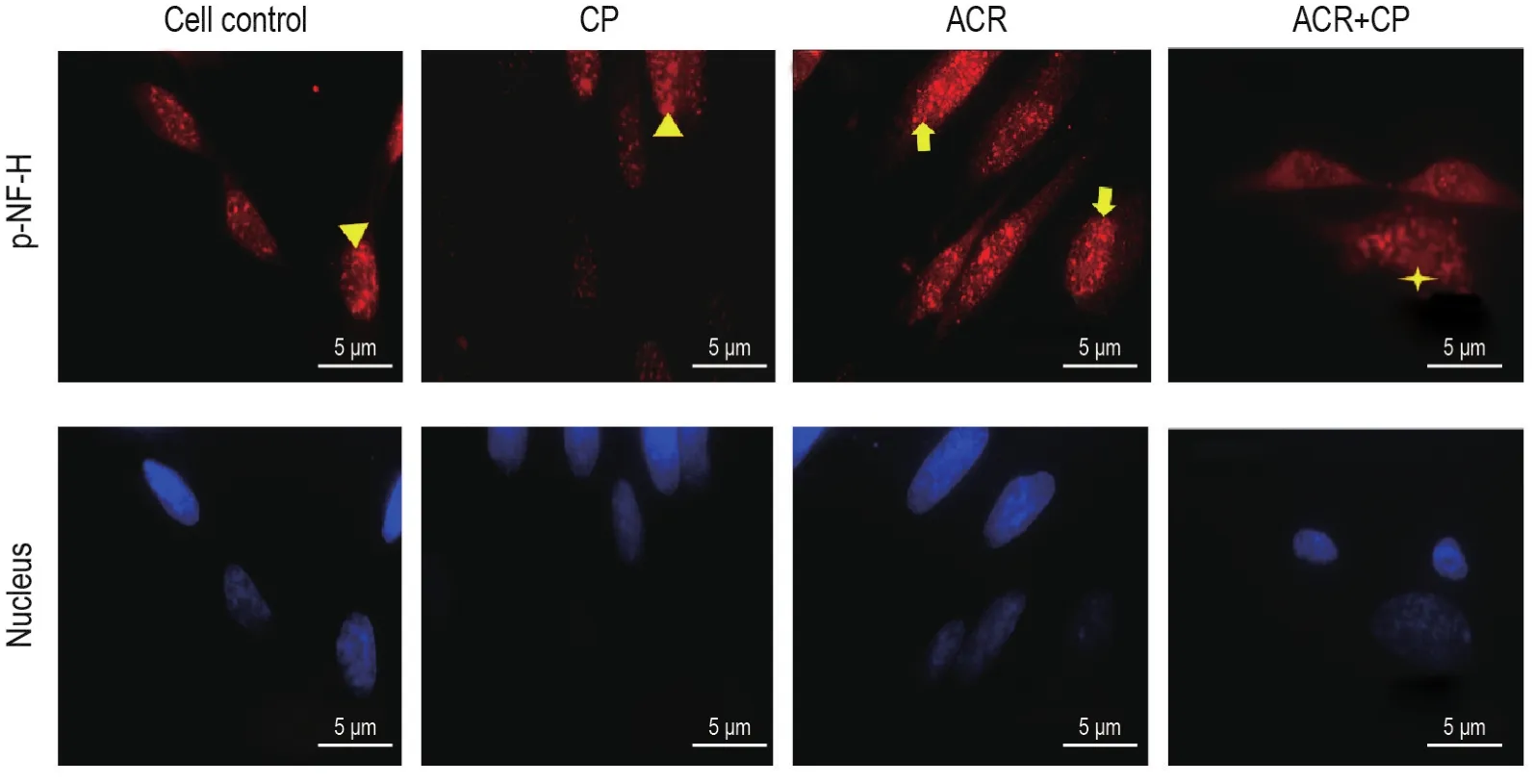
Fig.6 Effect of CP on distribution and expression of p-NF-H in primary cultured rat NSCs induced by ACR(Immuno⁃fluorescence staining).See Fig.3 for the cell treatment.In cell control group,p-NF-H was mainly distributed in the perinuclear region of the cell body within the NSCs(▲).In CP group,p-NF-H was mainly distributed in the perinuclear region of the cell body within the NSCs(▲).In ACR group,the fluorescence intensity of p-NF-H in NSCs was increased and also distributed in the axon(■).In ACR+CP group,the fluorescence intensity of p-NF-H in NSCs was decreased and present in small amounts in axons(★).
3 讨论
NSC是一种多功能干细胞,具有分化潜能,可应用于神经系统疾病发病及治疗机制研究[16]。本研究制备的大鼠原代NSC用DMEM/F12 1∶1细胞培养基培养,从第3天开始,细胞进入高速生长期,可延续至第6或第7天。因此,本研究选培养第4天的细胞进行后续实验。
据报道,未分化的NSC可特异性表达巢蛋白,并且巢蛋白的表达随着细胞的成熟呈进行性下降[17]。体外培养的NSC可诱导分化为神经元和神经胶质细胞,两者分别特异性地表达NSE和GFAP。本研究用免疫荧光染色显示,在细胞核周围,巢蛋白免疫反应阳性的细胞>90%,说明所制备的NSC纯度>90%。另经维生素A诱导后,两者均呈阳性,表明所制备的NSC具有分化潜能,此细胞可应用于后续实验。
NF的磷酸化修饰是由相关蛋白激酶及磷酸酶共同调节完成,且其磷酸化状态随NF组装、运输及解聚过程发生动态改变[18]。PKA和PKC作为多功能丝氨酸和苏氨酸激酶,并在各种神经元胞质和胞膜上有广泛存在。PKA主要是由2个基团构成,即调节亚基和催化亚基,催化亚基具有整个酶的催化活性。PKC是由Ca2+和磷脂依赖激活的蛋白激酶。PKA和PKC可作用于NF头部的磷酸化,使NF的组装能正常进行[19]。本研究结果显示,与细胞对照组相比,CP组PKA,PKC和p-NF-H蛋白表达水平并未发生显著改变,提示CP单独作用时相关激酶并无明显改变;ACR组PKA和PKC蛋白表达水平下降,p-NF-H蛋白表达水平升高,提示在ACR中毒时可能由于钙蛋白酶对PKA和PKC的水解作用加强,使NF无法进行正常的磷酸化,NF的组装发生障碍,导致p-NF-H亚基增多。与ACR组相比,ACR+CP组PKA和PKC蛋白表达水平增加,p-NF-H蛋白表达水平减少,提示CP可能通过抑制钙蛋白酶的活性,从而使PKA和PKC蛋白表达增加,使NF磷酸化并恢复组装,p-NF-H亚基减少。免疫荧光实验结果表明,PKA和PKC在细胞内分布不均匀且亮度低,可能是ACR导致钙蛋白酶的活性异常升高,从而使PKA和PKC蛋白降解所致。p-NF-H表达增加且轴突亦有分布,可能是由于PKA和PKC的异常改变导致NF的磷酸化异常,从而导致NF组装、运输及解聚发生故障,最终引起细胞骨架破坏,细胞死亡。
综上所述,在细胞水平上,ACR可导致NSC中PKA和PKC的蛋白水平降低,p-NF-H蛋白水平增加;CP对ACR导致的上述变化有拮抗作用。
