双黄连注射液对Ⅰ型超敏反应性炎症的抑制作用
2019-01-08费巧玲韩宜芯齐睿娟蔡润兰
方 蕾,费巧玲,侯 睿,高 源,韩宜芯,齐睿娟,蔡润兰,周 鸿,齐 云
(1.扬州大学医学院药学系,江苏扬州 225009;2.中国医学科学院北京协和医学院药用植物研究所,北京 100193;3.中国中医科学研究院西苑医院老年病中心,北京 100091)
Ⅰ型超敏反应是机体受到致敏原刺激后产生的一种由IgE介导的异常或病理性免疫反应,主要由致敏原结合于IgE致敏的肥大细胞形成抗原-IgEIgE Fc段受体I(FcεRI)交联而引发,造成细胞脱颗粒并释放组胺等过敏介质,引起血管通透性增加和平滑肌收缩等速发型反应。目前抗过敏药物的机制大多针对此环节,包括稳定肥大细胞膜并阻止颗粒介质释放的药物色甘酸钠和酮替芬(ketotifen),以及组胺H1受体拮抗剂氯雷他定(loratadine)等。事实上,Ⅰ型超敏反应除组胺释放等引起的早期速发相炎症反应外,还发生迟发性炎症反应,它通常是超敏反应反复发作和迁延不愈的主要病理基础[1]。通常这一过程在致敏原刺激8~12 h后发生,激活的肥大细胞持续合成、分泌炎症介质如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)和前列腺素E2(prosta⁃glandin E2,PGE2)等,这些因子促进了白细胞向炎症区域募集和持续性组织水肿。因此,抑制Ⅰ型超敏反应,不仅需要针对早期速发相炎症反应,对后期的迟发相炎症反应的控制也应给予相当的重视。
双黄连(Shuanghuanglian,SHL)制剂是《中华人民共和国药典》收录的中药复方,由黄芩、金银花和连翘的提取物组成,临床上作为抗微生物药物,以多种给药途径用于治疗细菌和病毒引起的上呼吸道感染和肺炎等。本课题组前期研究显示,SHL注射液(SHL injection,SHLI)抑制脂多糖(lipopoly⁃saccharides,LPS)诱导的急性肺损伤与其抗炎和抗氧化作用密切相关[2-3]。
除常规适应证外,SHLI也用于治疗Ⅰ型超敏反应性疾病,如支气管哮喘[4]和湿疹[5]。本课题组前期研究也发现其具有较强的稳定肥大细胞膜的作用,这一作用源于直接活化肥大细胞线粒体钙单向转运体,从而迅速降低胞质钙离子浓度[6]。结合本课题组前期发现的SHLI的抗炎作用,提示其机制可能是通过抑制P38和细胞外调节蛋白激酶的磷酸化,从而减少LPS刺激的巨噬细胞TNF-α和IL-6等炎症介质的释放[2-3]。由此推测,SHLI在Ⅰ型超敏反应中,不仅可针对速发相的脱颗粒反应,可能对迟发相时炎症介质的释放也有作用。因此,本研究测定其体外对抗虾原肌球蛋白(shrimp tropomyo⁃sin,ST)多抗血清诱导的大鼠嗜碱性粒细胞性白血病细胞RBL-2H3脱颗粒和佛波酯(phorbol 12-myristate 13-acetate,PMA)/A23187刺激的人外周血嗜碱性白血病细胞KU812分泌炎症介质的作用,并观察其体内对ST和抗ST多抗血清诱导的小鼠Ⅰ型超敏反应足肿胀的影响,以探讨SHLI对Ⅰ型超敏反应性炎症的作用。
1 材料与方法
1.1 动物、细胞、药品、试剂和主要仪器
C57/BL6J小鼠,18~20 g,购自扬州大学实验动物中心,许可证编号:SYXK(苏)2017-0044。RBL-2H3细胞和KU812细胞购自中国科学院上海生命科学研究院细胞资源中心。SHLI(黑龙江多多药业有限公司,13093013),酮替芬(上海梯希爱化成工业发展有限公司),MEM和IMDM培养基(美国Gibco公司),胎牛血清(fetal bovine serum,FBS,中国Excell Bio公司),4-甲基伞型酮-β-D-乙酰氨基葡萄糖苷、PMA和 A23187(美国Sigma公司),人TNF-α和IL-6 ELISA试剂盒(美国Biolegend公司),PGE2ELISA试剂盒(瑞士Enzo Life Science公司)。
荧光化学发光分析仪(美国Thermo Electron公司),Napco 5410型二氧化碳孵箱(美国NAPCO),XDS-1B倒置显微镜(重庆光电仪器公司),BCN-1360型超净工作台(北京东联哈尔仪器制造有限公司),Multiskan Ascent酶标仪(美国Thermo Electron公司),小鼠足容积测定仪(自制,精确度0.01 mL)。
1.2 小鼠抗ST多抗血清的制备
参照文献[7],提取刀额新对虾ST,每只小鼠ip给予20 μg含铝佐剂的ST,每周1次,连续6周。于6周末摘眼球取血,分离小鼠血清。
1.3 SHLI细胞毒性的测定
参照前期研究中SHLI的体外实验浓度[2],采用MTS法[8]检测0.5%~2%SHLI对RBL-2H3细胞和KU812细胞24 h细胞毒性。2种细胞分别按每孔5×104和2.5×104细胞接种于96孔板,分别加入终浓度为 0.5%~2%的 SHLI,孵育 21 h。加入 20 μL MTS/PMS混合液后继续孵育3 h。用酶标仪在波长492 nm处测定吸光度值(A492nm),计算细胞存活率,以选择SHLI用于后续实验的安全浓度。细胞存活率(%)=药物组A492nm/细胞对照组A492nm×100%。
1.4 抗ST多抗血清和ST诱导的RBL-2H3细胞 β-氨基己糖苷酶( β-hexosaminidase, β-HEX)释放的测定
参照文献[9]常规培养RBL-2H3细胞,待至对数生长期,胰酶消化后按每孔1×105细胞接种于48孔细胞培养板。贴壁后,除正常对照孔外,其余孔则分别加入抗ST多抗血清(终浓度2%),孵育过夜。次日弃上清,用Hank液洗细胞,加入阳性药物酮替芬48 μmol·L-1(终浓度)或SHLI 0.5%~2%(终浓度),与细胞共孵育30 min。加入ST 20 μg·L-1(终浓度),37℃孵育1.5 h。取上清20 μL,加入反应底物4-甲基伞型酮-β-D-乙酰氨基葡萄糖苷溶液(1 mmol·L-1)50 μL,25℃孵育 2 h,加甘氨酸终止液,在荧光化学发光分析仪λEX355 nm和λEM460 nm处测定荧光强度,以反映β-HEX相对释放量。
1.5 PMA/A23187诱导的KU812细胞分泌TNF- α,IL-6和PGE2水平的测定[10]
KU812细胞以IMDM完全培养基(含10%FBS,青霉素100 kU·L-1,链霉素100 mg·L-1和L-谷氨酰胺 2 mmol·L-1)常规培养,待至对数生长期,按每孔1×106细胞接种于6孔细胞培养板。先用不同浓度的SHLI(终浓度0.5%,1.0%或2.0%)分别预处理细胞30 min,然后加入终浓度1 μmol·L-1的A23187和40 nmol·L-1的PMA;正常对照孔以完全培养基代替SHLI和PMA/A23187;模型孔只加PMA/A23187,不加SHLI。于37℃细胞培养箱中孵育6 h取上清,采用ELISA法测定TNF-α和IL-6含量,24 h后测上清PGE2含量。
1.6 抗ST多抗血清和ST诱导的小鼠Ⅰ型超敏反应足肿胀时效关系测定
参照文献[11],采用毛细管放大测量法制备足容积测定仪,精确度0.01 mL。C57/BL6J小鼠10只,将抗ST多抗血清以生理盐水1∶10稀释,于小鼠右侧足跖皮下注射血清30 μL进行致敏。24 h后,于激发前测定小鼠右侧足跖容积(V),然后经小鼠尾静脉注射含ST 50 μg的生理盐水,再分别于1,12,24和72 h测定足容积,观察小鼠足容积随时间的变化。以对侧足为对照拍照。
1.7 动物分组、给药和Ⅰ型超敏反应足肿胀模型的制备
C57/BL6J小鼠40只,随机分为模型组、阳性药物组(酮替芬 20 mg·kg-1)和 SHLI组(2.5和5.0 mL·kg-1),每组10只。小鼠给药、模型诱导和测定时间点如图1所示。第1天(D1)~D3,SHLI组小鼠ip给予SHLI,酮替芬组ip给予酮替芬,模型组则ip等体积生理盐水,于抗原攻击前连续给药3 d。D2:在给药1 h后,右侧足跖皮下注射稀释的抗ST多抗血清。D3:各组小鼠给药处理同D1,并测定小鼠右侧足跖容积V。给药1 h后,每只小鼠尾静脉注射含ST的生理盐水,再分别于1和24 h后测右侧足容积(V1h和V24h),并计算与V比较后的足容积差。
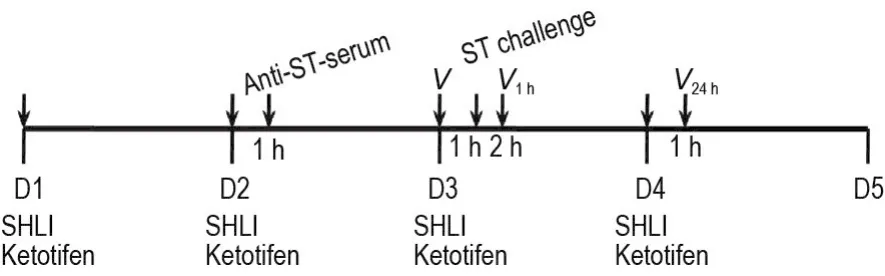
Fig.1 Schedule of treatment with Shuanghuanglian injection(SHLI)and passive cutaneous anaphylaxis in mice induced by shrimp tropomyosin(ST).D1:the 1stday.
1.8 统计学分析
实验结果数据用±s表示,多组之间比较采用单因素方差分析,两组间比较采用Studentt检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 SHLI对RBL-2H3和KU812细胞存活率的影响
如图2所示,0.5%~2.0%SHLI组细胞存活率与RBL-2H3细胞和KU812细胞对照组比较无明显差异,表明SHLI无明显细胞毒性。
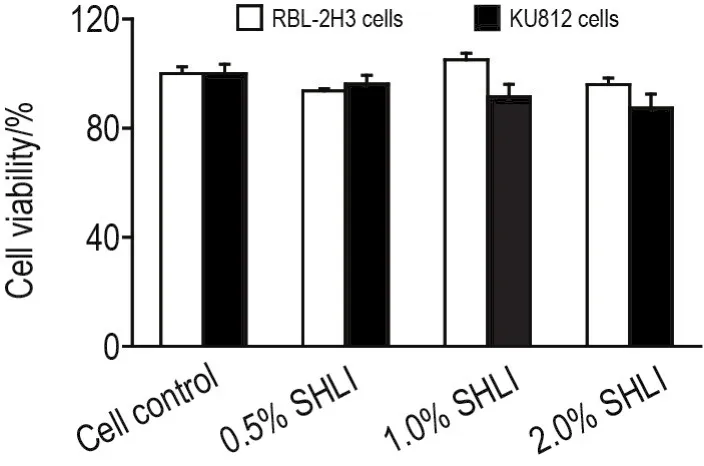
Fig.2 Effect of SHLI on cell viability of RBL-2H3 and KU812 cells.The cells were incubated with SHLI for 24 h and the cell viability was evaluated by MTS assay.Cell viability(%)=A492 nmof SHLI group/A492 nmof cell control group×100%.,n=3.
2.2 SHLI对抗ST多抗血清和ST诱导的RBL-2H3细胞 β-HEX释放的影响
图3所示,与细胞对照组比较,ST攻击抗ST多抗血清诱导的RBL-2H3细胞发生脱颗粒,胞外β-HEX含量增加(P<0.01);与模型组比较,0.5%,1.0%和2.0%SHLI均明显抑制ST攻击致敏的RBL-2H3细胞β-HEX的释放,荧光强度分别下降16%,31%和51%(P<0.01)。

Fig.3 Effect of SHLI on β-hexosaminidase( β-HEX)release in RBL-2H3 cells induced by anti-ST-serum and ST.After being sensitized overnight with 2%anti-ST-serum,RBL-2H3 cells were pretreated with SHLI(0.5%,1.0%or 2.0%)for 30 min and then stimulated with ST(20 μg·L-1).The β-HEX release was determined at 2 h.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with model group.
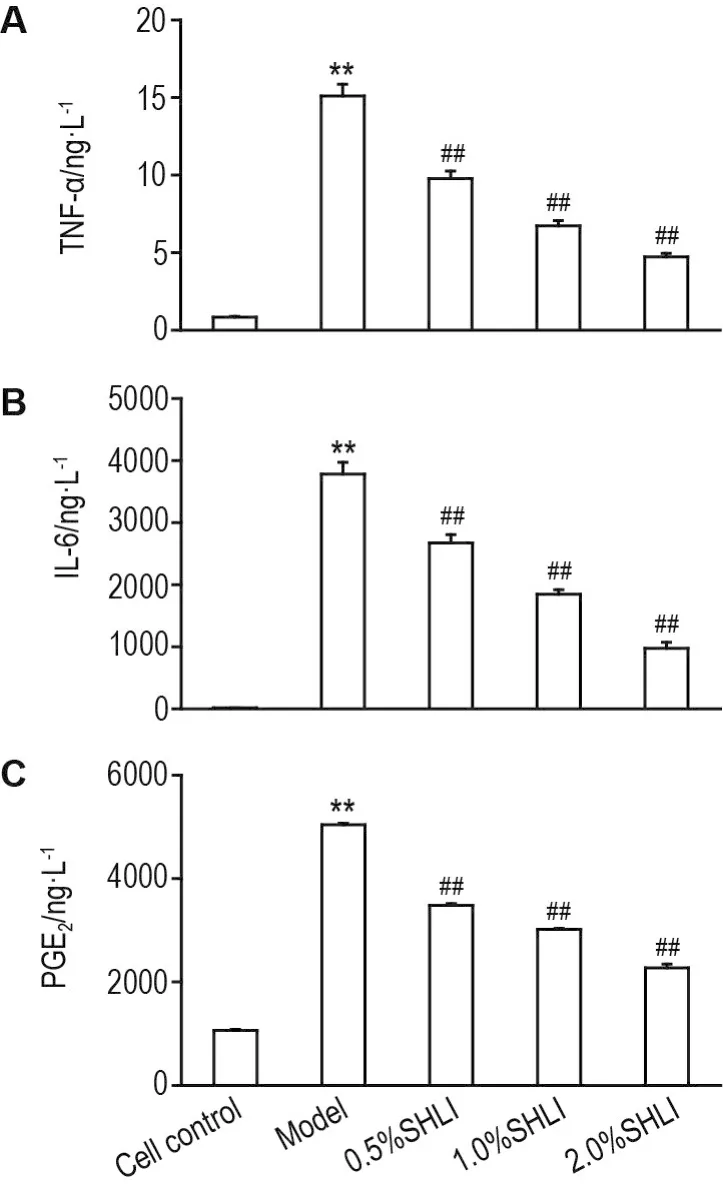
Fig.4 Effect of SHLI on production of tumor necrosis factor- α(TNF- α)(A),interleukin-6(IL-6)(B)and prostaglandin E2(PGE2)(C) in phorbol 12-myristate 13-acetate(PMA)/A23187-induced KU812 cells.KU812 cells were pretreated with SHLI for 30 min and then stimulated with A23187(1 μmol·L-1)plus PMA(40 nmol·L-1)for 6 h(TNF-α and IL-6)or 24 h(PGE2).Cytokines in the cell supernatant were assayed by ELISA.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with model group.
2.3 SHLI对PMA/A23187诱导的KU812细胞分泌TNF- α,IL-6和PGE2的影响
如图4所示,在PMA/A23187刺激的KU812模型中,细胞上清中TNF-α,IL-6和PGE2含量明显升高(P<0.01),而0.5%,1.0%和2.0%SHLI可抑制上述3种细胞因子的分泌,其中TNF-α分别降低35%,55%和69%(P<0.01),IL-6分别降低29%,51%和74%(P<0.01),PGE2分别降低31%,40%和54%(P<0.01)。
2.4 抗ST多抗血清和ST诱导的小鼠Ⅰ型超敏反应足肿胀时效关系
如图5所示,ST攻击抗ST多抗血清致敏的小鼠足跖后1 h足容积和容积差显著增加,12 h回落,24 h再继续升高,呈现速发相1 h和迟发相24 h两高峰。因此,本研究在后续药物实验中,选择1 h作为速发相时间点,24 h作为迟发相时间点。

Fig.5 Paw swelling of mice induced by anti-ST-serum and ST.The 10%anti-ST-serum was subcutaneously injected into the mouse right paw and 50 μg ST was iv given to the mice 24 h later.The paw volume(A)and volume change(B)were measured at each time after ST challenge.x ± s,n=10. **P<0.01,compared with corresponding group at 0 h.
2.5 SHLI对抗ST多抗血清和ST诱导的小鼠Ⅰ型超敏反应足肿胀的影响
如图6A和B所示,尾静脉注射ST激发1 h和24 h后,与左足比较,模型组右足可观察到明显的足部肿胀,SHLI给药组足肿胀呈现不同程度的减轻。测定足容积发现(图6C和D),SHLI组小鼠足容积和足容积差均显著减小,速发相(抗原攻击1 h)时2.5和5.0 mL·kg-1SHLI组足容积差分别降低69%和83%(P<0.01),迟发相(抗原攻击24 h)时则分别降低70%和100%(P<0.05,P<0.01),表明SHLI对抗ST多抗血清和ST诱导的小鼠Ⅰ型超敏反应速发相和迟发相足肿胀均具有明显的抑制作用。
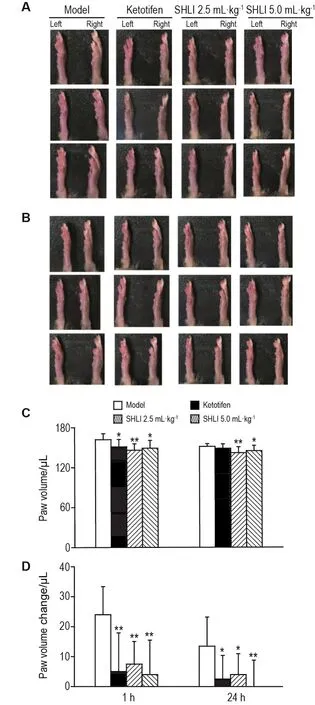
Fig.6 Effect of SHLI on paw swelling of mice induced by anti-ST-serum and ST 1 h and 24 h after ST chal⁃lenge.See Fig.1 and Fig.5 for the mouse treatment.SHLI and ketotifen was ip given for 3 d,respectively.A:paw swelling 1 h after ST challenge;B:paw sewelling 24 h after ST challenge;C:paw volume;D:paw volume change.±s,n=10.*P<0.05,**P<0.01 ,compared with model group at the same time.
3 讨论
临床常见的Ⅰ型超敏反应性疾病如哮喘和食物过敏均涉及肥大细胞或嗜碱性粒细胞介导的炎症反应。这些细胞在被抗原触发产生由IgE介导的即时效应外,持续活化时分泌白三烯、TNF-α、PG和IL-6等炎症介质,具有促进嗜酸性粒细胞迁移浸润、上调内皮和上皮细胞黏附分子的表达、增加气道反应性及促进单核细胞基质金属蛋白酶9释放和成纤维细胞增生而参与组织重塑等作用[12],对Ⅰ型超敏反应性疾病的发生和发展发挥重要作用。Ⅰ型超敏反应的速发相和迟发相,均因IgE介导肥大细胞活化所致。速发相归咎于肥大细胞脱颗粒,而迟发相需要启动相关因子的转录和翻译。从理论上讲,采用IgE介导的RBL-2H3细胞模型既可测定早期的β-HEX,也可测定后期迟发相反应所分泌的TNF-α,IL-6及PGE2等因子。但实际上,抗原刺激IgE致敏的RBL-2H3细胞诱导的迟发相反应并不明显。以钙离子载体A23187和蛋白激酶C活化剂PMA协同活化KU812细胞,模拟的是迟发相的炎症反应。本研究发现,SHLI除可以降低IgE介导的RBL-2H3细胞脱颗粒外,还抑制PMA/A23187诱导的KU812细胞分泌炎症介质PGE2,TNF-α和IL-6,提示SHLI不仅抑制Ⅰ型超敏反应速发相反应,对迟发相炎症可能也有对抗作用。为此,本研究采用体内模型对此作用予以确认。
目前,抗Ⅰ型超敏反应药物评价通常采用的致敏动物血清诱导的被动皮肤过敏实验(passive cuta⁃neous anaphylaxis,PCA)仅适用于速发相反应的测定。该法多采用抗卵清蛋白(ovalbumin,OVA)动物血清诱导PCA,将多抗血清皮内注射于同种或异种动物的局部皮肤进行致敏,以伊文思蓝为指示剂测定OVA激发1 h后局部皮肤蓝斑直径或萃取染料测定其吸光度[13],然而该法并不能测定迟发相炎症反应。另有研究者在皮肤超敏反应模型中对迟发相进行了测定,将2,4-二硝基苯酚IgE单克隆抗体经尾静脉注射于小鼠,24 h后在两耳涂以2,4-二硝基氟苯,采用测厚仪测定小鼠双耳的肿胀度,以1和24 h耳厚度分别作为衡量速发相和迟发相反应程度的指标[14]。但是由于小鼠耳部皮肤薄,对仪器的精密度要求高,而常规的测厚仪主观性较强,误差大(测定厚度的差值以μm为单位),并非一种适合常规实验室开展的准确性和重复性好的测定方法。因此,本研究进行了方法学改进并建立了更适用于评价Ⅰ型超敏反应迟发相炎症的体内模型。
由于不同品系小鼠对抗原的敏感性有差异,常用的有C57/BL6J小鼠、BALB/c小鼠、129Sv小鼠和A/J小鼠等,其中C57/BL6J小鼠对牛奶、虾和花生等抗原的敏感性较好[15]。因此,本研究选择了该品系小鼠以诱导模型。根据PCA原理,采用致敏动物血清皮下注射于小鼠足跖部,24 h经尾静脉给予ST激发诱导足肿胀;然后采用经典的急性炎症模型(角叉菜胶致小鼠足肿胀)中毛细管放大测量法[11]测定小鼠足容积,以足容积变化的时效曲线来反映Ⅰ型超敏反应速发相和迟发相的炎症。由于前期研究发现,ST 致敏性[9]和代表性[16]高于传统抗原OVA,所以本研究用ST作为致敏原免疫小鼠[7],获得了富含IgE的小鼠血清,而且体内实验仍采用ST为抗原进行实验。结果显示,ST攻击ST多抗血清致敏的小鼠足跖后1 h足容积增加,12 h时回落,24 h再继续升高,呈现速发相1 h和迟发相24 h两高峰,与刘继勇等[14]测定皮肤超敏反应耳厚度的变化趋势较一致。
本研究利用以上体内模型观察了SHLI对Ⅰ型超敏反应两相反应的作用。结果显示,在速发相(ST激发后1 h),SHLI可抑制抗ST多抗血清和ST诱导的小鼠足肿胀。阳性药物酮替芬具有拮抗组胺H1受体和稳定肥大细胞膜的作用,能够明显抑制Ⅰ型超敏反应速发相,本结果与此符合。对于迟发相(ST激发后24 h),SHLI亦可抑制小鼠Ⅰ型超敏反应迟发相足肿胀。据报道,酮替芬通过抑制趋化而减少超敏反应炎症部位嗜酸性粒细胞的浸润及其炎症介质释放[17],还可以降低OVA诱导的过敏性鼻炎小鼠血清中细胞因子TNF-α和IL-1β含量[18],表明其还具有抑制超敏反应性炎症的作用。本研究观察到酮替芬对ST多抗血清诱导的小鼠迟发相足肿胀的抑制作用与此作用一致。综上所述,SHLI具有抗Ⅰ型超敏反应全程的作用,不仅可抑制速发相脱颗粒,还可通过减少炎症介质的分泌来抑制迟发相炎症反应。
值得关注的是,据临床报道,SHLI有致速发型过敏反应的不良反应[19-20],似乎与本研究SHLI抗过敏作用相矛盾。事实上,本课题组正是在研究SHLI致过敏的不良反应过程中发现其对肥大细胞脱颗粒具有良好的抑制作用[6,21]。药物被机体作为异物识别而发生过敏反应与其可治疗过敏性疾病二者之间并不矛盾。正如作为抗过敏的一线药物酮替芬,其使用注意事项中也明确提出“对本品过敏症禁用”。需要说明的是,SHLI通过线粒体钙单向转运体活化发挥其强大的肥大细胞稳定作用[6]给其致过敏的研究带来了困难。在研究设计SHLI致敏性实验时,需要排除前者的干扰,这是研究过程中必须注意的。
