组织型纤溶酶原激活剂治疗急性缺血性脑卒中的作用机制及临床应用
2019-01-08郑斯莉缪朝玉
郑斯莉,缪朝玉
(第二军医大学药理学教研室,上海 200433)
脑组织代谢率高而能量储备低,充足的脑血流对脑部氧和营养物质的维持至关重要。当脑局部血流突然中断(主要由脑血管血栓栓塞造成),急性缺血性脑卒中(acute ischemic stroke,AIS)随即发生,缺血部位的脑组织很快发生不可逆性损伤,引起致残、致死的严重后果。AIS治疗的关键是要早期、快速、有效地实现血管再通,从而拯救缺血但尚未梗死的脑组织。
组织型纤溶酶原激活剂(tissue-type plasminogen activator,tPA)在血液纤溶系统中具有激活的重要纤溶酶原激活作用,其重组蛋白阿替普酶(alteplase)是美国食品药品监督管理局(Food and Drug Admin⁃istration,FDA)于1996年批准的首个(也是迄今唯一获批的)用于治疗AIS的溶栓药物,与人天然tPA无差别,其对AIS致死率和致残率的改善作用得到国际公认,因此tPA几乎成为“溶栓剂”的同名词。本文针对tPA治疗AIS的作用及其机制,综述tPA的分子特点和临床应用等研究进展。
1 内源性tPA的来源和功能
1947年,tPA最初发现于动物组织中,当时人们只知道其可激活纤溶酶原,因此最初也称其为纤溶酶原激酶。之后发现,其可从多种组织中提取纯化获得,且与另一种内源性纤溶酶原激活剂尿激酶不同的是,tPA对纤维蛋白具有高度亲和力,可在血块表面高效激活纤溶酶原[1-3]。
现已知,tPA表达于全身多种器官组织。基础生理条件下,tPA主要由内皮细胞合成并分泌入血,与其生理抑制剂纤溶酶原激活剂抑制剂1(plas⁃minogen activator inhibitor-1,PAI-1)以复合物的形式存在于血液循环[2,4-7]。tPA还储存于内皮细胞、神经内分泌细胞和肾上腺嗜铬细胞,并在受到细胞外刺激时被释放[8-11]。血管作用物质如凝血酶、组胺、类固醇激素和维生素A酸类都可以刺激tPA的合成和释放[12-13]。在肾上腺素水平升高的情形下,如运动和应激时,可观察到tPA浓度升高[7,14]。体内 tPA 在血浆中的浓度为 5~10 μg·L-1,且在不同生理病理状态下其浓度波动很大[2]。
tPA参与了多种生理病理过程,其在血管系统中的纤溶酶原激活作用是tPA最重要且最为人所知的生理功能,也是tPA治疗AIS的理论基础。其次,tPA还促进血管发生。另外,在中枢神经系统,tPA促进突触形成和神经迁移,同时又与谷氨酸诱导的神经毒性和血脑屏障的破坏等相关;在外周神经系统,tPA参与交感神经功能。tPA还有助于减少术后腹膜黏连形成等[15]。
2 tPA的溶栓机制
在血管纤溶系统溶栓的过程中,最重要的步骤是纤溶酶将高分子纤维蛋白裂解成可溶性的低分子质量产物。正常生理状态下,纤溶酶在循环血液中含量极低,但在纤溶酶原被纤溶酶原激活剂活化后可于局部形成大量纤溶酶。tPA是血管纤溶系统中最重要的纤溶酶原激活剂。如图1所示,tPA在正常血液循环中对纤溶酶原的激活作用微弱,溶栓过程中,tPA结合到血栓后其活性大增,可在血栓表面高效率地将纤溶酶原的Arg561-Val562肽键水解,使纤溶酶原激活变为纤溶酶[4,16-17]。
基于tPA的重要溶栓价值,人们对其溶栓性质和结构功能进行了深入研究。
2.1 tPA的单链分子结构
细胞新合成的tPA蛋白含562个氨基酸,其在细胞内经过剪切氨基端信号肽序列等形成成熟的tPA单链糖蛋白分子被分泌到细胞外[16]。如图2所示,tPA单链分子长527个氨基酸,分子质量约为70 ku,含17个二硫键、1个游离巯基(Cys83)、3个N 糖基化位点(Asn117,Asn184,Asn448)和1个O糖基化位点(Thr61)。包含如下结构域:①F区(第4~50位氨基酸,与纤连蛋白的Finger结构同源);②E区(第51~87位氨基酸,与表皮生长因子结构同源);③2个K区(K1区,第88~176位氨基酸;K2区,第177~256位氨基酸。K区与纤溶酶原的Kringle结构同源);④P区(第276~527位氨基酸,与其他丝氨酸蛋白酶的催化区同源),含活性位点 His322,Asp371和Ser478。通过设计合成tPA变异体,发现tPA上述结构域与其功能有关,如F区和K2区与tPA结合到纤维蛋白有关,tPA在体内快速清除与F区或E区及糖侧链有关,tPA酶活性与P区有关。而且序列Lys296-His-Arg-Arg299是tPA被其生理抑制剂PAI-1快速抑制失活所必需,第416位氨基酸在维持tPA单链活性方面具有重要作用[1-3,18-23]。
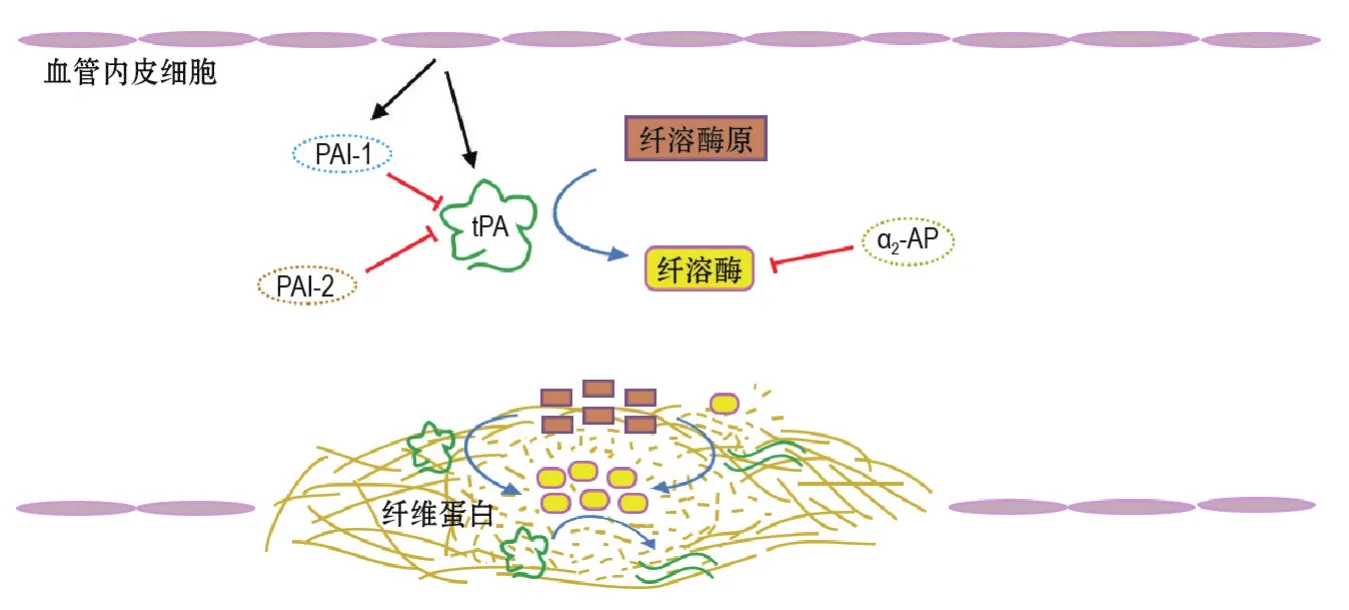
图1 组织型纤溶酶原激活剂(tPA)的溶栓机制.由血管内皮细胞分泌的tPA在血液循环中对纤溶酶原的激活作用微弱,其活性主要受到其生理抑制剂——纤溶酶原激活剂抑制剂1(PAI-1)和PAI-2抑制.当血管损伤时,tPA结合到血栓表面,其激活纤溶酶原生成纤溶酶的活性大增.纤溶酶一方面将单链tPA裂解成活性更高的双链tPA,进一步激活纤溶酶原生成更多的纤溶酶;另一方面,纤溶酶将血栓中的高分子纤维蛋白裂解成可溶性的低分子质量产物,最终引起整个血栓的连续溶解.α2-AP:α2-抗纤溶酶.
2.2 tPA分子的变构
在纤溶酶的作用下,tPA单链分子的敏感肽键Arg275-Ile276很容易被水解,单链随即断裂成2条链形式,形成双链tPA。双链分子的A链(又称H链或重链,1~275位氨基酸)位于分子N端,B链(又称L链或轻链,276~527位氨基酸)位于分子C端,2条链之间由1个二硫键连接。其中A链为tPA与纤维蛋白结合所必须;B链包含活性位点,对底物纤溶酶原具有高度特异性的活化作用[24]。电镜下tPA单链和双链的形状很难分辨,它们都是相对紧致的椭圆形,其长轴和短轴分别约为13 nm和10 nm,几个功能区极小并折叠在分子内部,分子整体看起来类似球状[25]。
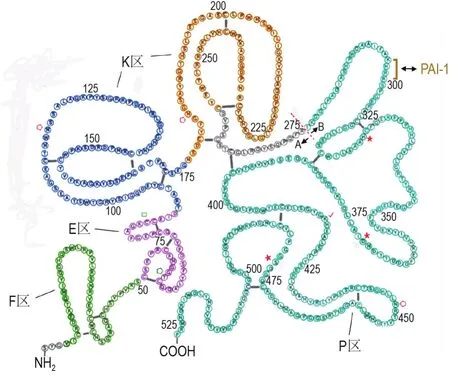
图2 tPA单链分子一级结构示意图.tPA单链分子长527个氨基酸(以氨基酸单字母缩写表示),含17个二硫键(—表示)、1个游离巯基(Cys83,以□表示)、3个N糖基化位点(Asn117,Asn184,Asn448,均以表示)和1个O糖基化位点(Thr61,以表示).包含F区(第4~50位氨基酸)、E区(第51~87位氨基酸)、2个K区(K1区,第88~176位氨基酸;K2区,第177~256位氨基酸)和P区(第276~527位氨基酸).存在3个活性位点(His322,Asp371,Ser478,均以★表示).序列Lys296-His-Arg-Arg299为tPA被其生理抑制剂PAI-1快速抑制失活所必需,第416位氨基酸(以√表示)在维持tPA单链活性方面具有重要作用.
2.3 tPA的低变构活化程度
tPA属于非典型的糜蛋白酶家族丝氨酸蛋白酶。通常,该家族蛋白酶(如糜蛋白酶原和胰蛋白酶原)以无活性或极微弱活性的单链形式被分泌,在单链分子N端高度保守的结构被水解之后蛋白才能被充分激活,而tPA与其他丝氨酸蛋白酶不同,其在单链时就可对纤溶酶原产生很好的活化作用,其断裂成2条链后分子活性才增加5~10倍[26-28]。
2.4 tPA的特异性溶栓性质
首先,tPA对纤维蛋白具有特异亲和力,当tPA存在于血凝块、血浆或纯化的纤维蛋白原中时,几乎只完全与血凝块结合。其次,tPA在正常生理状态下对纤溶酶原的活化作用很低,当血栓发生时,纤维蛋白及与其相关的复合物可强有力地刺激该活化作用(图1)。这种效应形成了tPA特异性溶栓的基础[1,16]。
另外,tPA和纤溶酶原都有结合纤维蛋白的特性。在tPA特异性溶栓的过程中,纤维蛋白具有双重功能,既参与激活纤溶酶原又作为提供形成纤溶酶的最终底物。tPA诱导裂解纤维蛋白血凝块的过程可分为缓慢相和快速相。在缓慢相中,单链tPA在完整的纤维蛋白表面激活纤溶酶原变为纤溶酶;在快速相中,纤维蛋白部分被纤溶酶降解并暴露出更多的可以结合纤溶酶原和tPA的位点,同时纤溶酶将单链tPA裂解为活性更高的双链tPA,又有纤溶酶原不断被激活产生纤溶酶。这样,tPA和纤溶酶原及纤维蛋白形成1个环状三元复合物,使溶栓效应以正反馈形式扩大[2,29]。
然而,值得注意的是,tPA的这种血凝块溶栓特异性仅能在其生理浓度观察到。在溶栓治疗中的药理浓度tPA,血凝块特异性消失,可产生全身溶栓状态,具有出血风险。在凝血事件中,内皮细胞合成并释放PAI-1抑制tPA;除此之外,生理条件下α2-抗纤溶酶(α2-antiplasmin,α2-AP)在血液循环中的浓度很高,可快速使未与血凝块结合的纤溶酶失活。然而,这种全身性调节功能在使用治疗剂量tPA进行溶栓时会被抵消,止血性纤维蛋白被tPA特异性溶解所造成的出血成为tPA特异性溶栓机制的直接后果[30]。
2.5 tPA的半衰期
tPA在血液循环中能被肝快速清除,导致其体内半衰期非常短,约5 min[16]。这一性质也使得人们在利用tPA进行溶栓治疗时需要持续泵注或注射相对大剂量的tPA。
2.6 tPA的生理抑制剂
PAI-1是tPA最重要的生理抑制剂,也是血浆中最主要的PAI,对tPA单链和双链及尿激酶均可抑制[6]。PAI-1 在血浆中的浓度非常低,约 20 μg·L-1。PAI-1最初从培养的牛血管内皮细胞中纯化,因此也叫内皮型PAI。后来人们发现,PAI-1可以被许多细胞合成。PAI-1抑制单链tPA的二阶速率常数为5.5×106L·mol-1·s-1,而抑制双链tPA的速率常数为1.8×107L·mol-1·s-1,比单链高 2倍以上。计算显示,生理浓度的单链tPA在含有PAI-1 20 μg·L-1(0.38 nmol·L-1)的血浆中能在 5.5 min内被抑制50%。PAI-1对纤维蛋白也有亲和力,其与纤维蛋白的结合可保护纤维蛋白免受蛋白水解。反过来,纤维蛋白的存在可严重降低PAI-1和tPA单链或双链分子的反应速率[2,31]。
PAI-2最初从人胎盘组织提取,故也叫胎盘型PAI。后来发现,PAI-2也存在于白细胞、单核细胞、巨噬细胞和组织淋巴细胞。PAI-2在血浆中的浓度通常很低,但孕妇血浆中的浓度可高达35 μg·L-1。PAI-2缓慢抑制单链tPA(4.6×103L·mol-1·s-1)。虽然双链tPA被抑制的速度稍快,但PAI-2抑制tPA的作用比较小[2]。
此外,血浆蛋白抑制剂如α2-AP、酯酶抑制蛋白C1(C1-inactivator)、α1抗胰蛋白酶和α2巨球蛋白对tPA活性只是缓慢抑制,很可能在PAI-1耗尽后起作用,尤其对具有较长半衰期的tPA变异体重组蛋白起到抑制作用[2]。
3 重组tPA及其变异体
1983年,Pennica等[32]首次发表了在大肠杆菌中克隆表达人tPA的cDNA结果。之后人们利用哺乳动物细胞系更有效地生产人单链tPA,这种重组tPA(阿替普酶)在生化性质、体内转化、特异溶栓活性方面与人天然tPA并无差别,是第一代重组tPA,到20世纪90年代已是临床和实验室研究最常用的tPA形式[2]。临床及科研工作者有时用tPA,TPA,t-PA或rt-PA指代阿替普酶。
基于tPA的结构重要性和溶栓治疗潜力,人们在tPA分子结构修饰改造方面进行了大量工作,希望能进一步提高tPA的溶栓性质,得到具有更强纤溶酶原激活能力、更高纤维蛋白特异性、对PAI-1具有更强耐受性和更低血浆清除率的变异体。在过去二十多年,已重组合成了不同的tPA变异体,代表性变异体有瑞替普酶(reteplase)和替奈普酶(tenecteplase),分别为第二代和第三代重组tPA。其他重组变异体还有孟替普酶(monteplase)、帕米普酶(pamiteplase)和兰替普酶(lanoteplase)等[33]。
瑞替普酶是天然人tPA蛋白的非糖基化变异体,含有其Kringle 2区和蛋白酶区。天然tPA含527个氨基酸,瑞替普酶包含其中的355个(第1~3和176~527位氨基酸)。瑞替普酶生产成本低于阿替普酶,由于缺少功能结构域,其纤维蛋白特异性不如tPA,且与内皮细胞和肝细胞的亲和力也降低,故半衰期较长,为 13~16 min[17,34]。
替奈普酶的分子结构在人天然tPA分子的基础上做了如下修改:将位于Kringle 1区的第103位苏氨酸和第117位天冬酰胺分别换成天冬酰胺和谷氨酰胺,将C端胰蛋白酶样蛋白水解区的第296~299位氨基酸换成4个丙氨酸。替奈普酶比阿替普酶具有更高纤维蛋白特异性,对PAI-1耐受性更强,血浆清除率更低[35-36]。
需要注意的是,虽然重组tPA及其变异体都属于tPA,但其溶栓治疗的疾病有所不同。阿替普酶于1987年获美国FDA批准用于治疗急性心肌梗死,之后又于1996年获美国FDA批准用于治疗AIS和急性肺动脉大栓塞。瑞替普酶和替奈普酶分别于1996年和2000年获美国FDA批准仅用于治疗急性心肌梗死。
4 AIS的tPA溶栓治疗
自20世纪60年代起,人们就开始试图使用纤溶酶原激活剂对AIS患者进行溶栓治疗。在一些早期试验中,先后使用了链激酶和尿激酶溶栓,均引起严重的颅内出血,重要原因是链激酶和尿激酶对血栓表面和循环血液中纤溶酶原的激活无选择性,导致出血[33,37]。1979年发现,tPA与传统非特异性纤溶酶原激活剂的一个显著差异在于tPA对纤维蛋白具有很高亲和力,在无纤维蛋白存在时极少与纤溶酶原结合,而在结合纤维蛋白时其激活纤溶酶原的效率大增,可实现血栓表面介导的纤溶酶原高效激活。因此,有望增加AIS溶栓治疗的安全性[1]。20世纪80年代中期,具有溶栓特异性的重组tPA阿替普酶问世,首次获准用于急性心肌梗死治疗,阿替普酶显示了比链激酶和尿激酶更加优越的冠脉溶栓效果,激起了人们对tPA治疗AIS的极大兴趣[3]。
4.1 tPA治疗AIS的有效性和安全性
1990年,阿替普酶用于治疗AIS的双盲多中心临床试验结果首次发表[37]。这次试验使用阿替普酶或尿激酶治疗364例AIS患者,治疗时,36.2%患者发生AIS的时间在24 h内,69.5%患者在48 h内,最终两组间未见差异,但提示阿替普酶在AIS发生后极早期治疗可能会比较有效。
1992年,开展了2次临床研究试验来测试静注阿替普酶治疗AIS的安全性[38-39],使用了逐渐增加的药物浓度(0.35~1.08 mg·kg-1),共计94例患者,时间窗为自发病起90或180 min以内(当时已有动物实验表明,在脑缺血2~3 h时即发生脑损伤[40])。结果表明,阿替普酶剂量<0.95 mg·kg-1是相对安全的,有助于促进早期神经功能恢复,并提示应非常早期地进行治疗,即在脑卒中发生后90或180 min内进行治疗,以减少出血风险并提高恢复率。1995年,美国国家神经紊乱和中风研究所(National Insti⁃tute of Neurological Disorders and Stroke,NINDS)的随机对照试验中共治疗了624例患者,发现在AIS(CT排除出血)3 h内静脉输注阿替普酶0.9 mg·kg-1可使患者在第3个月时少残或无残比例提高至少30%,但颅内出血发生率为6.4%,是安慰剂组的10倍。另外,值得注意的是,NINDS试验关注了治疗的最小时间窗,阿替普酶组312例患者中有302例在发病后90 min内完成一系列手续并获得治疗[41]。此外,由于AIS治疗后血压上升也会增加颅内出血风险,因此该试验中对血压也进行了严格控制。基于NINDS的重要试验结果,美国FDA在1996年批准阿替普酶用于治疗AIS发生3 h内符合治疗标准的患者[33]。
然而,有关tPA在临床实践中的安全性和有效性问题仍然存在。首先担心的是短期出血风险和这种治疗在常规临床实践中的实用性。因此,又进行了许多研究,包括美国逆转卒中标准治疗研究(Standard Treatment with Alteplase to Reverse Stroke,STARS)(2000年)[42]、加拿大阿替普酶治疗卒中疗效研究(Canadian Alteplase for Stroke Effectiveness Study,CASES)(2005 年)[43]、欧洲的静脉溶栓实施安全监测研究(Safe Implementa⁃tion of Thrombolysis in Stroke-Monitoring Study,SITS-MOST)(2007年)[44],这3项试验都确证了AIS发生3 h内阿替普酶的有效性和可接受的安全性。此外,在2008年发表的另一个大型随机对照临床试验欧洲急性卒中协作研究Ⅲ(European Cooperative Acute Stroke StudyⅢ,ECASSⅢ)[45],其结果不仅支持了NINDS试验的结论,而且进一步证明,在AIS发生后3~4.5 h内使用阿替普酶依然有效。但之前的其他试验,如ECASSⅠ临床试验(1995 年)[46]、ECASSⅡ临床试验(1998年)[47]和阿替普酶急性非介入溶栓治疗缺血性卒中研究(Alteplase Thrombolysis for Acute Noninterventional Therapy,ATLANTIS)的A部分(Part A)(2000年)[48]和B部分(Part B)临床试验(1999年)[49],阿替普酶的溶栓治疗结果并未显示出显著的有益性。值得注意的是,这些试验中,阿替普酶使用的方案和(或)时间窗都和NINDS和ECASSⅢ临床试验中的不同。ECASSⅠ,Ⅱ和ATLANTIS Part A临床试验的时间窗是0~6 h,而ATLANTIS Part B临床试验为3~5 h;同时,阿替普酶在ECASSⅠ临床试验中的剂量为1.1 mg·kg-1,比其他临床试验中的剂量较高[50]。
4.2 tPA治疗AIS的时间窗
阿替普酶治疗AIS的时间窗是排除不符合治疗标准患者的最重要也是最常见的因素。1995年,NINDS临床试验结果介绍3 h作为阿替普酶溶栓的时间窗,2008年,ECASSⅢ临床试验专门评估了AIS发生3~4.5 h后使用阿替普酶的安全性和有效性并取得阳性试验结果,之后欧洲和澳大利亚等许多国家和地区将阿替普酶治疗AIS的时间窗从脑卒中发生后3 h延长至4.5 h,美国心脏协会和卒中协会(American Heart Association/American Stroke Association,AHA/ASA)发布的临床指南也将治疗窗延长至4.5 h,但是对证据要求更加严格的美国FDA并未更改阿替普酶治疗AIS的时间窗[50-52]。
现在比较清楚的是,在AIS发生后,越早采用阿替普酶溶栓治疗越有利于患者预后。但同时需要注意的是,每位患者的脑侧支循环能力不同,其能承受的最大缺血时间也不一样,在更多更好的诊断技术和成像技术的协助下,超过时间窗的患者将来也可能进行溶栓治疗。
4.3 tPA治疗AIS的患者选择标准
1995年,NINDS在随机对照试验中要求,患者必须有明确的AIS发生时间和NIHSS评分,且脑CT扫描结果显示无颅内出血。患者出现以下情况之一则被排除:①3个月前有过脑卒中或严重的脑部创伤;②2周内进行过大手术;③具有颅内出血史;④收缩压>185 mm Hg或舒张压>110 mm Hg;⑤AIS症状轻微或快速改善;⑥具有蛛网膜下腔出血症状;⑦3周内有过胃肠道出血或泌尿道出血;⑧1周内在不可压迫止血的部位有过动脉穿刺;⑨AIS发生时有过癫痫;⑩AIS发生前48 h内服用抗凝药(或接受肝素治疗)并有部分活化凝血活酶时间升高;○11 凝血酶原时间>15 s,血小板计数<1×1011L-1,或者血糖<2.7或>22.2 mmol·L-1;○12 需要进行积极治疗以将血压降至特定范围内[41]。
NINDS临床试验是AIS治疗史上的里程碑。2013年,美国AHA/ASA发表的AIS阿替普酶溶栓疗法对患者的选择标准大部分还是以1995年NINDS试验要求为基础,但治疗时间窗为4.5 h[53]。ECASSⅢ临床试验与AHA/ASA指导原则对患者基本具有相同的排除和纳入标准,只是又额外排除了高危人群,如年龄>80岁的患者、严重的AIS患者即美国国家卫生研究院脑中风量表(National Insti⁃tutes of Health Stroke Scale,NIHSS)分数>25或成像技术显示缺血区>大脑中动脉供血区的1/3、使用口服抗凝药患者、患过脑卒中合并糖尿病的患者。此外,ECASSⅢ临床试验允许患者在接受阿替普酶治疗24 h后使用低剂量非口服抗凝药来预防深静脉血栓形成[45]。
需要指出的是,NINDS和ECASSⅢ临床试验制定的患者排除标准是为了优化疗效,避免治疗风险大于治疗益处,很多禁忌证并无实际的数据证明材料。这些严格的AIS溶栓治疗的限制性条件是阿替普酶应用率极低的一个重要原因。据估计,约80%脑卒中为缺血性脑卒中,而符合阿替普酶治疗标准的缺血性患者仅占所有脑卒中患者的6%~8%[51]。因此,许多研究对“标准”之外的一些条件进行了探索,如年龄>80岁、脑卒中病史合并糖尿病、新近心肌梗死、口服抗凝药、轻微脑卒中、脑卒中症状快速恢复、3个月内大型手术等[53]。总体来讲,上述研究表明,具有禁忌证的AIS患者使用阿替普酶溶栓的选择余地值得进一步探讨。例如,2012年IST-3大型临床试验结果表明,阿替普酶对>80岁的老年患者的治疗效果至少与年轻患者一样有效[54]。
2015 年,Demaerschalk 等[51]以 AHA/ASA 指导原则和美国FDA治疗建议为中心,结合临床试验背景,专门对阿替普酶治疗AIS的患者选择条件进行了系统详细的分析讨论,提示AIS溶栓治疗的限制性条件在数据证明材料和实际排除率上都存在很大波动性。Fugate等[55]分析认为,这些限制性条件有些是绝对的,有些是相对的,其中很多可做出适当调整。
4.4 tPA治疗AIS的给药途径和剂量
动脉给药方式的优点是可使药物直接运送至闭塞处,可能有更高的再通率,但需要干预的技术比较复杂耗时,具备条件的医疗单位有限。静脉给药会导致较严重的药物稀释,可能需要更高剂量,因此增加全身不良反应风险,但是可能有更快速的溶栓效果,且更容易推广使用[46]。在NINDS临床试验中,阿替普酶的给药剂量为0.9 mg·kg-1,上限为90 mg,首先静脉推注剂量的10%,剩余90%在60 min内以恒定速度静脉泵注。此后绝大部分临床试验包括ECASSⅢ临床试验,均沿用此给药途径和剂量,并证明阿替普酶0.9 mg·kg-1治疗AIS确实有效,尽管该剂量会引起颅内出血风险升高。
2006年,在日本阿替普酶临床试验(Japan Alteplase Clinical Trial,J-ACT)中[56],103 例 AIS患者接受了阿替普酶总剂量为0.6 mg·kg-1溶栓治疗,其临床预后和颅内出血发生率结果提示,阿替普酶0.6和0.9 mg·kg-1在治疗效果上有可比性。尽管该试验有很多缺点和局限性,日本药品安全管理部门在此之后即批准了阿替普酶0.6 mg·kg-1用于AIS溶栓。为了证实低剂量阿替普酶治疗AIS是否具有优势,2015年的改进高血压管理和溶栓治疗研究(Enhanced Control of Hypertension and Throm⁃bolysis Stroke Study,ENCHANTED)[57]对13个国家的3310例AIS患者(63%为亚洲人,治疗时间窗为4.5 h)随机给予阿替普酶0.6 mg·kg-1和0.9 mg·kg-1溶栓治疗,发现0.6 mg·kg-1组在第3个月的最主要预后指标(致残致死率)并未达到非劣性标准,但该组颅内出血率明显低于0.9 mg·kg-1组。
4.5 tPA治疗AIS的不良反应
颅内出血是阿替普酶溶栓治疗最常见最严重的不良反应。为及早发现颅内出血并发症,1995年NINDS临床试验建议静脉输注阿替普酶后2 h内每15 min监测一次血压和进行一次神经功能评估,之后是6 h内每30 min一次,接下来是16 h内每60 min一次。AHA/ASA在2013年及以后的治疗准则中支持该建议,且在3~4.5 h内阿替普酶治疗的患者遵循相同的血压和神经功能评估流程[53,58]。
根据前期阿替普酶的临床试验,Micieli等[59]和Robinson等[60]分析认为,溶栓治疗AIS时一些关键因素可明显影响颅内出血风险。首先是阿替普酶的剂量,剂量过大时出血风险明显增加;其次是患者在AIS发生后获得溶栓治疗的时间,治疗得越及时越有利于减少出血的发生;第三是患者自身的状态,当其脑梗太严重,或年龄过大、合并糖尿病(高血糖)或高血压都易增加出血风险。此外,抗血小板药与阿替普酶联用致使颅内出血风险升高亦引起人们相当的重视,发生原因是临床上常使用抗血小板药以提高阿替普酶用药后血管再灌率;另一方面,有很多患者发生AIS前在服用抗血小板药(主要是阿司匹林),用于心血管事件的初级预防和二级预防[61-62]。
以上因素绝大部分在AHA/ASA治疗准则中以严格的治疗限制条件或禁忌证得到充分体现。为在有效溶栓的基础上尽可能减少颅内出血风险,已有不少研究致力于解决此问题:①一些临床试验尝试减少阿替普酶的用药剂量,典型试验如2006年的J-ACT 试验[56]和2015年的ENCHANTED大型临床试验[57],比较了阿替普酶0.6和0.9 mg·kg-1溶栓的预后指标和颅内出血率,提示具有较高颅内出血风险的AIS患者使用低剂量阿替普酶治疗的潜在益处。②由于AIS患者入院后接受影像检查等会导致延迟实施溶栓治疗,不少学者提出,医务人员除了使患者在时间窗内接受溶栓治疗,还应权衡溶栓前辅助检查带来的益处与检查所致治疗延迟可出现的风险。③近些年,许多临床试验及其分析报告就阿替普酶溶栓治疗AIS过程中使用的抗血小板药种类、剂量和用药时间等对患者预后效果及颅内出血率的影响进行了研究[62-67],有望进一步提高AIS溶栓治疗效果。目前,2018年的AHA/ASA临床指南支持患者在AIS发病后24~48 h内使用阿司匹林治疗,对于使用阿替普酶治疗的患者,宜在静脉输注阿替普酶后24 h再使用阿司匹林,但用药仍需权衡利弊[58]。④人们一直在寻找比阿替普酶具有更高纤维蛋白亲和力的溶栓药物,如替奈普酶[68],但至今还无明确的证据证明这些药物在临床试验中优于阿替普酶。⑤其他治疗探索如联合应用超声波助溶技术,在2017年发表的挪威急性脑卒中超声溶栓研究试验(Norwegian Sonothrombolysis in Acute Stroke Study,NOR-SASS)[69]中,183 例AIS患者在阿替普酶(或替奈普酶)溶栓治疗条件下,被分为超声辅助溶栓组和对照组,但两组的功能预后和颅内出血率并未显示出超声溶栓的有益性。2018年的AHA/ASA临床指南并不支持使用该辅助疗法[58]。
除了颅内出血,其他不良反应发生概率较低,包括全身出血、过敏反应和口舌血管性水肿等,其中口舌血管性水肿发生于患侧大脑对侧,症状轻微且是暂时性的,估计1.3%~5.1%接受阿替普酶溶栓治疗的患者会出现此反应,通常与使用血管紧张素转换酶抑制剂或大脑岛、额叶皮质梗死有关。早期暂时性神经损害与阿替普酶溶栓治疗引起的脑实质水肿及阿替普酶潜在的神经毒性有关[33,53]。
5 AIS的tPA溶栓联合血管内取栓新疗法
自1996年阿替普酶获美国FDA批准用于治疗AIS起,一直到2014年,阿替普酶溶栓疗法还是唯一的AIS治疗方案。然而,其严格的治疗时间窗使得绝大多数患者不符合治疗条件;另外,对于血栓位于脑部主要大动脉(如远端颈内动脉或近端大脑中动脉)的患者,由于血栓大,阿替普酶溶栓效果并不太理想。2015年,Berkhemer等[70]的随机临床试验首次证明,对于具有脑前循环近端大动脉阻塞的AIS患者,在AIS发生6 h内进行阿替普酶溶栓联合血管内机械取栓疗法是安全且有效的;之后同一年内,又有4项随机临床试验结果表明,阿替普酶溶栓联合血管内机械取栓治疗AIS的方案确实优于单纯使用阿替普酶溶栓疗法,且这些试验的治疗时间窗不同程度延长,最长的为AIS发生后12 h内[71-74]。2015年,美国AHA/ASA修改AIS早期治疗原则,支持在一定条件下对具有颅内颈内动脉或近端大脑中动脉阻塞的AIS患者在AIS发生后6 h内进行血管内机械取栓治疗,并强调,患者如符合阿替普酶溶栓条件,宜联合使用阿替普酶溶栓[75]。2018年初,2项随机临床试验,分别为临床影像不匹配的觉醒卒中和迟发型卒中患者应用Trevo装置取栓研究(Diffusion Weighted Imaging or Computerized Tomography Perfusion Assessment with Clinical Mismatch in the Triage of Wake-up and Late Presenting Strokes Undergoing Neurointerven⁃tion with Trevo,DAWN)[76]及磁共振弥散和灌注加权成像观察卒中研究(Endovascular Therapy Following Imaging Evaluation For Ischemic Stroke 3,DEFUSE 3)[77],这2项试验的分析结果再次证明了阿替普酶溶栓联合血管内机械取栓治疗AIS的有效性,并且分别将治疗时间窗延长至24或16 h。据此,2018年AHA/ASA将阿替普酶溶栓联合血管内机械取栓治疗AIS的时间窗进一步修改,即在继续支持6 h时间窗的基础上,认为如果AIS患者符合DAWN或DEFUSE 3试验纳入标准,其时间窗可延长至24或16 h[58]。
一般认为,血管内机械取栓治疗前联合阿替普酶溶栓可提高血管再通成功率并减少再通所需时间。另外,阿替普酶溶栓还有助于溶解机械取栓法无法解决的远端深静脉血栓,从而改善预后。但是血管内机械取栓治疗的关键依然取决于从AIS症状发生至开展治疗的这段时间。因此,治疗延迟时间必须要最小化。由于阿替普酶对脑大血管血栓患者的血管再通效果很有限,而且先进行阿替普酶溶栓操作会延迟机械取栓的开始时间,故也有学者质疑使用阿替普酶联合溶栓的必要性,毕竟越早进行机械取栓其效果越好。
2018年,Ferrigno等[78]临床观察性试验中研究分析了静脉输注阿替普酶对血管内机械取栓疗法的影响,共纳入485例发生脑前循环大动脉闭塞的AIS患者,其中有348例患者接受阿替普酶溶栓联合血管内机械取栓治疗,137例只接受血管内机械取栓治疗。结果表明,阿替普酶溶栓联合血管内机械取栓治疗有较好血管再通率、较好预后及较低死亡率,该结果独立于颅内出血并发症的发生率。
另一方面,为了缩短从tPA溶栓至血管内机械取栓的时间,2018年Campbell等[79]随机临床试验研究了替奈普酶在tPA联合溶栓治疗中的疗效。替奈普酶是阿替普酶的变异体,比阿替普酶的半衰期更长,可以静脉推注;而阿替普酶需要泵注1 h,该不同点有望减少血管内机械取栓的延迟时间。替奈普酶还具有更强的纤维蛋白特异性,可发挥比阿替普酶更强的纤溶酶原激活功能,且出血并发症可能比阿替普酶更少。在此次临床试验中,他们纳入AIS发生后4.5 h内具有脑大血管血栓且预备进行机械取栓的患者共202例,分为2组,每组101例,分别使用替奈普酶和阿替普酶溶栓并进行血管机械取栓。结果表明,替奈普酶的血管再通率比阿替普酶更好,但并未发现使用替奈普酶节省了从溶栓到机械取栓的时间,且替奈普酶组AIS患者独立生活能力的恢复及脑出血并发症的发生率等与阿替普酶组也无差异。该项试验证明了替奈普酶的非劣性。
6 结语和展望
近3年来,AIS的治疗方案发展很快,在使用阿替普酶静脉输注进行溶栓治疗的基础上又增加了血管内机械取栓疗法,治疗时间窗也得到延长,意味着将来会有更多的AIS患者得到有效治疗。从AIS发生到开始治疗的这段时间仍然是拯救脑缺血损伤的关键,对于那些符合治疗条件的患者,如何缩短这段时间、如何减少溶栓到机械取栓的时间及如何进一步延长治疗时间窗将仍然是人们关心的问题。阿替普酶溶栓联合血管内机械取栓疗法在AIS治疗史上是一大进步,然而符合治疗条件的患者毕竟还是少数,未来还需进一步优化血管再通的治疗方案,研发更加安全有效的溶栓药物。
