超高压液相色谱-串联质谱法测定粮食中多种真菌毒素残留
2019-01-08钟世欢叶佳明叶磊海裘钧陶王庆龄应寒松
钟世欢,叶佳明,叶磊海,裘钧陶,王庆龄,王 京,应寒松
(1.浙江公正检验中心有限公司,浙江杭州 310009;2.浙江赞宇科技股份有限公司,浙江杭州 310009)
真菌毒素(Mycotoxin),是真菌在生长过程中产生的有毒代谢产物,包含多种化学结构不同的物质,易诱发人畜各种生理损害,目前是各种粮食、农副产品的主要污染物之一[1]。家畜被饲喂含有真菌毒素的饲料会导致病患率升高,生产性能下降,同时其组织中可能会残留真菌毒素,通过食物链,逐级传递给食用者,对食用者的健康构成潜在危害。这些真菌毒素不仅具有致癌、致畸和致突变等作用,还具有肝细胞毒性、中毒性肾损害、生殖紊乱、免疫抑制等危害,对机体造成永久性损害甚至死亡,对人类和动物健康造成极大威胁[2]。因此,为监测食品受污染,需加强对真菌毒素的检测力度。同时为保障食品安全,减小人群的真菌毒素暴露危险,因此建立一套有效的检测食品中多种真菌毒素含量的方法具有一定的社会意义。
目前检测食品中真菌毒素的方法有很多,主要包括薄层色谱法(TLC)、高效液相色谱法(HPLC)、酶联免疫吸附法(ELISA) 等[3-4]。但是,这些方法存在着一定缺陷。如薄层色谱法、酶联免疫法只是半定量方法,液相色谱法定量较为准确,但其选择性较差、定性能力不足、灵敏度较低,而且这些方法都只能检测某一种或者某一类最多4种真菌毒素,涉及多成分同时检测的方法甚少。随着HPLC-MS/MS仪器的成功应用,利用其专属性强、选择性好、灵敏度高、操作简单省时等优势,可弥补前述方法的不足,对多组分同时进行定性和定量分析,使该技术在分析检验中得到广泛应用[5-6]。
试验以80%乙腈水为提取液,粮食谷物等样品经过超声提取后,使用固相萃取柱净化杂质,以超高压液相色谱串联质谱法进行定性、定量检测分析,该方法较好地控制了基质效应,且简单高效。
1 试验设计
1.1 仪器和试剂
Agilent1260型超高效液相色谱仪、Agilent 6460型三重四极杆质谱仪、AR2140型电子分析天平、MP1100B型电子分析天平、KS-300EI型超声波、Centrifug-5804R型台式离心机、Milli-Q型纯水仪等。
甲醇(色谱级)、乙腈(色谱级)、甲酸(色谱级)、19种真菌毒素标准品、Oasis PRiME HLB固相萃取柱。
1.2 试验方法
(1) 提取。称取样品约5.00 g(精确至1 mg),置于50.0 mL离心管中,加入10.00 mL乙腈-水(80∶20,V∶V) 混合提取液,涡旋30 s,超声提取20 min,离心,取上清液5.00 mL,加入10 mL乙腈饱和的正己烷去脂,取下层清液备用。
(2) 净化。将上述液体上样Oasis PRiME HLB型柱,以1滴/s的速度过柱,收集洗脱液于试管中,再用3 mL乙腈-水(80∶20,V∶V) 溶液淋洗小柱,收集全部流出液后,在40℃下用氮气吹至液面低于1 mL,并用50%甲醇水溶液定容至1.00 mL,漩涡混匀,过0.22 μm微孔滤膜,经液相色谱-串联质谱测定。
(3) 色谱条件。色谱柱:Agilent RRHD SB-C18型柱 (100 mm×2.1 mm,1.8 μm);柱温 35℃,进样量5 μL,流动相A:0.1%甲酸水溶液或水溶液(负离子使用),流动相B乙腈,流速0.3 mL/min,停止时间12.0 min。
梯度洗脱条件见表1。
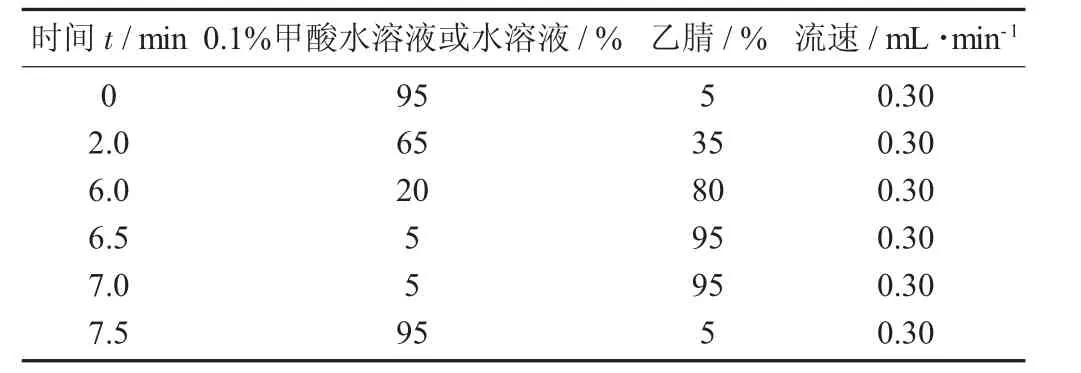
表1 梯度洗脱条件
(4) 质谱条件。离子源:电喷雾离子源(ESI);扫描方式:负离子监测模式和正离子监测模式;检测方式:多反应监测(MRM);毛细管电压4.0 kV;雾化器(N2)压力35 psi;干燥气(N2)温度350℃;干燥气(N2)流速10 L/min。
19种真菌毒素的相关质谱检测参数见表2。
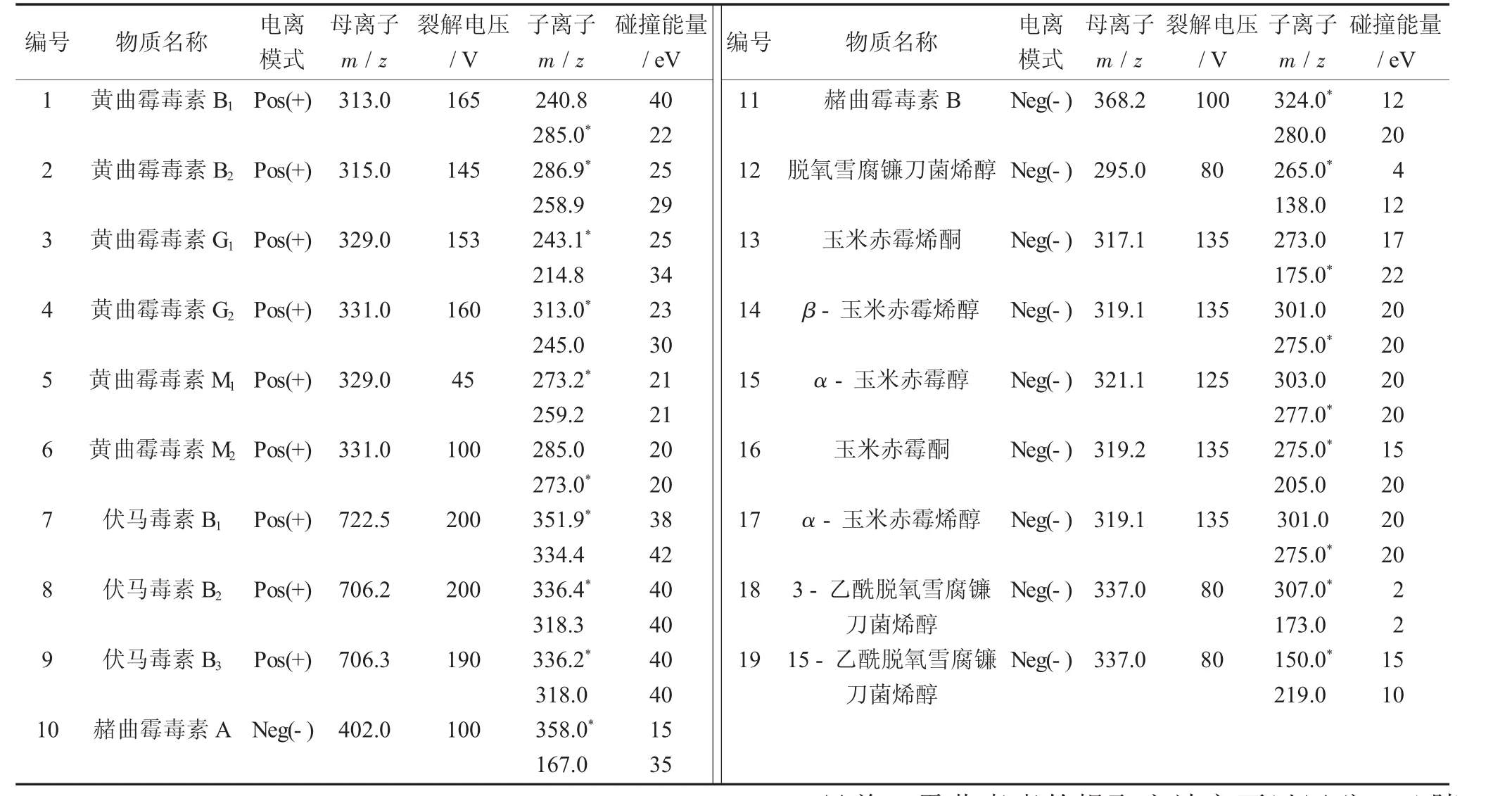
表2 19种真菌毒素的相关质谱检测参数
2 结果与分析
2.1 样品提取的优化
目前,霉菌毒素的提取方法主要以甲醇、乙腈及其与水的混合溶液为提取剂。鉴于玉米赤霉醇及其类似物和黄曲霉类毒素为脂溶性物质,难溶于纯水,溶于大多数有机溶剂。试验使用乙腈水溶液作为提取液,保证目标物提取,同时沉淀部分蛋白降低基质效应。现比较了70%,80%,90%(V/V) 的乙腈-水溶液的提取效率,并对提取方法、提取时间等条件进行比较。试验表明,80%(V/V)乙腈-水溶液,超声提取20 min对各真菌毒素的提取效果总体效果最佳。
2.2 净化方式的优化
由于粮食制品中含有大量淀粉糖类及磷脂、脂肪等亲脂性杂质的存在,降低色谱柱寿命,同时增大基质效应干扰目标化合物的分析。采用固相萃取净化方法是复杂基质中痕量检测进行净化的常用方法。若选择了专一性较强的萃取小柱对测定某种或某类化合物效果较好,但若用于多组分中性质差异较大的样品,往往对某些组分的吸附性较差而得不到满意的效果。试验比较采用了Oasis HLB和Oasis PRiME HLB 2种不同类型的固相萃取小柱进行样品净化处理比较。Oasis HLB型萃取小柱要求在大比例水相的条件下上样,才会使目标物在柱子上得以保留,这就要求把提取液中的乙腈蒸发并置换成水相,增加了前处理时间,而且玉米赤霉烯酮的回收率稳定性较差,无法准确定量。因此,试验利用Oasis PRiME HLB型萃取小柱可用80%乙腈水的提取液直接通过,吸附磷脂及非极性干扰物,而所有的待测物无吸附等特性,这样既能使干扰物有效去除,确保所有待测组分无损失,同时在净化过程中也省去了溶剂转换的过程,简化了操作步骤。故试验采用Oasis PRiME HLB型萃取小柱进行样品的净化。
2.3 线性关系和检测限
以19种真菌毒素的质量浓度为横坐标、对应的响应值为纵坐标,进行线性回归。
19种真菌毒素的线性方程、线性关系见表3。
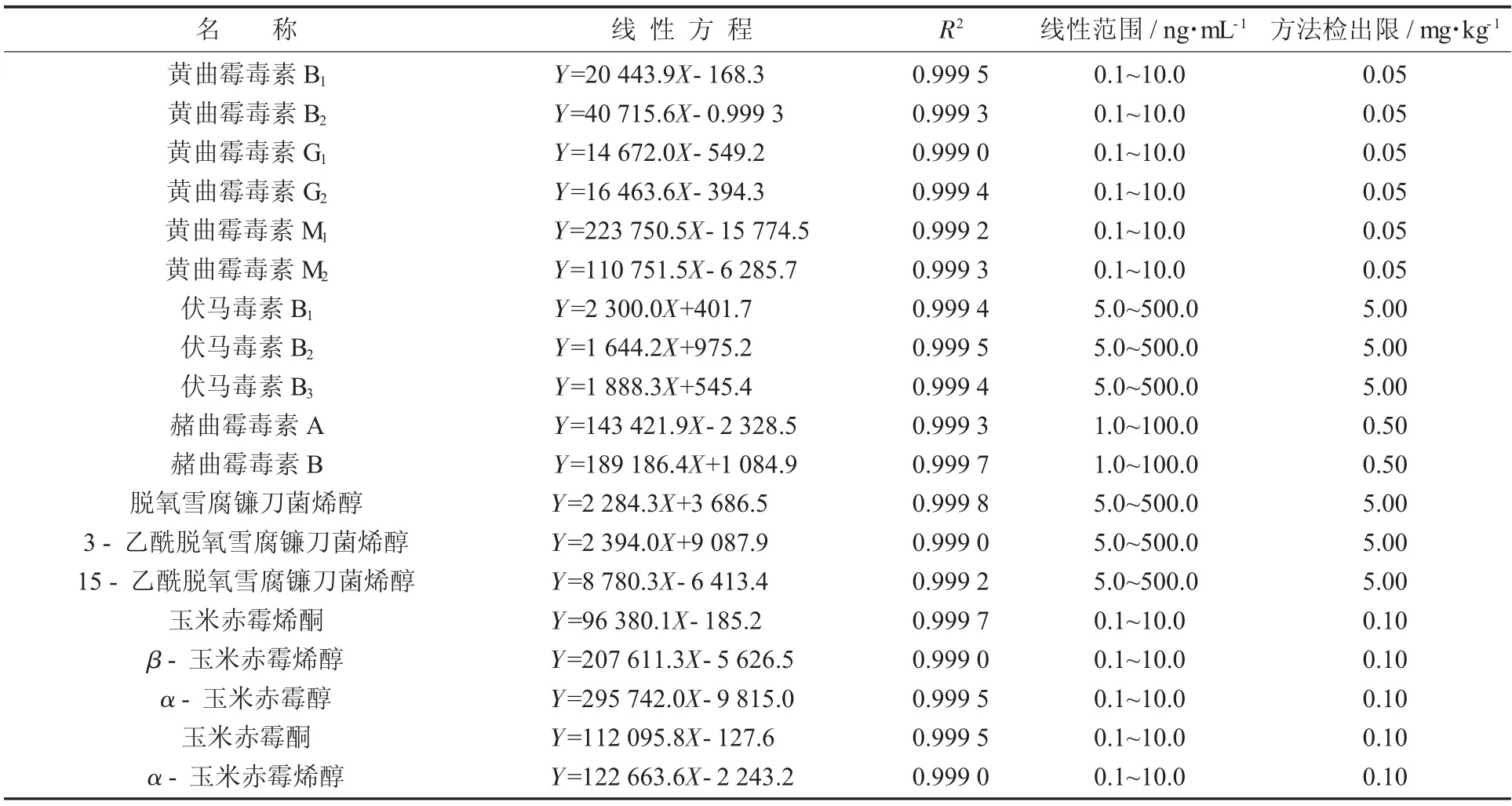
表3 19种真菌毒素的线性方程、线性关系
2.4 精密度与回收率
按试验液相色谱-串联质谱测定方法操作,对大米、玉米、大豆及花生阴性样品分别进行2个水平6次重复性加标回收试验。加标的回收率为73.4%~108.9%,相对标准偏差均小于10%。结果表明,此方法具有良好的准确性和可靠性。
19种真菌毒素的加标回收和重现性(n=6)见表4。
3 结论
试验建立了HPLC-MS/MS法测定粮食中黄曲霉毒素(B1,B2,G1,G2,M1,M2)、伏马毒素(B1,B2,B3)、赭曲霉毒素A和B、玉米赤霉烯酮、脱氧雪腐镰刀菌烯醇、α-玉米赤霉醇、玉米赤霉酮、α-玉米赤霉烯醇、β-玉米赤霉烯醇、3-乙酰脱氧雪腐镰刀菌烯醇、15-乙酰脱氧雪腐镰刀菌烯醇等19种真菌毒素的检测方法。该方法优化了前处理提取、净化,色谱和质谱条件,使其有良好的分离度,同时该方法简单、灵敏度高、专属性强,节省大量的人力物力资源和时间,为监管和质量控制提供了有利的技术支持,可用于实际样品的测定。
表4 19种真菌毒素的加标回收和重现性(n=6)
序号 名称 加标量/μg·kg-1回收率/%1 2 3 4 5 6 7 8 9 1 0黄曲霉毒素B1黄曲霉毒素B2黄曲霉毒素G1黄曲霉毒素G2黄曲霉毒素M1黄曲霉毒素M2伏马毒素B1伏马毒素B2伏马毒素B3赭曲霉毒素A 0.50 2.00 0.50 2.00 0.50 2.00 0.50 2.00 0.50 2.00 0.50 2.00 50.00 200.00 50.00 200.00 50.00 200.00 5.00 20.00 73.6~85.3 81.2~105.1 74.9~85.1 82.1~108.3 73.4~87.9 79.2~97.9 74.2~103.6 86.0~107.9 81.8~103.6 86.2~99.2 80.2~100.6 86.8~106.7 84.7~103.7 87.3~106.1 79.6~100.6 85.4~108.1 82.2~102.6 89.3~108.9 85.5~101.6 85.9~104.9 RSD/%5.4 8.5 4.7 8.8 7.1 5.1 9.5 7.8 9.2 6.3 8.9 8.7 6.3 7.7 8.7 9.2 8.8 7.8 6.9 8.2序号 名称 加标量/μg·kg-1回收率/% RSD/%11赭曲霉毒素B 12脱氧雪腐镰刀菌烯醇133-乙酰脱氧雪腐镰刀菌烯醇1415-乙酰脱氧雪腐镰刀菌烯醇15玉米赤霉烯酮16β-玉米赤霉烯醇17α-玉米赤霉醇18玉米赤霉酮19α-玉米赤霉烯醇5.00 20.00 50.00 200.00 50.00 200.00 50.00 200.00 1.00 5.00 1.00 5.00 1.00 5.00 1.00 5.00 1.00 5.00 80.8~92.0 88.8~104.6 73.5~86.6 80.8~101.7 78.3~98.7 85.9~106.2 79.5~100.7 93.9~107.1 79.6~99.6 82.4~101.3 75.2~96.2 87.9~105.1 77.7~95.7 81.9~104.1 76.3~102.6 86.3~107.9 73.3~95.6 87.3~106.9 5.1 6.5 6.6 9.5 9.2 8.9 8.2 6.9 9.7 7.3 8.7 7.9 9.7 7.9 9.5 8.1 8.7 8.3
