一种米曲霉耐盐蛋白酶的纯化及酶学性质分析
2019-01-07毛丙永刘艳凤赵国忠崔树茂赵建新
毛丙永,刘艳凤,赵国忠,崔树茂,赵建新,*
(1.江南大学食品学院,江苏 无锡 214122;2.天津科技大学食品工程与生物技术学院,天津 300457)
米曲霉是目前酱油酿造中最重要的菌株,由于其不产毒素,且胞外蛋白酶系十分复杂[1],是分解大豆蛋白的最佳选择[2],能够赋予酱油独特的风味[3]。米曲霉的胞外蛋白酶系通过顶端分泌的方式分泌至胞外[4-5],其基因组中有135 个胞外蛋白酶基因[6],在酱油发酵期间,蛋白酶之间交替发生作用。米曲霉产生的蛋白酶如此重要,引起学者们的广泛关注。Su Guowan等[7]研究发现,米曲霉蛋白酶粗提物水解脱脂大豆的能力优于碱性蛋白酶、复合蛋白酶和木瓜蛋白酶等商业蛋白酶。微生物生产得到的工业蛋白酶,约75%被用于烘焙、酿造、发酵、明胶、肉类、皮革和洗涤剂等领域[8]。在酱油发酵后期,NaCl质量浓度高达12~18 g/100 mL,许多蛋白酶的活性被抑制,只有一些耐盐的蛋白酶仍保持较高的酶活力,导致原料水解不彻底,发酵周期被延长。因此,从米曲霉中纯化得到耐盐蛋白酶,对于指导酱油发酵具有重要的意义。本实验旨在从米曲霉3.042中,挖掘一种具有潜在工业价值的耐盐蛋白酶,从而指导生产实践。
1 材料与方法
1.1 材料与试剂
米曲霉3.042保藏于江南大学食品生物技术中心;Q-HP阴离子柱、Superdux 75凝胶柱 通用电气医疗集团;BCA蛋白浓度测定试剂盒 上海碧云天有限公司;福林-酚、40%聚丙烯酰胺-甲叉双丙烯酰胺(29∶1)、胰蛋白酶(均为分析纯) 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
AKTA avant全自动蛋白快速分离系统 瑞典GE公司;ultrafleXtreme基质辅助激光解析电离串联飞行时间质谱仪 美国布鲁克·道尔顿公司;MOS-450圆二色谱仪 法国Biologic公司;UV2450型分光光度计日本岛津公司。
1.3 方法
1.3.1 种曲培养条件
称取100 g麦麸,添加110 mL蒸馏水,按照30 g/500 mL三角瓶分装,121 ℃灭菌20 min。待温度冷却至40 ℃以下,接入米曲霉,摇匀,30 ℃堆积培养,待瓶内泛白后摇瓶培养,生长至黄绿色时,将种曲装入牛皮纸袋中,密封,50 ℃烘干,4 ℃贮存备用。
1.3.2 大曲培养条件
称取60 g豆粕,添加110 g沸水浸泡30 min后,加入40 g麸皮,搅拌均匀,121 ℃灭菌20 min,按照质量分数2.5‰接种种曲,28 ℃、相对湿度90%培养,控制温度低于40 ℃,待大曲变为黄色,立即收集并提取蛋白酶。
1.3.3 粗酶液提取
称取一定量的大曲,按照料液比为1∶20添加0.9%无菌生理盐水,40 ℃水浴1 h,不断搅拌,纱布过滤,4 ℃、8 000×g离心20 min,收集上清液。
1.3.4 硫酸铵分级沉淀
参考Wang Dong等[9]的方法。量取一定体积的粗酶液,低温搅拌加入硫酸铵,使之饱和度分别达到10%、20%、30%、40%、50%、60%、70%、80%和90%,每一饱和度在4 ℃静置4 h,9 000×g离心20 min,20 mmol/L pH 7.5 Tris-HCl重悬沉淀,使用8~14 kDa透析袋透析脱盐,使用聚乙二醇20000浓缩样品,冻干冷藏备用。
1.3.5 Q-HP阴离子交换
上样缓冲液A为20 mmol/L pH 7.5 Tris-HCl,洗脱液B为1 mol/L NaCl,流速为2 mL/min,洗脱条件:100% A,0% B,15 BV;90% A,10% B,15 BV;20% B,15 BV。收集样品测定酶活力,做十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)。
1.3.6 Superdux 75凝胶层析
用20 mmol/L pH 7.5 Tris-HCl平衡柱子,并洗脱,流速为0.4 mL/min,收集样品测定酶活力,做SDS-PAGE。
1.3.7 蛋白酶活力测定
参考SB/T 10317—1999《蛋白酶活力测定法》的方法。取待测样品1 mL以及质量浓度2 g/100 mL酪蛋白溶液,pH 7.2,40 ℃水浴2 min,取出立即加入1 mL酪蛋白,40 ℃水浴反应10 min,加入2 mL 0.4 mol/L三氯乙酸溶液,水浴20 min使蛋白质沉淀,随后使用0.22 μm针头式滤器过滤,然后取1 mL滤液,加入5 mL 0.4 mol/L Na2CO3溶液,加入1 mL稀释3 倍的福林-酚试剂混匀,40 ℃水浴20 min,在波长660 nm处测定光密度。40 ℃时每分钟水解酪蛋白生成1 μg酪氨酸,被定义为1 个蛋白酶活力单位(U)。1.3.8 蛋白质量浓度测定
采用BCA法测定蛋白质量浓度,以牛血清蛋白作为标准蛋白。
1.3.9 蛋白酶SDS-PAGE分析
参考Laemmli[10]的方法。浓缩胶质量浓度为5 g/100 mL,分离胶质量浓度为12 g/100 mL,利用考马斯亮蓝R250染色。
1.3.10 飞行时间质谱鉴定蛋白酶
参考Vejvoda等[11]的方法。将上述SDS-PAGE的蛋白条带切下,切成1 mm3的小胶块,置于1.5 mL EP管中,加入200~400 μL 100 mmol/L NH4HCO3/30% ACN混合溶液脱色,清洗至透明,去除上清液,用50 μL ACN脱水2 次,得到白色胶粒。加入5 μL 2.5~10 ng/μL胰蛋白酶溶液,4 ℃放置30~60 min,使胶块充分溶胀,吸出剩余酶液。再加入20~30 μL 25 mmol/L NH4HCO3缓冲液,37 ℃水浴20 h。吸出酶解液,冷冻浓缩,点样,进行质谱分析。检索参数见表1。

表1 检索参数设置Table 1 Parameters of database search
1.3.11 蛋白酶三级结构预测
飞行时间质谱鉴定得到的蛋白序列,在NCBI(https://www.ncbi.nlm.nih.gov/)中进行比对,得到蛋白酶的氨基酸序列,将此序列在Swiss model(http://www.swissmodel.expasy.org/)中进行模型拟合,按照GMQE值选择匹配度较高的模型。
1.3.12 蛋白酶最适温度和温度稳定性测定
参考Lee等[12]的方法。pH 7.2时,在20、30、40、50、60、70 ℃和80 ℃测定蛋白酶活力,计算不同温度条件下的相对酶活力,酶活力最高的温度即为最适温度。
pH 7.2时,把蛋白酶放置于35、40、45、50 ℃和55 ℃分别保温20、40、60、80 min和100 min,在40 ℃、pH 6.5条件下测定其蛋白酶活力,保温前的酶活力被定义为100%,计算其他条件下的相对酶活力,酶活力最高的温度即为最适温度。
1.3.13 蛋白酶最适pH值和pH值稳定性测定
参考Lee等[12]的方法。利用pH 4.5、5.0和pH 5.5柠檬酸缓冲液,pH 6.0、6.5、7.0、7.5、8.0、8.5和pH 9.0 Tris-HCl缓冲液配制质量浓度2 g/100 mL酪蛋白溶液,并调节酶液至相应的pH值,在40 ℃测定不同pH值条件下蛋白酶活力,计算不同pH值的相对酶活力,最高酶活力的pH值即为最适pH值。
将调至pH 6.0、6.5、7.0、7.5、8.0、8.5和pH 9.0的酶液,40 ℃分别保温30、60、90 min以及120 min,在40 ℃、pH 6.5条件下测定其蛋白酶活力,保温前的酶活被定义为100%,最高酶活的pH值即为稳定pH值,计算其他条件下的相对酶活力。
1.3.14 金属离子对蛋白酶活力的影响
配制NaCl、CaCl2、MnSO4、CuCl2、FeSO4、FeCl3和KCl溶液,与蛋白酶混合使金属离子终浓度达到2 mmol/L,在40 ℃、pH 7.0条件下测定酶活力,不添加金属离子测得的酶活力定义为100%,计算不同金属离子条件下的相对酶活力。
1.3.15 蛋白酶动力学特征测定
参考Lineweaver等[13]的方法。配制1.0、3.0、5.0、7.0、9.0、11.0 g/L和13.0 g/L的酪蛋白溶液,在40 ℃、pH 7.0条件下测定其反应速率,然后绘制1/S-1/V的Lineweaver-Burk双倒数曲线,根据曲线的横截距为-1/Km,纵截距为1/Vm,求出蛋白酶的米氏常数Km以及最大反应速率Vm。
1.3.16 金属离子影响下蛋白酶二级结构测定
参考Sreerama等[14]的方法。样品蛋白质量浓度范围0.01~0.2 mg/mL,添加NaCl、CaCl2、MnSO4、CuCl2、FeSO4、FeCl3和KCl溶液,使金属离子终浓度为2 mmol/L,扫描波长190~250 nm,扫描速率100 nm/min,光程1 mm,使用SELCON3进行分析。
1.3.17 蛋白酶的耐盐特性
蛋白酶液中加入NaCl溶液,使其终浓度质量分别为5、10 g/100 mL和15 g/100 mL,在pH 7.0,40 ℃的条件下测定酶活力,不添加Na+测得的酶活力定义为100%,计算不同浓度Na+条件下的相对酶活力。
1.4 数据分析
实验结果数据均以 ±s表示(n=3),图形采用Origin 8.5软件绘制。
2 结果与分析
2.1 米曲霉蛋白酶的分离纯化
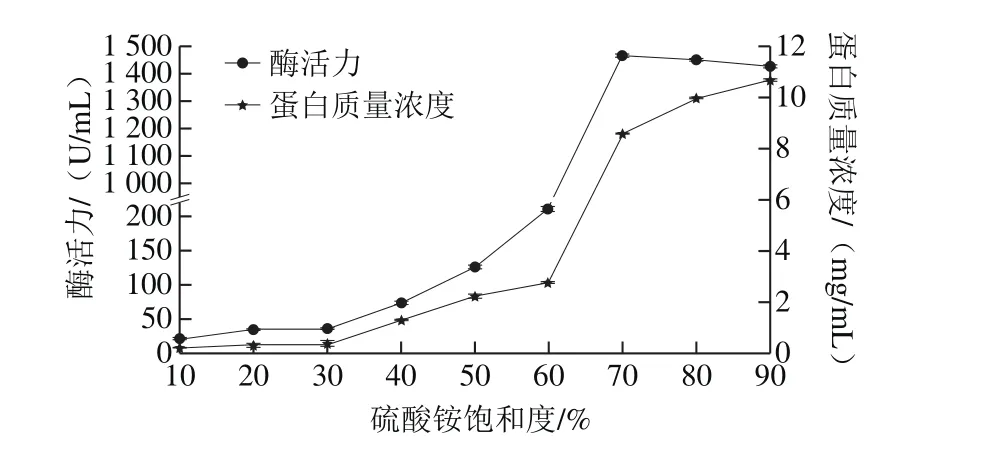
图1 蛋白酶的盐析曲线Fig. 1 Salting-out profile of protease
酶活力标准曲线:y=151.81x-1.582 4,R²=0.999 1。蛋白质量浓度标准曲线:y=0.507 2x+0.001 4,R²=0.999 7。由蛋白酶的盐析曲线(图1)可以看出,随着硫酸铵饱和度的增加,析出的蛋白酶活力呈现出增加的趋势,尤其是当硫酸铵饱和度达到70%、80%、90%时,酶活力分别达到(1 471.11±1.01)、(1 451.02±0.71)、(1 426.54±0.67) U/mL,但是比酶活并没有显著高于其他饱和度,故选用30%~90%饱和度进行分级沉淀,提高回收率。
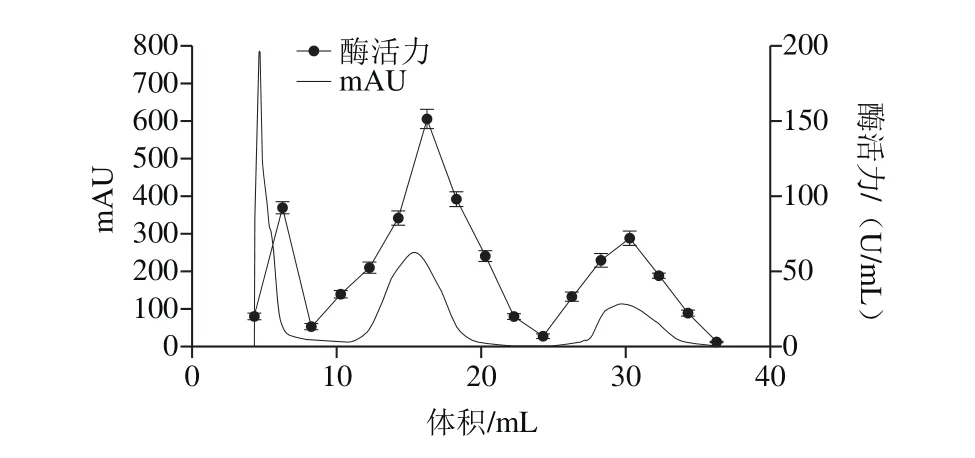
图2 蛋白酶的Q-HP洗脱曲线Fig. 2 Elution profile of protease on Q-HP column
如图2所示,检测各个峰的酶活力显示,第2个峰酶活力最高,达(151.51±4.41) U/mL,SDS-PAGE结果显示有2条明显条带,故收集合并第2个峰的酶液,使用30 kDa超滤离心管浓缩,进行下一步纯化。
如图3所示,凝胶层析分离效果较好,收集第1个峰的样品检测其具有蛋白酶活力,SDS-PAGE呈现单一条带。Li Caihong等[15]利用硫酸铵分级沉淀,离子交换柱和凝胶层析联合使用,从米曲霉FC76中纯化得到一种酸性蛋白酶。Rafael等[16]通过乙醇沉淀,凝胶层析和离子交换柱联合使用,从米曲霉中纯化出一种丝氨酸蛋白酶。也由此可以看出,离子交换柱和凝胶层析联合使用,是蛋白酶纯化过程中常用的技术手段。
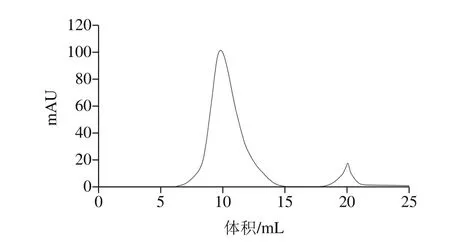
图3 蛋白酶的Superdux 75洗脱曲线Fig. 3 Elution profile of protease on Superdux 75 column
如表2所示,随着纯化步骤的增加,蛋白的比酶活和纯化倍数呈增长的趋势,Superdux 75凝胶层析后比酶活达到1 422.76 U/mg,纯化倍数为94.47,回收率为2.73%。
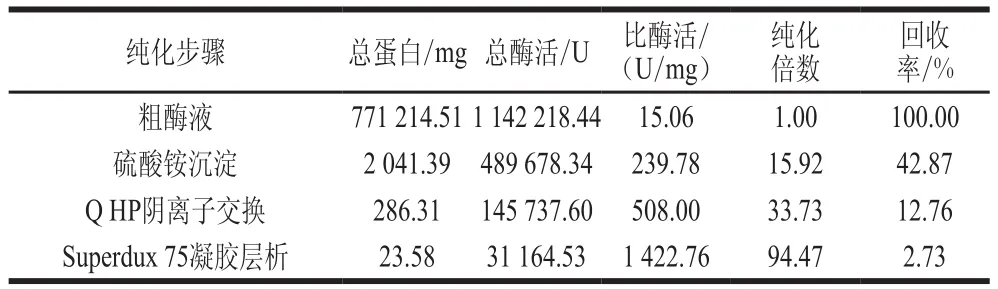
表2 蛋白酶纯化结果Table 2 Purification of the protease
2.2 蛋白酶SDS-PAGE分析
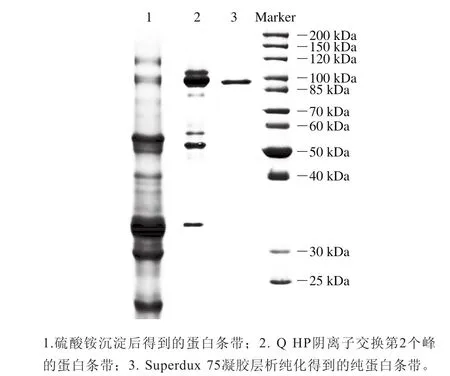
图4 蛋白酶的SDS-PAGE分析Fig. 4 SDS-PAGE analysis of the protease
由图4可以看出,纯化得到的蛋白酶达到电泳纯,分子质量约为93.33 kDa。
2.3 飞行时间质谱鉴定蛋白酶
飞行时间质谱鉴定该蛋白酶可能为钙蛋白酶RIM13(Gene ID:AO090005000756),是一种半胱氨酸蛋白酶,分子质量为88.89 kDa,该蛋白酶于2012年在米曲霉3.042中被鉴定[17]。米曲霉3.042中也曾纯化得到中性蛋白酶,分子质量分别为50 kDa[18]、27 kDa和58 kDa[19]、37 kDa和45 kDa[20]。钙蛋白酶RIM13首次从米曲霉3.042中分离得到,安全特性高,可以直接应用于酱油工业发酵。钙蛋白酶是一种信号蛋白酶,在碱性环境中,通过转录因子PacC,分泌碱性蛋白和异青霉素N-合成酶等,提高菌体在高pH值环境中的适应性[21]。半胱氨酸的活性中心是Cys-His-Asn三联体[22],应用广泛,也被用于降解乳品工业废弃物,如干酪乳清等[23]。
2.4 蛋白酶三级结构预测结果
蛋白酶在Swiss model中匹配到的结果是钙蛋白酶[24],GMQE值为0.33,该蛋白酶包含3 个肽段,分别为钙蛋白酶-2催化亚基、钙蛋白酶小亚基,钙蛋白酶抑制蛋白,以及10 个非共价的Ca2+配体(图5)。三级结构的表征更有助于从结构上验证该蛋白酶的性质。
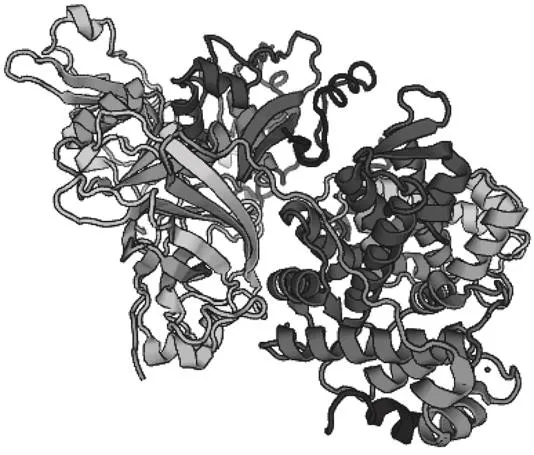
图5 蛋白酶的三级结构预测Fig. 5 Predicted tertiary structure of the protease
2.5 蛋白酶的酶学性质
2.5.1 蛋白酶的最适温度及温度稳定性
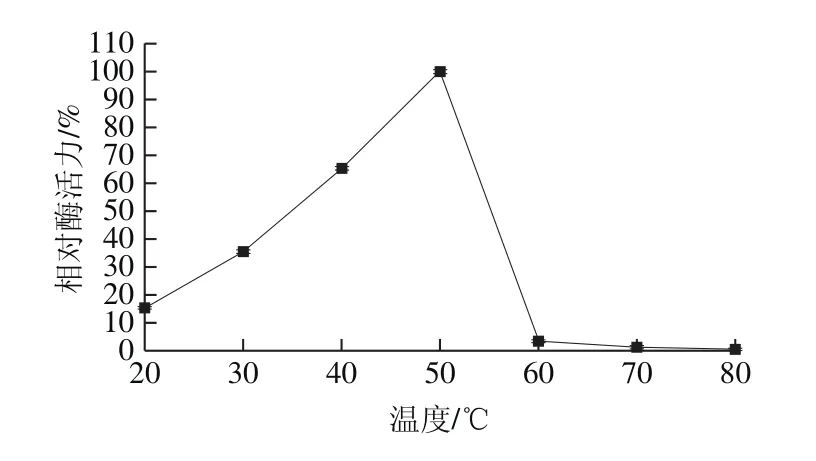
图6 蛋白酶的温度-相对酶活力曲线Fig. 6 Optimum temperature of the protease
如图6所示,在20~50 ℃,蛋白酶活力呈现增加的趋势,在50 ℃时酶活力最高,为(90.28±0.76) U/mL。当温度升至50 ℃以上时,酶活力迅速降低,80 ℃时酶活力降至(0.61±0.30) U/mL,这也表明此蛋白酶不耐高温,60 ℃以上酶几乎失活。如图7所示,该蛋白酶在35 ℃和40 ℃时蛋白酶保持较稳定,35 ℃和40 ℃保持100 min,酶活力分别保留
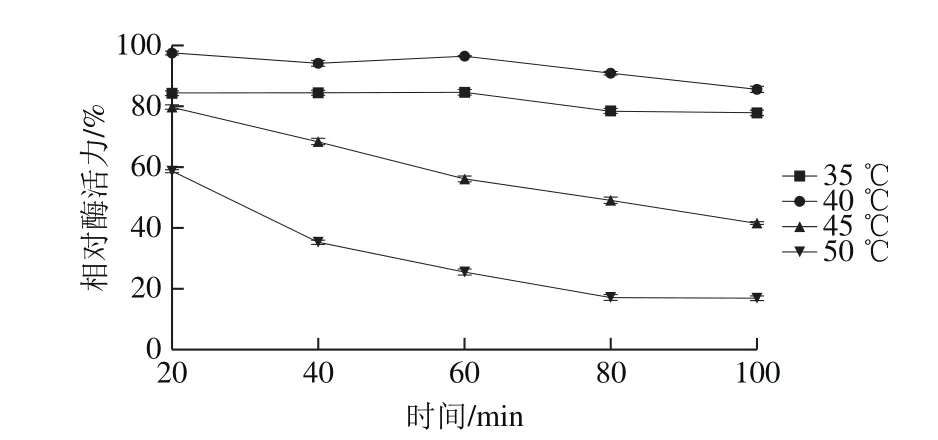
图7 蛋白酶的温度-相对酶活力稳定性曲线Fig. 7 Effect of temperature on the activity of the protease
77.96 %和85.70%。在45 ℃和50 ℃时随着保温时间延长,蛋白酶活力迅速下降,保温100 min后,酶活力分别保留41.70%和16.95%,表明该蛋白酶在此温度下不能稳定保存。
2.5.2 蛋白酶的最适pH值及pH值稳定性
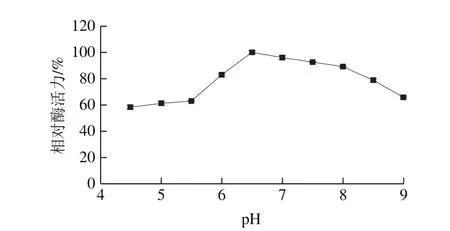
图8 蛋白酶的pH值相对酶活力曲线Fig. 8 Optimum pH profile of the protease
如图8所示,pH 4.5~6.5,酶活力呈现增加的趋势,pH 6.5时酶活力最高,达到(89.06±1.07)U/mL。当pH值继续升高时,酶活力呈下降趋势,在pH 9.0时酶活力下降至(58.70±0.70)U/mL,故此蛋白酶最适pH值为6.5。每一种酶均具有最适pH值,是由于Hofmeister效应,在不同pH值的体系中,酶表面的氨基基团和羧基基团的电荷分布受到影响,进而影响酶与底物的结合以及催化效率[25]。
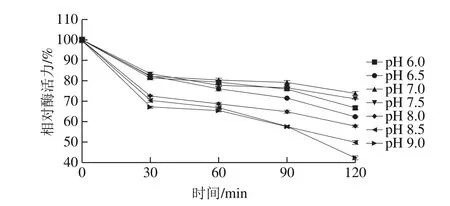
图9 蛋白酶的pH值-相对酶活力稳定性曲线Fig. 9 Effects of pH on the activity of the protease
将此蛋白酶在不同pH值,40 ℃水浴不同时间测定其酶活力,如图9所示,在不同pH值随着水浴时间延长,酶活力均呈现降低的趋势,蛋白酶在不同pH值保温120 min时,相对酶活力最高的是pH 7.0,然后依次是pH 7.5、6.0、6.5、8.0、8.5、9.0,故此蛋白酶属于中性蛋白酶。
2.5.3 金属离子对蛋白酶活力的影响
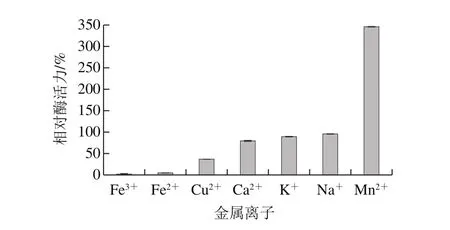
图10 金属离子对蛋白酶活力的影响Fig. 10 Effects of metal ions on the activity of the protease
如图10所示,Fe3+、Fe2+、Cu2+、Ca2+、K+和Na+对蛋白酶呈现出抑制作用,且呈现减弱的趋势。Mn2+对蛋白酶活力呈现促进作用,酶活力是不添加金属离子时的(3.46±1.07)倍。添加Ca2+时,蛋白酶的酶活力是不添加金属离子时的(0.80±0.1)倍,这可能是由于钙蛋白酶抑制蛋白与钙蛋白酶结合,降低钙蛋白酶活力。真菌中的中性蛋白酶,一般可以被金属离子螯合剂抑制[26]。
2.5.4 金属离子对蛋白酶二级结构的影响
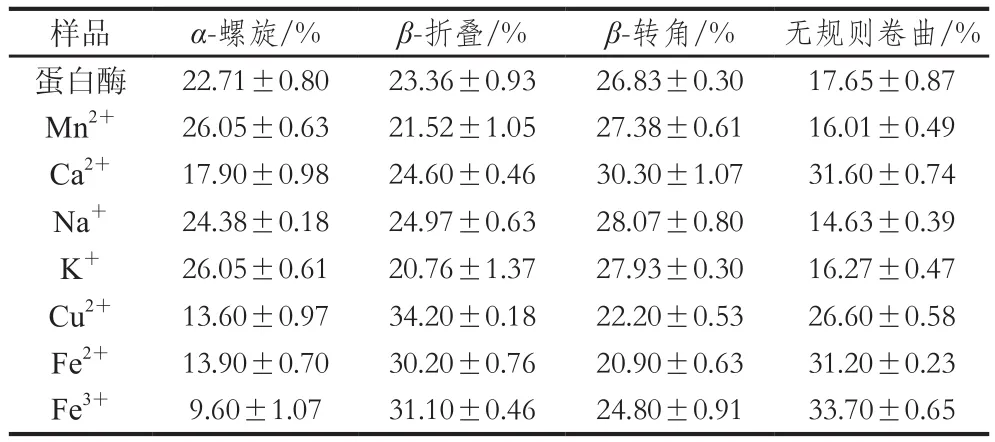
表3 金属离子对蛋白酶二级结构的影响Table 3 Effects of metal ions on the secondary structure of the protease
样品蛋白质量浓度为0.09 mg/mL,不同金属离子对蛋白酶结构的影响结果如表3所示,Mn2+促进蛋白酶活,使蛋白酶的α-螺旋增加,β-折叠减少,β-转角增加和无规则卷曲减少。可能这种结构变化促进蛋白酶与底物结合,使得蛋白酶呈现增加的趋势。Ca2+使蛋白酶的α-螺旋减少,β-折叠增加,β-转角增加和无规则卷曲增加。Na+是影响酶活的重要因素,Na+使蛋白酶α-螺旋增加,β-折叠增加,β-转角增加和无规则卷曲减少。K+、Cu2+、Fe2+也均使蛋白酶的结构发生不同程度的变化。Fe3+几乎完全抑制了蛋白酶的酶活,Fe3+使蛋白酶的二级结构发生很大的改变,其中α-螺旋由22.71%下降到9.60%,β-折叠增加了7.74%,无规则卷曲增加了16.05%,β-转角减少了2.03%,如此巨大的结构变化使得该蛋白酶的结构紊乱,酶活几乎丧失。米曲霉中一种中性蛋白酶在NaCl的环境中,半衰期增加,这是由于在高盐环境中中性蛋白酶的吉布斯自由能和活化能均升高的原因,同时,在加入NaCl后中性蛋白酶二级结构中的α-螺旋也发生明显变化。虽然高盐环境改变了蛋白酶原本的结构,但是半衰期的延长也具有一定的应用价值。2.5.5 蛋白酶的动力学特征
根据1/S-1/V的Lineweaver-Burk双倒数曲线(图11),计算得到蛋白酶水解酪蛋白时米氏常数Km为2.43 g/L,最大反应速率Vm为103.09 mg/(L·min)。Km值较低,表明此蛋白酶与酪蛋白亲和力较高,蛋白酶的活性中心容易与酪蛋白结合生成酶-底物复合中间体。
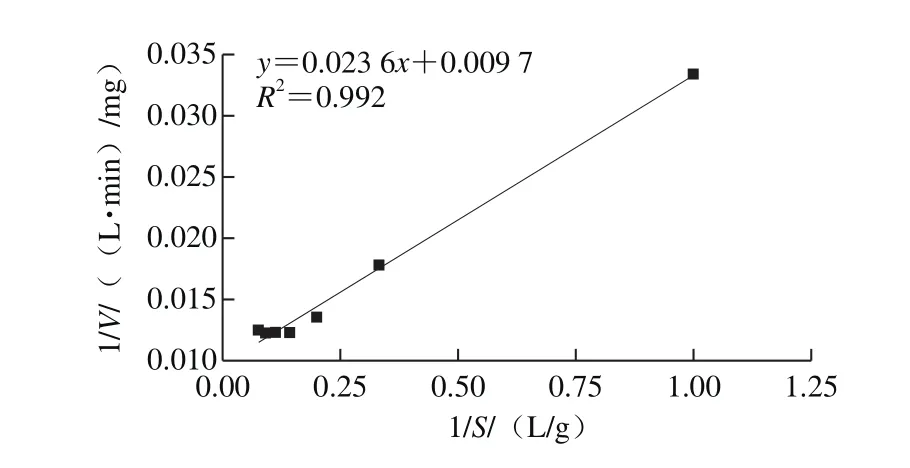
图11 蛋白酶的双倒数曲线Fig. 11 Lineweaver-Burk plot of the protease
2.5.6 蛋白酶的耐盐性
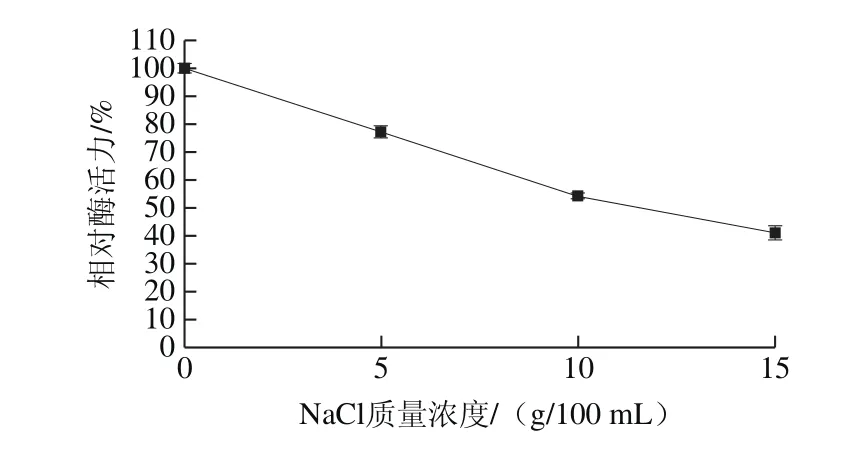
图12 盐度对蛋白酶活力的影响Fig. 12 Effect of salinity on the activity of the protease
由图12可知,随着NaCl质量浓度的上升,蛋白酶活力呈现下降的趋势,酶液中NaCl质量浓度分别为5、10 g/100 mL和15 g/100 mL时,相对酶活力分别为77.22%、54.39%和41.15%。盐度是影响酶活力的重要因素,酱油大曲中提取的粗酶液,在18% NaCl环境中酶活力仅能保持大约3%[27]。有学者从米曲霉LK-101中纯化得到一种耐盐蛋白酶,该蛋白酶在5、10 g/100 mL和15 g/100 mL NaCl环境中酶活力分别能保持80%、50%以及30%[12]。曲霉菌FC-10中纯化得到的耐盐蛋白酶,18% NaCl环境中酶活力能保持50%[28]。由此可以看出,该蛋白酶和已纯化得到的耐盐蛋白酶耐盐性相近,即使在高盐度的环境中也保持着较高的酶活。随着米曲霉基因组测序的完成,米曲霉分子遗传改造成效卓著,人溶菌酶和牛凝乳酶在米曲霉中异源表达,以及单个碱基的精准敲除或者插入[29]。因此,有望将此胞外耐盐蛋白酶进行过表达,或者异源表达,应用于酱油工业生产,改善酱油风味[30]。
3 结 论
钙蛋白酶RIM13首次从米曲霉3.042中分离得到,高盐环境中保持较高的酶活力。该蛋白酶的最适温度50 ℃;稳定温度40 ℃;最适pH 6.5;稳定pH 7.0。Mn2+促进蛋白酶活,Fe3+、Fe2+、Cu2+、Ca2+、K+、Na+抑制蛋白酶活力,以上金属离子对蛋白酶的二级结构也产生不同程度的影响;米氏常数Km为2.43 g/L,最大反应速率Vm为103.09 mg/(L·min)。在5、10 g/100 mL和15 g/100 mL的NaCl质量浓度下,保留的酶活力分别为77.22%、54.39%以及41.15%。该蛋白酶的酶学性质也表明,其适合应用于酱油酱醪发酵过程,在酱油工业发酵中具有很大的潜在应用价值。
