L-阿拉伯糖促进秀丽隐杆线虫的生长发育及降低脂肪合成
2019-01-07吴超王慧张晓伟秦海兰周兴华赵延胜
吴超,王慧,张晓伟,秦海兰,周兴华,赵延胜,
(1.江苏大学食品与生物工程学院,江苏镇江 212013)
(2.镇江出入境检验检疫局检验检疫综合技术中心,江苏镇江 212000)
L-阿拉伯糖又称L-树胶醛糖、果胶糖,其形态为白色结晶,对热和酸稳定,广泛存在于植物中如玉米皮、甘蔗渣[1]。L-阿拉伯糖具有很强的非竞争性抑制蔗糖吸收的功能,能够减少吸收蔗糖带来的血清中葡萄糖浓度升高,其甜度是蔗糖的一半,可作为一种新型的低热量功能型甜味剂[2]。已有研究表明,L-阿拉伯糖具有调节血糖吸收、降脂、促进肠道消化排毒、防止龋齿等功效[3],近年来不断被开发应用。
秀丽隐杆线虫是一种重要的模式生物,以大肠杆菌OP50为食。它具有结构简单、身体透明、易于观察、生命周期短、子代数目多等生物学特征[4],并与人类脂肪代谢路径相似,各关键步骤的酶相似度较高[5]。通过线虫的生理生化研究,有助于阐明并揭示食品中功能活性成分对健康的影响及作用机制。L-阿拉伯糖作为一种食品中重要的代糖来源,目前在模式生物线虫中的研究较少。因此,本试验拟通过研究 L-阿拉伯糖对秀丽隐杆线虫生长发育和脂肪合成能力的影响,为进一步探索开发其功能活性,并揭示其健康作用机制提供理论和试验基础。
1 材料与方法
1.1 材料与试剂
秀丽隐杆线虫N2野生型、大肠杆菌OP50由东南大学王大勇实验室惠赠;L-阿拉伯糖由山东汉糖生物科技有限公司提供;甘油三酯检测试剂盒购自南京建成生物工程研究所;油红O储备液、琼脂粉、NaCl粉末、胰蛋白胨、CaCl2、MgSO4、胆固醇、葡萄糖粉末、异丙醇均购自国药集团化学试剂有限公司。
1.2 试剂的配制
线虫裂解液:10%的次氯酸钠和1 mol/L的氢氧化钠按照1:1的比例混合,摇匀得到裂解液。M9缓冲液:称取KH2PO4粉末3 g、Na2HPO4粉末6 g、NaCl粉末5 g于锥形瓶内,量取1 mL的1 mol/L硫酸镁溶液加入,然后在磁力搅拌器上加水至1 L,高压灭菌后分装使用。油红O染液:油红O储备液与蒸馏水3:2混合,现配现用。上述配制的溶液均需过滤除菌。
1.3 主要仪器设备
体视显微镜,南京江南永新光学有限公司;多功能酶标仪,帝肯(上海)贸易有限公司;生化培养箱,上海科学仪器有限公司;高速离心机,江苏捷达离心机制造有限公司;恒温培养箱,上海科学仪器有限公司;高压灭菌锅,帝肯(上海)贸易有限公司;电子天平,沈阳科瑞永兴化玻仪器有限公司;一次性培养皿,青岛金典生化器材有限公司。
1.4 试验方法
1.4.1 含糖培养基的配制
(1)线虫生长培养基(Nematode Growth Media,NGM)的配制参照Brenner等[6]的方法:称取氯化钠3 g、琼脂粉17 g、胰蛋白胨2.5 g于锥形瓶中,加入975 mL蒸馏水混匀封口后放入高压灭菌锅内121 ℃灭菌50 min,待培养液温度降至60 ℃,依次加入1 mL浓度为1 mol/L的CaCl2、1 mL浓度为1 mol/L的MgSO4、1 mL浓度为5 mg/mL的胆固醇、以及25 mL浓度为1 M的K3PO4缓冲液,混匀后倒入无菌塑料培养皿。
(2)含葡萄糖的NGM培养基:将1 mol/L葡萄糖母液按照1:1000的比例加入NGM培养基内。
(3)含L-阿拉伯糖的NGM培养基:配制L-阿拉伯糖浓度分别为5、10、15、20、40 mmol/L,然后按1:1与线虫混合,再涂布到含葡萄糖的NGM培养基,得到L-阿拉伯糖的终浓度分别是2.5、5、7.5、10、20 mmol/L。
1.4.2 线虫的培养与同步化
在超净工作台上,将1 mL的大肠杆菌OP50涂布到配制好的NMG培养基上,然后自然干燥,放于4 ℃的冰箱内备用。将秀丽隐杆线虫接种于上述含有大肠杆菌OP50的NGM培养基中,培养温度为20 ℃,培养到产卵期。用2 mL M9缓冲液将大量处于产卵期的雌雄同体秀丽隐杆线虫成虫从NGM固体培养基表面冲洗下来并转移到1.5 mL EP管中,然后3000 r/min离心1.5 min,弃上清。向EP管中加入1 mL裂解液,上下颠倒混匀裂解5 min,3000 r/min离心1.5 min,弃上清,然后用无菌M9缓冲液反复清洗3次,充分去除裂解液成分,得到同步化后的虫卵[7]。
1.4.3 暴露方法
将同步化后的虫卵置于含有不同浓度的 L-阿拉伯糖并涂有大肠杆菌OP50的NGM培养基,和含有葡萄糖并涂有大肠杆菌 OP50的 NGM 培养基中,20 ℃恒温培养箱中培养48 h,此时秀丽隐杆线虫处于L4期,再养12 h可测定各项指标,同时进行三次平行试验。
1.4.4 生长发育指标的测定[8]
(1)头部摆动频率:将秀丽隐杆线虫置于含有60 μL M9缓冲液的载玻片上,等待其经过1 min的适应,行为恢复稳定后,在体视显微镜下观察并记录秀丽隐杆线虫的头部摆动频率。每个浓度测量20条秀丽隐杆线虫。头部摆动频率的标准为1 min内头部从一侧摆到另一侧再摆回来的次数。
(2)身体弯曲频率:将线虫置于表面未涂有大肠杆菌OP50的NGM培养基上,等待线虫恢复1 min以去除身体粘附的大肠杆菌,然后在体视显微镜下观察并记录秀丽隐杆线虫1 min内的身体弯曲频率。每个浓度测量20条秀丽隐杆线虫。一次身体弯曲的标准为假定沿着咽泵的方向是y轴,线虫爬行过程中身体沿着相应x轴方向上的一次改变。
(3)身体长度的测定:将线虫转移到载玻片上,经麻醉剂麻醉,置于显微镜下观察并测量身长。
(4)子代数目:在涂有大肠杆菌OP50的NGM培养基上挑1只待测的线虫,放置在20 ℃的培养箱内培养。在产卵期内每天将线虫转移到新的NGM培养基内,含有虫卵的旧平板继续放置在 20 ℃的培养箱内培养24 h,然后对每个平板内的线虫的数目进行统计、相加。等到线虫的排卵期结束后,计算每条线虫总的子代数目。
1.4.5 甘油三酯含量的测定
用M9缓冲液将线虫冲洗三遍,离心弃上清,加入150 μL M9缓冲液超声破碎虫体提取甘油三酯,超声条件:超声功率为100 W,工作时间为20 s,暂停时间为60 s,重复8个循环;或者采用匀浆器进行研磨:加入M9缓冲液使得总体积为300 μL,进行研磨,最后在倒置显微镜下取20 μL虫液观察线虫是否都已经破碎(研磨过程需冰浴)。线虫研磨充分后,将各浓度组研磨管置于 4 ℃离心机中 5000 r/min离心 10 min,将离心后上清液转移到1.5 mL离心管中。根据试剂盒说明测定甘油三酯含量。
1.4.6 油红O染色
油红O染色方法参照Ramirez等的染色方法[9],每个浓度组取生长至L4末期的线虫,用M9缓冲液将平板中的线虫洗脱于离心管中,转速为1500 r/min离心2 min去上清,重复洗脱三次;加入体积分数为60%的异丙醇,使线虫脱水,15 min后洗去异丙醇溶液;加入油红O染色30 min,用M9反复冲洗6次;将线虫转移到NGM平板上,随机挑取20只线虫置于载玻片上,显微镜下观察拍照。
1.5 统计分析
采用SPSS 12.0进行显著性分析,显著水平设定为*p<0.05、**p<0.01。
2 结果与讨论
2.1 L-阿拉伯糖对秀丽隐杆线虫生长指标的影响
2.1.1 L-阿拉伯糖对秀丽隐杆线虫头部摆动频率的影响
头部摆动频率是线虫运动能力的一项重要指标,将葡萄糖作为对照组,设置L-阿拉伯糖的浓度分别为2.5、5、7.5、10、20 mmol/L,研究不同浓度下秀丽隐杆线虫的头部摆动频率变化。结果如图1显示,当L-阿拉伯糖浓度为5 mmol/L时,线虫头部摆动频率出现显著性增加(p<0.05),与对照组相比增加了16.43%;当浓度在 7.5~20 mmol/L时,出现极显著性增长(p<0.01);与对照组相比,20 mmol/L组的头部摆动频率增加了19.72%;试验结果表明,L-阿拉伯糖对秀丽隐杆线虫的头部摆动频率有显著性促进作用。
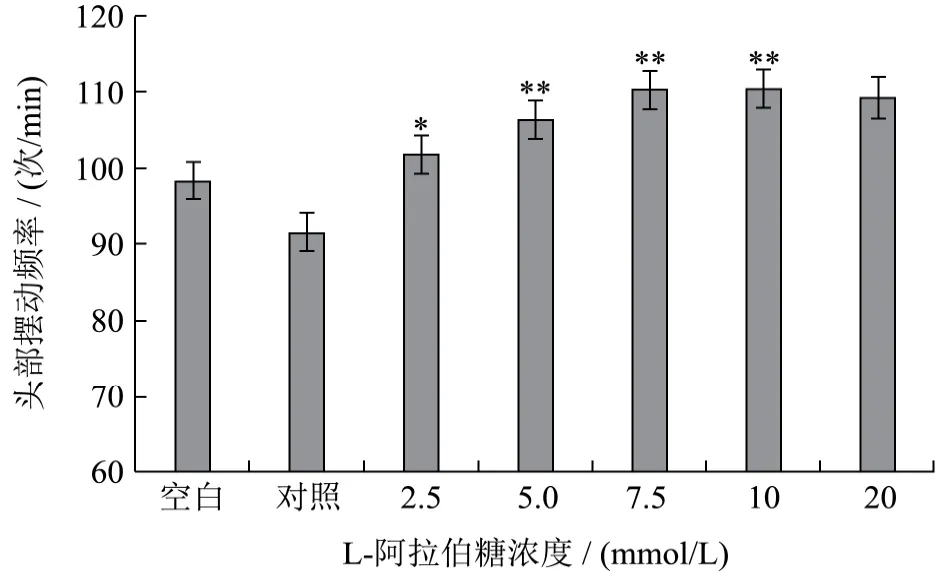
图1 L-阿拉伯糖对秀丽隐杆线虫头部摆动频率的影响Fig.1 Effect of L-arabinose on the head swing frequency of Caenorhabditis elegans
2.1.2 L-阿拉伯糖对秀丽隐杆线虫身体弯曲频率的影响
线虫身体弯曲频率的大小表明其运动能力的强弱。如图2所示,当L-阿拉伯糖浓度为2.5 mmol/L和10 mmol/L时,线虫身体弯曲频率稍有增长,相对于对照组分别增加了 7.32%、9.02%;随着 L-阿拉伯糖浓度的增加,线虫身体弯曲的频率保持相对稳定的水平状态。但统计分析结果表明,与葡萄糖对照组相比,L-阿拉伯糖对线虫身体弯曲频率的影响效果不显著(p<0.05,p<0.01)。
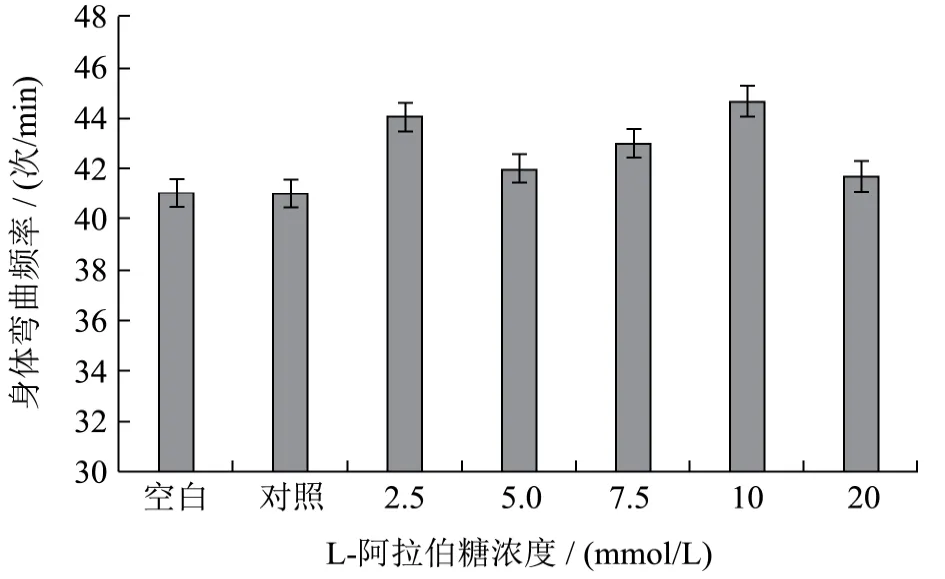
图2 L-阿拉伯糖对秀丽隐杆线虫身体弯曲频率的影响Fig.2 Effect of L-arabinose on body bending frequency of Caenorhabditis elegans
2.1.3 L-阿拉伯糖对秀丽隐杆线虫子代数目的影响
不同浓度 L-阿拉伯糖对秀丽隐杆线虫子代数目的影响结果如图 3所示,当 L-阿拉伯糖浓度为 2.5 mmol/L时,子代数目最多,相对于对照组增加了1.43%;但随着 L-阿拉伯糖浓度的增加,秀丽隐杆线虫的子代数目没有显著性的增加或减少(p<0.05,p<0.01),维持在一个较为稳定的水平,表明在现有浓度作用下,L-阿拉伯糖对秀丽隐杆线虫子代数目无显著影响。

图3 L-阿拉伯糖对秀丽隐杆线虫子代数目的影响Fig.3 Effect of L-arabinose on the brood size of Caenorhabditis elegans
2.1.4 L-阿拉伯糖对秀丽隐杆线虫身体长度的影响
如图4结果显示,与对照组相比,当L-阿拉伯糖浓度为2.5 mmol/L,线虫身体长度开始出现增长的状态,说明此时阿拉伯糖的浓度有促进线虫身体生长作用;当浓度达到7.5 mmol/L时,线虫身体长度增长明显(p<0.05),与对照组相比增加了 10.89%;当浓度大于7.5 mmol/L,与5 mmol/L浓度下的线虫身体长度相比无明显变化,维持在较为稳定的水平。
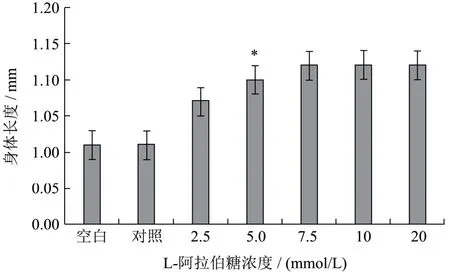
图4 L-阿拉伯糖浓度对秀丽隐杆线虫身体长度的影响Fig.4 Effect of L-arabinose on body length of Caenorhabditis elegans
2.2 甘油三酯含量的测定
甘油三酯是脂肪合成的重要原料,如果甘油三酯含量降低,将会导致脂肪合成的减少,从而达到降脂的效果。图5结果显示,在2.5~20 mmol/L浓度范围内,随着L-阿拉伯糖浓度的逐渐增加,与葡萄糖对照组相比,L-阿拉伯糖试验组中秀丽线虫体内的甘油三酯含量下降均极为显著(p<0.01);当L-阿拉伯糖浓度为2.5 mmol/L,相比于对照组其甘油三酯含量降低了45.56%;而当L-阿拉伯糖浓度为20 mmol/L时,线虫体内的甘油三酯含量与对照组相比降低了67.34%,说明L-阿拉伯糖具有良好的降低线虫脂肪合成的能力。

图5 L-阿拉伯糖对甘油三酯含量的影响Fig.5 Effect of L-arabinose on triglyceride contents
2.3 油红O染色
试验通过油红O染色检测分析了线虫体内脂肪的变化情况。图6结果可以直观的显示,试验组线虫的脂肪含量明显要低于对照组,且随着L-阿拉伯糖浓度的不断增加脂肪含量逐渐减少。这一试验结果和甘油三酯含量测定结果相同,进一步说明L-阿拉伯糖具有明显的降低脂肪合成作用,具有一定的降脂功效。

图6 油红O染色结果Fig.6 The results of oil red O staining
3 结论
随着 L-阿拉伯糖功能性质研究的深入以及生产成本的逐渐降低,其在食品、保健、医药等领域具有广阔的应用前景。本文通过研究不同浓度L-阿拉伯糖对秀丽隐杆线虫生长发育的影响,结果表明L-阿拉伯糖能够一定程度上促进秀丽隐杆线虫的头部摆动频率和身体的生长;已有研究报道指出,经L-阿拉伯糖作用后大鼠体重、空腹血糖、甘油三酯含量均有明显下降[10],L-阿拉伯糖对人体肠道血糖酶活性也有降低作用[11]。本研究通过线虫体内甘油三酯含量的测定和油红O染色试验,表明L-阿拉伯糖可能通过调控糖脂代谢相关基因从而降低线虫体内甘油三酯含量,导致了脂肪合成量的减少;李凯[12]研究报道了L-阿拉伯糖可通过上调控肝脏CPT-Iα、PDK4 mRNA的表达,下调ACCαmRNA的表达,使大鼠糖脂代谢改善、体重增加有延缓趋势。基于以上试验及其研究结果,可进一步通过分子生物学等手段,以秀丽隐杆线虫作为研究对象,继续探索并解析L-阿拉伯糖对生物体糖脂代谢等方面的调节机制,有助于明确L-阿拉伯糖这一重要代糖资源的生理功能及其健康促进功效。
