疏水改性藜麦淀粉的制备及其Pickering乳液乳化性研究
2019-01-07肖志刚时超杨柳秦新生杨庆余罗志刚
肖志刚,时超,,杨柳,秦新生,杨庆余,罗志刚,,3
(1.沈阳师范大学粮食学院,辽宁沈阳 110034)(2.华南理工大学食品科学与工程学院,广东广州 510641)(3.华南协同创新研究院,广东东莞 523808)
Pickering乳液是一种由固体颗粒代替小分子表面活性剂稳定乳液体系的新型乳液[1]。因其独特的稳定性,逐渐成为食品、化妆品、涂料、生物医药及石油开采等[2~7]领域的研究热点。通常用于稳定 Pickering乳液的是无机/合成颗粒[4],如二氧化硅,粘土和乳胶,其中食品级颗粒包括蛋白质[8]、纤维素[9]、脂质晶体[10]、类黄酮[11]、淀粉[12]等。与其他食品级颗粒相比,淀粉来源广,成本低,可降解,且生物相容性高,是制备食品级颗粒乳化剂的良好原料[12]。但是原淀粉含有较多的亲水性羟基,单独作为颗粒乳化剂乳化效果一般,且乳液稳定性较差。需要将其进行疏水化修饰以增加其润湿性。辛烯基琥珀酸(Octenyl Succnic Anhydride,OSA)改性是一种常用的疏水化修饰手段,改性后得到的辛烯基琥珀酸淀粉酯(OSA淀粉)引入了亲水性的羧酸基团和疏水性的烯基长链,在制备乳液时亲水的羧酸基团会伸向水相中,疏水的辛烯基长链会伸入油相中,而复杂的多糖长链会在油水界面上展开,形成一层连续、致密且厚实的不易被破坏的界面膜。
Yusoff等[13]的研究表明 OSA改性的蜡质玉米淀粉、木薯淀粉可用于稳定Pickering乳液,但其在制备乳液前需要冷冻研磨降低其颗粒的尺寸,然后再通过喷射均化器制备乳液,工艺复杂且耗能较大。藜麦淀粉提取自藜麦种子(苋科藜属双子叶假谷物,淀粉含量约58.1%~64.2%),目前基本由实验室制备而得,颗粒的粒径多数分布在0.4~2.0 μm范围内,小于其他植物来源的大多数淀粉[14],如玉米淀粉大米淀粉 3~8 μm、5~25 μm、马铃薯淀粉15~100 μm,是用来做颗粒乳化剂的良好选择,因此藜麦淀粉具有很高的商业化生产潜力。Rayner等[7]曾针对藜麦淀粉与大米、玉米、水稻、蜡质大麦和高直链淀粉玉米稳定的Pickering乳液进行了研究,对比研究发现原藜麦淀粉比其他类型淀粉更稳定。藜麦淀粉颗粒较小,可作为颗粒乳化剂稳定食品级Pickering乳液。经疏水改性后具有较好的界面特性,可提高定乳液的稳定性。目前有关以藜麦OSA淀粉稳定的Pickering乳液的深入研究较少。
本研究通过红外光谱(FTIR)分析OSA基团是否成功接到淀粉链上,通过扫描电子显微镜(SEM)分析对比原淀粉与 OSA淀粉形态的差异。选取不同取代度、颗粒浓度及油相比例等因素,以乳液的体积平均直径粒径(d4,3)和乳化指数(EI)为考察指标,研究上述因素对 OSA淀粉颗粒制备乳液的乳化性影响。
1 材料与方法
1.1 材料与试剂
藜麦购买于沽源县天然园农场;辛/癸酸甘油酯(MCT),印度尼西亚Britz Networks Sdn. Bhd.;尼罗红,阿拉丁试剂有限公司,其它化学试剂均为国产分析纯,实验所用水为二级蒸馏水。
1.2 仪器与设备
光学显微镜OLYMPUS BX51,日本株式会社;高速剪切机T25,IKA艾卡(广州)仪器设备有限公司;扫描电镜ZEISS EVO18,德国卡尔蔡司;傅立叶红外光谱仪Vector 33-MIR,德国 Brukev Optik;激光粒度仪 Malvern 2000,英国马尔文仪器有限公司;TDL-5-A离心机,上海安亭科学仪器厂。
1.3 实验方法
1.3.1 藜麦淀粉的制备[15]
将藜麦种子磨成粉末,过100目筛,取筛下物放入烘箱烘干备用。称取适量预处理后的藜麦粉并将其与0.20%的NaOH溶液按照1:5的比例混合,搅拌3 h后,静置18 h。将混合物于4000 r/min离心10 min,去上层黄色蛋白质沉淀和下层灰色沉淀,留中间白色淀粉反复离心、洗涤,调pH至中性,继续洗涤至上层无黄色沉淀为止。最后将产物置于 40 ℃烘箱中干燥48 h,粉碎,过100目筛后封袋保存。
1.3.2 OSA淀粉的制备[16]
取10 g藜麦淀粉(干基),加入适量蒸馏水配成30%的淀粉乳,装入250 mL三口烧瓶,置于30 ℃水浴锅磁力搅拌;分别称取一定量的OSA(添加量分别为淀粉干基的1%、3%、5%,W/W)溶于2.5 mL无水乙醇,一边搅拌一边加入淀粉乳中,于1 h内加完。搅拌反应过程中,用质量分数为3%的NaOH调控pH在8.0~8.5范围内。反应2 h后,用质量分数为3%的HCl调节pH=6.5终止反应。将所得产物离心,条件为4000 r/min,10 min,留下层沉淀用80%的乙醇洗涤3次,干燥,粉碎得到OSA淀粉。
1.3.3 取代度测定[17]
精确称取5.000 g OSA淀粉,置于250 mL烧杯中,用约5 mL异丙醇润湿。加入盐酸-异丙醇溶液25 mL淋洗烧杯壁上的试样,磁力搅拌30 min。再加入100 mL 90%异丙醇溶液,搅拌10 min,经布氏漏斗过滤试样,用90%异丙醇溶液淋洗至洗出液无氯离子(用0.1 mol/L硝酸银溶液检验)。将滤液移入500 mL烧杯,用90%异丙醇溶液仔细淋洗布氏漏斗,洗液并入烧杯,加水至300 mL,置于沸水浴中加热搅拌10 min,趁热用0.1 mol/L氢氧化钠溶液滴定至酚酞终点原藜麦淀粉为空白对照。
OSA基团的含量以质量分数w2计,数值以%表示,按下述公式计算:
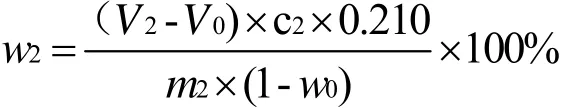
式中:V2:滴定试样消耗的氢氧化钠溶液的体积,单位为毫升(mL);V0:滴定空白消耗的氢氧化钠溶液的体积,单位为毫升(mL);c2:氢氧化钠溶液的浓度,单位为摩尔每升(mol/L);0.210:辛烯基琥珀酸基团的毫摩尔质量,单位为克每毫摩尔(g/mmol)[M(C12H18O3)=210];m2:待测样品的质量,单位为克(g);w0:待测样品实际测得的干燥减量,%。
实验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测试结果的绝对差值不大于5%。
1.3.4 Pickering乳液的制备[7]
称取一定质量的不同取代度的 OSA淀粉(取代度分别为 0.82%、1.43%、3.12%),用磷酸盐缓冲溶液(5 mM pH为7.0)将淀粉颗粒配制成2.5%、5.0%、7.5%、10%(W/V)的淀粉颗粒分散液(浓度相对于水相体系),用高速剪切机处理以15000 r/min处理30 s,之后添加不同油相比例(0.1、0.2、0.3、0.4、0.5)的MCT油相,用高速剪切机处理40 s,剪切机转速为20000 r/min,分两次进行,每次20 s,中间间隔1 min,将制备好的乳液保存在25 mL拇指瓶中。以原淀粉作为参照。
1.4 淀粉颗粒的分析表征
1.4.1 傅里叶红外光谱
使用压片法对原淀粉和 OSA淀粉颗粒的结构进行鉴定。将样品与光谱纯的溴化钾(KBr)按照质量比为100:1混合,将混合物于玛瑙研钵中充分混合后用压片机压成薄片,用FTIR光谱仪进行光谱扫描,扫描范围4000~500 cm-1分辨率4 cm-1,扫描次数32次。
1.4.2 扫描电子显微镜
将原淀粉和 OSA淀粉固定在导电胶上,用洗耳球吹去导电胶上多余的样品,使样品均匀分散;把样品放在镀膜台上喷金300 s,用扫描电子显微镜放大到适合的倍数察看,加速电压10.0 kV并拍摄具备代表性的淀粉颗粒形貌,每个试样选取多点进行观察拍照。
1.5 乳液的分析表征
1.5.1 光学显微镜
取40 μL经过稀释的乳液样品滴在载玻片上,小心盖上盖玻片,确保盖玻片和载玻片中间没有气泡。用奥林巴斯光学显微镜观察乳液的显微结构(目镜10倍,物镜40倍)。将制备好的样品放置在显微镜下观察,物镜放大10和20倍数,找到有代表性的物象后,用显微镜附带的相机拍照。
1.5.2 乳滴粒径的测定
采用Malvern 2000粒度分布仪测定乳滴的粒径大小,乳滴粒径以体积平均直径d4,3表示。参数设置为:颗粒折射率:1.540;颗粒吸收率:0.1;分散剂:水;分散剂折射率:1.330;泵的转速:2500 r/min。
1.5.3 乳液乳化指数的测定
将新制备的乳液静置于室温(25 ℃)环境下,放置1 d对样品进行观察,记录乳液分层后乳化层的高度。
乳化指数(Emulsion Index,EI)计算公式为:
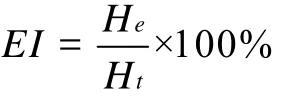
式中:He:乳液乳化层高度(cm);Ht:乳液总高度(cm)。
1.6 数据统计与分析
2 结果与讨论
2.1 傅里叶红外光谱结构分析

图1 原淀粉和OSA淀粉(取代度为1.43%)颗粒的红外吸收图谱Fig.1 FT-IR spectrum of the native starch and modified starch granules (DS of 1.43%)
图1为原淀粉和OSA淀粉(取代度为1.43%)颗粒的红外吸收图谱。由图1可知,原淀粉在3387 cm-1和2932 cm-1处的特征吸收峰,分别由O-H伸缩振动和C-H的伸缩振动产生。在1647、1150、1102 cm-1处明显的特征吸收峰,分别由淀粉内的结合水和C-O的伸缩振动产生[18]。1078 cm-1处的吸收峰是仲醇羟基相连的C-O的伸缩振动。对比原淀粉与OSA淀粉的红外图谱发现,OSA淀粉在1570 cm-1处出现RCOO-的不对称伸缩振动,这说明淀粉经改性处理后成功引入了新官能团即 OSA基团,并以酯键的形式与淀粉分子相连,且在 1730 cm-1处出现新的吸收峰(1710~1740 cm-1是酯羰基-C=O的特征吸收区域),说明OSA基团与藜麦淀粉发生了酯化反应。
2.2 藜麦淀粉颗粒形貌分析
原淀粉与不同取代度 OSA淀粉颗粒形貌的扫描电镜图(均放大50000倍)如图2所示。从图2可以看出,藜麦原淀粉颗粒呈不规则的多边形,有棱角,表面略光滑,有少许破损痕迹,但颗粒基本完整。对比a与b、c、d发现,OSA淀粉与原淀粉相比,尽管颗粒表面更粗糙,但淀粉的颗粒结构没被破坏。OSA对淀粉颗粒的疏水化修饰作用先发生在淀粉颗粒的表面,很少破坏淀粉颗粒的内部结构[19]。藜麦淀粉颗粒粒径主要分布在1.1~5.0 μm,平均粒径为2.3 μm,属于小颗粒淀粉。这与翟娅菲等[20]描述的从藜麦种子中提取的淀粉平均粒径分布1.15~1.97 μm相似,因藜麦产地不同,提取得到的淀粉理化性质会有部分差异。

图2 原淀粉与OSA淀粉颗粒形貌Fig.2 SEM micrographs of the native starch and modified starch granules
2.3 不同因素对乳液乳化性的影响
2.3.1 取代度对乳液乳化性的影响
选取10%淀粉颗粒浓度(W/V),OSA淀粉颗粒取代度分别为0%、0.82%,1.43%,3.12%,添加一定量的缓冲液配制淀粉颗粒分散液,油相比例为0.5,制备乳液,乳化方法同1.3.4。
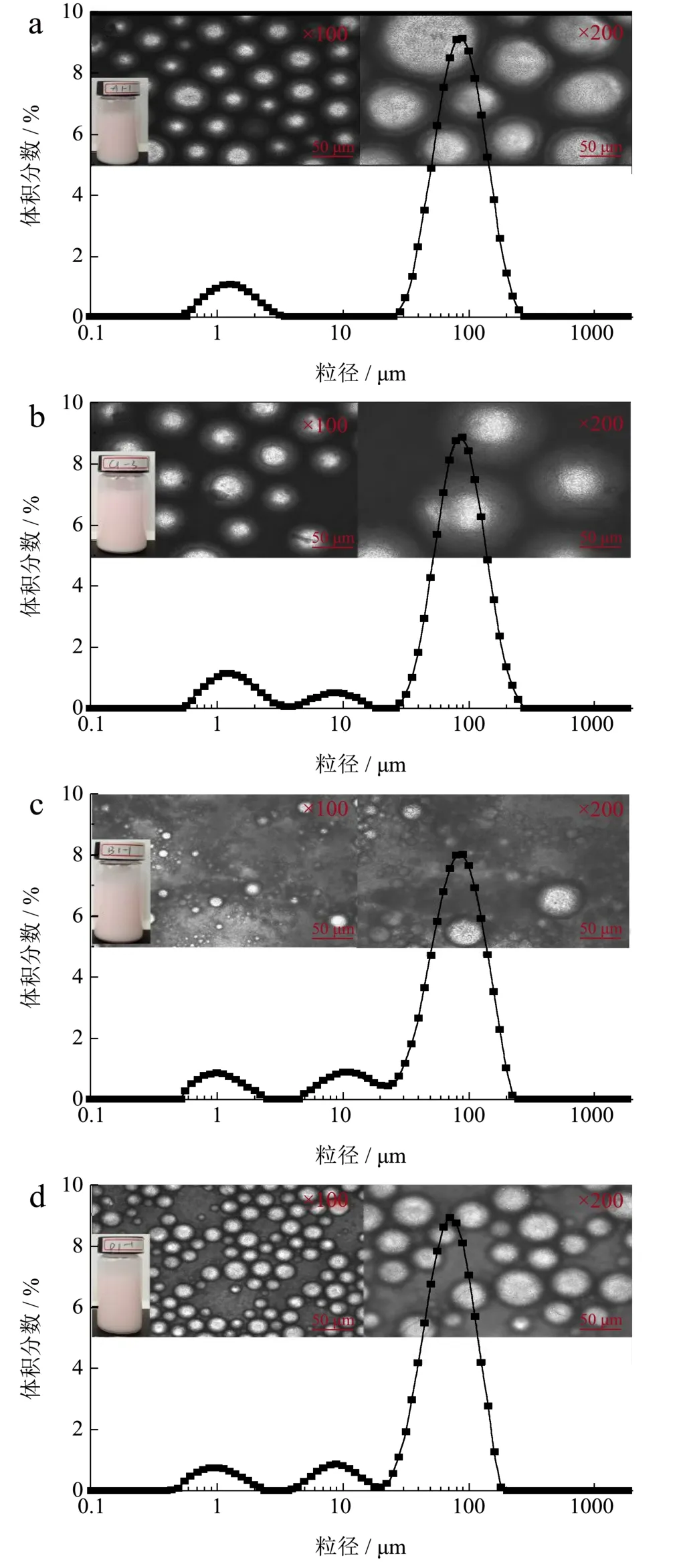
图3 不同取代度淀粉颗粒制备的乳液的微观结构及乳滴粒径分布Fig.3 Particle size distribution and microstructure of emulsionprepared with different degree of starch particles
从图3乳液的微观结构可看出,原淀粉可以稳定乳液,但其乳滴粒径大于 OSA淀粉颗粒稳定的乳液乳滴粒径。这主要是因为 OSA改性后,随着取代度的提高,颗粒表面的疏水性增强,颗粒的疏水部分可以更多的探入到油滴内部,在剪切乳化的过程中,只需少量的颗粒即可稳定乳滴,因此形成的乳滴的粒径会更小。对于原淀粉颗粒而言,因未经疏水改性其表面的疏水性较差,与油滴接触时颗粒与油滴接触面积小,只能达到瞬时稳定的效果,放置一段时间后,油滴与油滴之间极易絮凝进而导致乳滴变大。结合图 2改性淀粉的颗粒形貌可知,OSA改性后的淀粉颗粒表面比原淀粉粗糙,淀粉颗粒大小介于0.2~5.0 μm之间,在界面处具有一定的厚度,颗粒吸附存在障碍和需要非常高的解吸能量,这一点不同于表面活性剂和蛋白等粒度极小的纳米级乳化剂,它们的颗粒吸附到油水界面速度快,所需能量小,同时需要的解吸能量也低,因此稳定时间不长[21~24]。由粒径分布可以看出,原淀粉与OSA淀粉的粒径分布在0.2~5.0 μm的范围内均出现峰,且峰的分布范围与淀粉颗粒大小分布基本一致,这说明在乳液体系中有小部分淀粉颗粒因为吸附量过饱和没有与油滴充分结合形成Pickering乳液。而随着取代度的增加乳滴在5~40 μm有部分分布,且随着取代度的增加这部分峰的峰值由0.52增至0.86,说明在油相比例不变的情况下,取代度的提高有利于在乳液乳化过程中小乳滴的形成。由图4可知,随着淀粉取代度的增加,乳滴粒径逐渐减小,当取代度达到3.12%时,乳滴粒径由原淀粉的89.47 μm减小到69.36 μm,下降显著。原淀粉的EI值为69.33%,随着取代度的增加,EI值也随之增加,当取代度为1.43%时EI值为70.67%,当取代度达到3.12%时EI值为88.33%,增长显著。虽然取代度为 3.12%时,乳液的乳化效果最好,但在国家食品添加剂标准中要求 OSA基团的含量不超过 3%,因此后续试验选择取代度为 1.43%的淀粉颗粒进行研究。
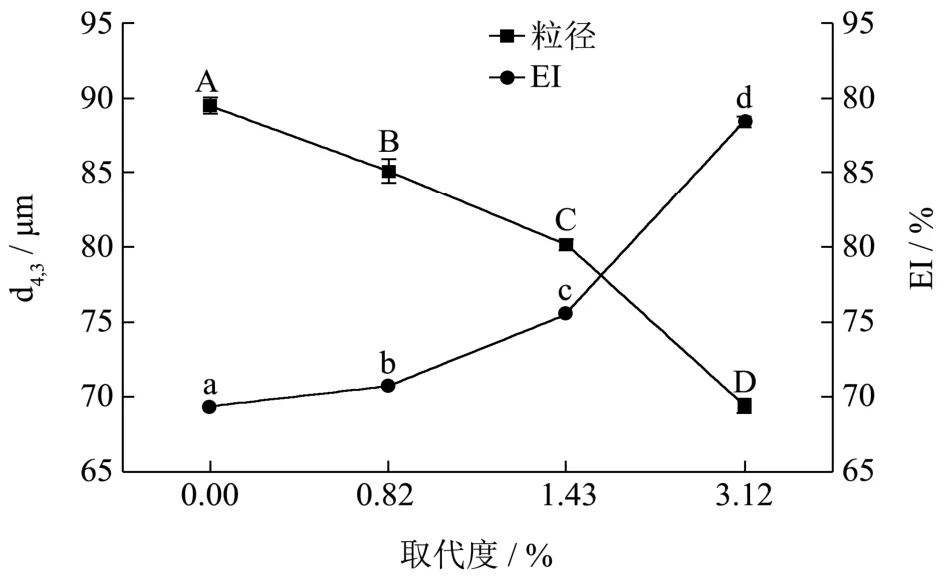
图4 不同取代度对乳滴粒径与乳液乳化性的影响Fig.4 Effect of different degree of substitution on particle size and emulsifying properties
2.3.2 颗粒浓度对乳液乳化稳定性的影响
选取淀粉颗粒浓度分别为 2.5%、5.0%、7.5%、10.0%(W/V),OSA淀粉颗粒取代度为1.43%,添加一定量的缓冲液配制淀粉颗粒分散液,油相比例为0.5,制备乳液,乳化方法同1.3.4。
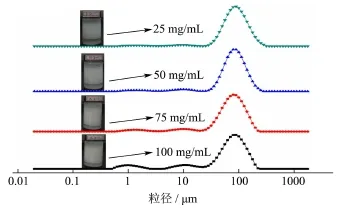
图5 不同淀粉颗粒浓度制备的乳液的乳滴粒径分布Fig.5 Particle size distribution of emulsion prepared by different starch granule concentrations
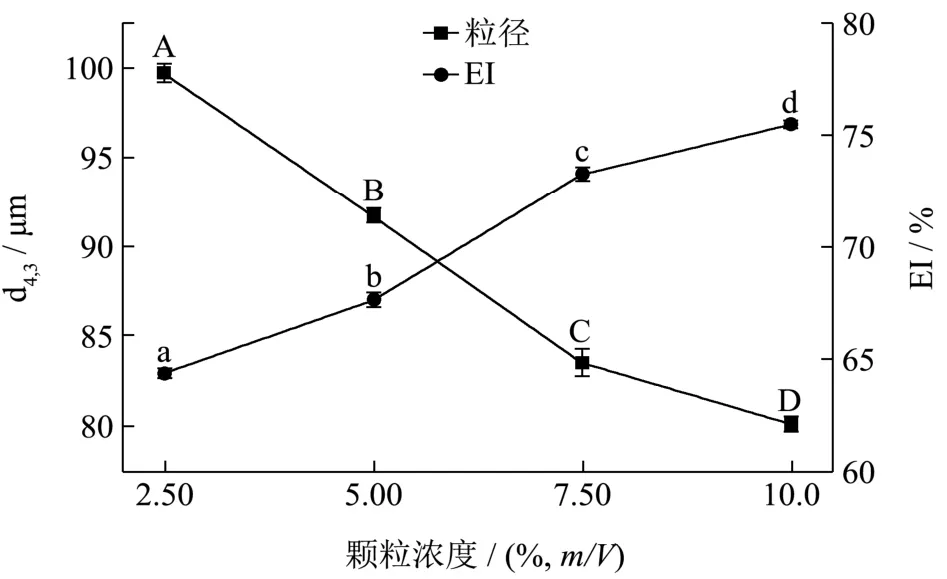
图6 不同颗粒浓度对乳滴粒径与乳液乳化性的影响Fig.6 Effect of particle concentration on emulsion particle size and emulsifying properties
结合图5、图6可知,随着淀粉颗粒浓度增加,乳滴粒径分布范围向更小的方向平移,这是因为随着水相中颗粒增多,淀粉颗粒在油/水界面吸附量增加,引起界面张力降低,使得包裹的油相表面积随之增加,当包裹相同比例的油相时,比表面积的增加表现为乳滴粒径变小。由图6知,随着淀粉颗粒浓度的增加,乳液的EI值增大,当淀粉颗粒浓度小于7.5%时,EI值显著增加;当淀粉颗粒浓度大于 7.5%时,EI值增加缓慢。乳滴粒径随淀粉颗粒浓度增加而减小,当淀粉颗粒浓度小于7.5%时,乳滴粒径显著减小;当淀粉颗粒浓度大于7.5%时,乳滴粒径降低的幅度较小。表明体系中淀粉颗粒浓度达到7.5%时,淀粉颗粒大部分均吸附于油水界面,继续提高颗粒浓度,颗粒与界面的吸附达到饱和,过量的颗粒进入连续相中,水相黏度逐渐增加,乳液呈凝胶状,阻止乳液分层、絮凝或聚集,乳液稳定性明显增强[25]。故随着颗粒浓度的增加,EI值的增加及乳滴粒径的减小均趋于缓慢。前人在有关不同颗粒乳化剂稳定 Pickering乳液的研究中也有类似的发现,无机颗粒如二氧化硅[4];有机颗粒如蛋白[8]、淀粉[12]、纤维素[9]等。
2.3.3 油相比例对乳液乳化性的影响
选取淀粉颗粒浓度分别为10%(m/V),OSA淀粉颗粒取代度为 1.43%,添加一定量的缓冲液配制淀粉颗粒分散液,油相比例分别为0.1、0.2、0.3、0.4、0.5,制备乳液,乳化方法同1.3.4。
由图7可知,随着油相比例的增加,乳滴的粒径分布变化较大,其中0.2~5.0 μm处峰面积显示出由大变小的趋势,这说明随着油相比例增大,稳定油滴需要更多的淀粉颗粒吸附在油水界面上,原本过饱和的淀粉颗粒被利用;5.0~25 μm 处峰面积下降迅速,说明体系中油相比例增加使得乳滴的粒径分布向较大值方向移动,在图8中表现为d4,3随油相比例增大而逐渐增大,EI值也随之增大,乳化性增加显著。结合图7、图8可知,当乳液体系中油相比例增加时,单位界面膜上淀粉颗粒的浓度减小,体系在高速剪切下通过降低比表面积(液滴体积变大)来完成乳化[25]。当油相比例达到0.4后,EI值增势趋缓,这与Timgren A等[26]的研究一致。
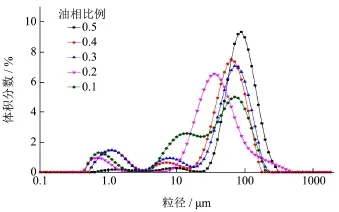
图7 不同油相比例制备的乳液的乳滴粒径分布Fig.7 Particle size distribution of emulsion prepared by different oil fraction

图8 不同油相比例对乳滴粒径与乳液乳化性的影响Fig.8 Effect of oil fraction on emulsion particle size and emulsifying properties
3 结论
原藜麦淀粉粒径较小,尺寸分布较均匀,但乳化性不佳。经过 OSA改性后的淀粉颗粒因引入了疏水基团,使得其制备的Pickering乳液乳化性增强。并且使用少量 OSA淀粉颗粒即可得到乳化稳定性较好的乳液,随着取代度或 OSA淀粉颗粒浓度的增加,乳滴粒径呈现减小的趋势,EI值呈现增大的趋势,乳液乳化稳定性性得到提高。随着油相比例的增加,乳滴粒径增加显著,当油相比例为0.5时制备的乳液的乳化性较好。OSA改性的藜麦淀粉可作为一种新型食品级颗粒乳化剂用于提高乳液乳化性,在食品结构修饰及活性成分包埋方面有潜在的应用价值。
