辣木多肽对LPS所致Caco-2细胞间高通透性的保护作用
2019-01-07宋家乐钱波王程强曾榛雷少玲黄傲
宋家乐,钱波,王程强,曾榛,雷少玲,黄傲
(1.桂林医学院公共卫生学院,广西高校预防医学重点实验室,广西桂林 541000)(2.广西肽王生物科技有限公司,广西桂林 530000)(3.广西民族大学相思湖学院,广西南宁 530008)
肠黏膜屏障生理功能的异常是导致炎症性肠病(inflammatory bowel disease,IBD),肠应激综合征(irritable bowel syndrome,IBS)及肠道肿瘤发生的重要原因之一[1,2]。肠上皮细胞和细胞间紧密连接所构成肠上皮结构在防止病原微生物侵入,阻隔外源有害物质进入血液循环系统,防止细菌移位等方面具有重大意义[3]。临床观察发现,IBD、IBS以及肠道肿瘤患者的肠上皮组织中细胞间紧密连接结构遭受破坏,上皮细胞通透性增大,肠黏膜屏障损毁严重并由此能够引发严重的并发症[4]。因此,改善肠上皮功能,维持细胞间紧密结构完整则有助于改善IBD、IBS以及肠道肿瘤患者的临床症状[5]。
辣木(Moringa oleifera)属辣木科辣木属多年生热带落叶乔木,广泛分布于亚洲南部热带地区,非洲热带以及部分亚热带地区,目前已被国家认定为一类新资源食品。在我国的广东、广西、台湾、云南等地均形成了具有一定规模的栽培种植[6~9]。特别是广西壮族自治区的百色、崇左和武鸣等地在当地政府的重点支持下已经开展了辣木的规模化种植,并形成一定的产业规模[6,10]。近年来,由于活性多肽类物质其本身所具有的抗菌、抗炎、抗氧化、抗衰老和免疫调节等诸多生物活性而成为实现可持续性农业和生物综合利用研究热点以及开发利用的重点[11]。当前,对于辣木的研究主要集中在辣木叶提取物以及辣木叶多糖等方面,而对辣木多肽的研究还不多见[7,9]。特别是,就辣木多肽提取物对于肠道功能的调控效果,尤其是对受损肠道上皮细胞高通透性保护作用的研究鲜见报道。人结肠癌 Caco-2细胞是一株具有与正常小肠上皮细胞类似的紧密连接、微绒毛等结构而被公认用于肠道屏障损伤与修复机制研究的经典细胞系[12]。因此,本研究在基于LPS处理所制备的Caco-2肠上皮细胞高通透性模型中探讨辣木多肽对细胞高通透性的保护效果及作用机制。
1 材料与方法
1.1 材料与试剂
DMEM高糖型细胞培养液、青霉素-链霉素双抗、胰蛋白酶-EDTA消化液、胎牛血清(fetal bovine serum,FBS)、四甲基偶氮唑蓝(methyl thiazolyltetrazolium,MTT),美国 Thermo Scientific公司;Trizol试剂、OligodT18、RNase、dNTPs、MLV 逆转录酶,美国Invitrogen公司;ROX reference Dye和SYBR Premix Ex Taq II,大连宝生物工程公司;异硫氰酸荧光素(FITC)-右旋糖酐(FD40,分子量40000 Da)、大肠杆菌脂多糖(LPS),美国Sigma-Aldrich公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒,南京建成生物工程研究所;IL-1β、IL-8、TNF-α试剂盒,美国Cloud colon公司;其他化学试剂均为国产分析纯。辣木多肽(MOPP)由广西肽王生物科技股份有限公司提供。
1.2 仪器与设备
Biotek Elx808酶标仪,美国伯腾仪器有限公司;ND2000超微量核酸蛋白测定仪、3110型二氧化碳细胞培养箱,美国Thermo Scientific公司;AL204电子分析天平,梅特勒-托利多公司上海有限公司;电热恒温水浴锅 HWS-28,上海一恒科学仪器有限公司;FLUOstar OPTIMA荧光酶标仪,德国BMG公司;MERS00002 Millicell-ERS上皮跨膜细胞电阻仪,美国Millipore公司。
1.3 细胞培养与分组
Caco-2人结肠腺癌细胞(源自中国科学院上海细胞资源中心)系由桂林医学院生物技术学院邹先琼教授馈赠,本研究室保种传代。DMEM高糖型细胞培养液(含10% FBS与1%青-链霉素双抗液)置于37 ℃、5% CO2环境下湿化培养。细胞贴壁长至80%时,胰蛋白酶-EDTA液按比例消化传代后用于实验。DMEM培养液(含LPS:2 μg/mL)处理细胞24 h制备细胞模型。模型细胞以辣木多肽(10 μg/mL、50 μg/mL、100 μg/mL、150 μg/mL)继续培养24 h并进行后续实验。正常组为未经过任何处理的正常Caco-2细胞。
1.4 细胞存活率及LDH脱氢酶水平测定
细胞按前述分组处理后,移除内培养基(用于后续LDH酶活性测定)并加入100 μL的MTT试剂(终质量浓度:0.5 mg/mL)继续培养24 h。培养结束后弃上清液,每孔加入DMSO (100 μL)避光振荡30 min,测定OD490nm后按公式:细胞生存率(%)=OD样品组/OD正常组×100来计算细胞生存率。LDH脱氢酶水平采用比色试剂盒按照说明书操作要求进行测定。
1.5 IL-1β、IL-8、TNF-α 分泌水平的测定
细胞接种到培养板并依前述方法处理后,4 ℃下收集细胞培养上清液。取适量培养上清液按照IL-1β、IL-8、TNF-α测定试剂盒说明书步骤操作(单位以pg/mL表示)。
1.6 模型细胞的膜通透性水平测定
依前述处理后的细胞接种至Transwell小室中,实验前测定跨上皮细胞电阻(trans epithelialelectrical resistance,TEER)检查细胞融合状态和肠上皮屏障的完整性,取细胞屏障完整的细胞(TEER≥100 Ω.cm2)用于实验。移除Transwell小室内外的培养液,HBSS液(pH 7.4)冲洗细胞3次,37 ℃孵育30 min后测量TEER值,待TEER值稳定后记录数据。此外,在Transwell小室顶端腔内加入100 μL的HBSS液(含有终浓度为1 mg/mL的FD-40),37 ℃孵育2 h,收集侧腔内溶液,使用FLUOstar OPTIMA荧光酶标仪测定荧光强度(激发波长480 nm,发射波长530 nm)。

表1 引物序列表Table 1 Sequences of primers
1.7 细胞中 IL-1β、IL-8、TNF-α、occludin、claudin-1、ZO-1和MLCK的mRNA表达
Trizol试剂盒法提取细胞内总RNA,紫外分光检测提纯后的RNA浓度用于后续实验。取总RNA(2 μg)加入 dNTPs(1 μL)、OligodT18引物(1 μL)、MLV 逆转录酶(1 μL)、RNases抑制剂(1 μL)及 5×Buffer (10 μL)逆转录成cDNA。取适量cDNA(2 μL)用qRT-PCR法检测 IL-1β、IL-8、TNF-α、Occludin、claudin-1、ZO-1和MLCK的表达量。在总反应体系中(20 μL)加入上游和下游引物(10 μmol/L)各 1 μL、2×SYBR Premix Ex Taq II (10 μL)、50×ROX reference Dye(0.4 μL)和灭菌双蒸水(5.6 μL),充分混匀后置于Quant Studio TM 6 Flex PCR仪中进行反应。扩增反应条件为95 ℃ 30 s,95 ℃25 s,55 ℃ 25 s,72 ℃ 50 s,共 35~40 个循环,72 ℃延伸5 min。每个基因cDNA样本平行扩增3次,取Ct值均数,依公式计算目的基因表达量[F=2(检测样品中基因的Cr值-检测样品中持家基因的Cr值)/2(空白样品中基因的Cr值-空白样品中持家基因的Cr值)]。相关基因的引物序列见表1所示。
1.8 数据处理与统计分析
本研究中,所有实验均重复 3次,结果以均值(means)±标准偏差(SD)表示。所得实验数据运用SPSS20.0统计软件进行单因素方差分析与统计处理,p<0.05为具有统计差异。
2 结果与讨论
2.1 辣木多肽对细胞生存率和LDH释放水平的影响
Caco-2细胞经2 μg/mL的LPS处理后,细胞生存率下降至41.3%(表2)。给予辣木多肽处理后,受损细胞的生存率逐渐升高并呈显著的剂量效应关系(p<0.05)。特别是在经加高浓度(100 μg/mL 和 150 μg/mL)辣木多肽处理后,细胞生存率分别升高至72.9%和83.8%,生存率分别较未处理的模型细胞增高1.77倍和2.03倍。正常处于细胞内部的LDH在细胞遭受外界强烈应激刺激导致细胞膜损伤后能够直接从细胞内部溢出,因此被常用作评估细胞损伤程度的一种生物指标[13]。与正常组细胞相比,LPS模型组细胞中LDH的溢出量为正常细胞的6.45倍。经辣木多肽处理模型细胞后,细胞 LDH外溢水平显著降低,且抑制效果存在显著的剂量效应关系(p<0.05)。较高浓度的辣木多肽(100 μg/mL和150 μg/mL)处理后,细胞中LDH溢出水平分别较未经处理的模型细胞LDH溢出水平降低40.9%和50.3%。
2.2 辣木多肽对 IL-1β、IL-8、TNF-α 分泌水平的影响
IL-1β、IL-6、IL-8和TNF-α等炎性细胞因子的异常表达是导致肠组织细胞间紧密连接丢失以及细胞上皮屏障损伤的主要原因,也在IBD发病过程中起着重要的作用[11~15]。如图 1所示,LPS处理能显著刺激Caco-2细胞中IL-1β、IL-8和TNF-α的分泌。而辣木多肽处理能够显著抑制模型细胞中 IL-1β、IL-8和TNF-α的分泌。特别是,高浓度辣木多肽(100 μg/mL和150 μg/mL)能够使细胞中的IL-1β水平分别较模型细胞中IL-1β水平降低10.6%和19.8%,IL-8水平降低36.4%和43.7%,TNF-α水平降低30.7%和37.9%。

图1 辣木多肽对LPS处理Caco-2细胞中IL-1β、IL-8和TNF-α分泌水平的影响Fig.1 Effects of MOPP on IL-1β, IL-8 and TNF-α levels in LPStreated intestinal Caco-2 cells
2.3 辣木多肽对 IL-1β、IL-8与 TNF-α 的mRNA转录水平的影响
LPS(2 μg/mL)刺激能显著诱发 Caco-2细胞中IL-1β、IL-8和TNF-α的mRNA转录(图2)。不同浓度的辣木多肽处理能够抑制IL-1β、IL-8和TNF-α的异常转录。与模型组细胞相比,高浓度的辣木多肽(100 μg/mL和150 μg/mL)能够分别降低模型细胞中IL-1β转录水平至32.8%和44.3%,IL-8转录水平至32.6%和35.0%,TNF-α转录水平至25.7%和33.5%。抑制IL-1β、IL-8和TNF-α等的过度表达能够直接改善肠组织炎症水平,从而缓解高炎症环境所致肠上皮细胞紧密连接丢失的发生[1,12,13]。
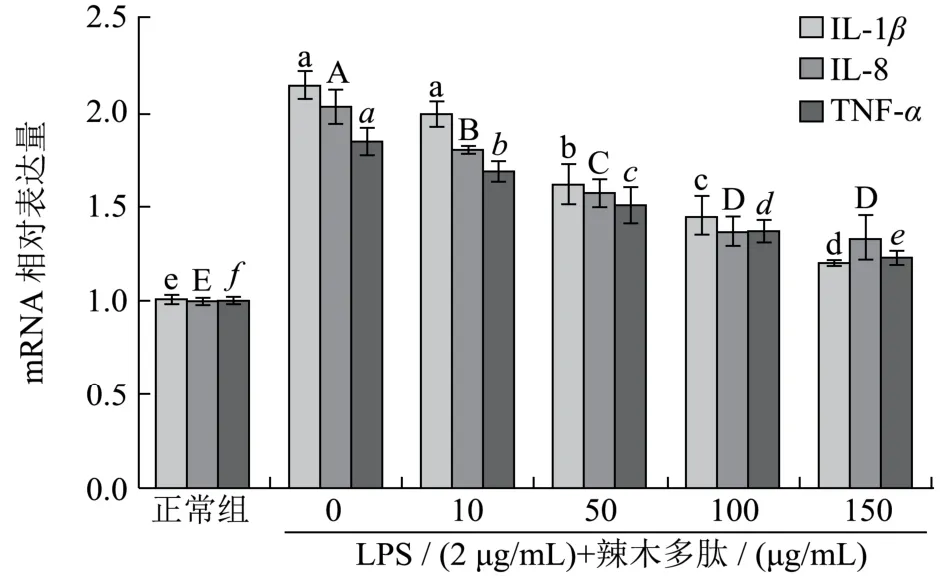
图2 辣木多肽对LPS处理Caco-2细胞中IL-1β、IL-8和TNF-α的mRNA转录水平影响Fig.2 Effects of MOPP on IL-1β, IL-8 and TNF-α mRNA expression in intestinal Caco-2 cells
2.4 辣木多肽对LPS处理Caco-2细胞的膜通透性影响
细胞的跨上皮细胞电阻(TEER)值和异硫氰酸荧光素(FITC)-右旋糖酐(FD40)是用于检测肠上皮细胞单层屏障功能变化的经典生物指标[16]。TEER值主要反映肠上皮屏障模型的离子通透性改变情况[17]。如表3所示,LPS处理显著造成Caco-2细胞TEER值的降低。给予不同浓度辣木多肽能够显著回升模型细胞的TEER 值(p<0.05)。其中,辣木多肽(10 μg/mL、50 μg/mL、100 μg/mL 和 150 μg/mL)处理组细胞分别较LPS组细胞的TEER值升高1.22倍、1.57倍、1.80倍和2.04倍。此外,FITC-右旋糖酐(FD-40)通过率也是反映肠上皮屏障功能是否正常的指标之一,FD-40透过水平越高则细胞的通透性损伤发生程度越高[18]。LPS刺激显著造成Caco-2细胞的通透性增高(p<0.05)。辣木多肽处理能够显著模型细胞的 FD-40透过水平(p<0.05)。辣木多肽(10 μg/mL、50 μg/mL、100 μg/mL和150 μg/mL)处理组细胞分别较模型组细胞的FD-40透过水平降低4.9%、15.7%、25.1%和33.3%。

表3 辣木多肽对LPS处理Caco-2细胞TEER与FD-40透过度的影响Table 3 Effects of MOPP on TEER and FD-40 levels in LPS treated intestinal Caco-2 cells

图3 辣木多肽对LPS处理Caco-2细胞中细胞间紧密连接相关因子的mRNA转录水平的影响Fig.3 Effects of MOPP on tight junction related factors mRNA expression in LPS treated intestinal Caco-2 cells
2.5 辣木多肽对 Occludin、claudin-1、ZO-1和MLCK的mRNA转录水平影响
Occludin、claudin-1与ZO-1蛋白是构成细胞间紧密连接(tight junction,TJs)的重要结构蛋白[19]。TJ结构在参与调控物质的跨肠上皮运输,维持细胞间结构稳定以及负责细胞间的通讯等方面具有非常重要的意义[20]。qRT-PCR分析发现,LPS刺激Caco-2细胞后,细胞中Occludin、claudin-1和ZO-1的mRNA转录水平显著下降(图 3)。与正常组相比,模型细胞中Occludin、claudin-1和ZO-1的mRNA转录水平分别下降67.2%,49.6%和48.4%。相反,给予辣木多肽处理后,模型细胞中 Occludin、claudin-1和 ZO-1的mRNA转录水平均显著回升。高浓度辣木多肽(100 μg/mL和 150 μg/mL)能够较模型细胞分别提升Occludin(2.30倍与2.61倍)、claudin-1(1.55倍与1.85倍)和ZO-1(1.52倍与1.68倍)的mRNA转录水平。
如图3所示,LPS刺激能显著造成Caco-2细胞中MLCK 的转录水平升高(p<0.05)。而辣木多肽能够抑制模型细胞中MLCK的转录水平。与模型组相比,高浓度(100 μg/mL和150 μg/mL)的辣木多肽可显著抑制MLCK的 mRNA转录水平(抑制率分别为 28.0%和31.3%)。肌球蛋白轻链激酶(MLCK)能够通过促肌球蛋白轻链(MLC)的磷酸化使其参与肌动蛋白收缩,引发细胞骨架重排,破坏细胞TJ结构,最终造成细胞间通透性增高[21]。抑制肠上皮细胞中MLCK的过度活化,对于维持肠上皮细胞屏障和细胞间紧密连接的重要作用[22]。
3 结论
本研究基于LPS构建的Caco-2肠上皮细胞高通透性细胞模型研究了辣木多肽提取物对细胞高通透性的改善效果。研究发现,辣木多肽能够有效抑制LPS刺激所造成的细胞损伤后LDH外溢,并抑制LPS所造成的细胞死亡。辣木多肽可有效抑制LPS刺激所致IL-1β、IL-8和 TNF-α炎性细胞因子分泌并抑制其mRNA转录。此外,辣木多肽处理还能改善模型细胞的高通透性发生。从分子层面上,辣木多肽能显著上调受损细胞中TJ相关因子(Occludin、claudin-1和ZO-1)的mRNA转录,抑制导致细胞TJ丢失的MLCK的mRNA高转录。综合上述研究结果,辣木多肽对LPS所致 Caco-2细胞发生高通透性的保护作用可能与其具有较强的抗炎作用以及对细胞 TJ相关因子的mRNA转录水平的调控能力有关。在后续研究中,课题组将重点针对辣木多肽是否具有 MLCK活化过程中的上、下游信号通路的调控作用而展开深入研究。
