CaN/NFAT信号通路在有氧运动改善高血压心肌肥大中的作用
2019-01-04石丽君
贾 祁,李 丽,石丽君,吴 迎
CaN/NFAT信号通路在有氧运动改善高血压心肌肥大中的作用
贾 祁,李 丽,石丽君,吴 迎
北京体育大学 运动人体科学学院, 北京 100084
目的:探讨有氧运动对自发性高血压大鼠(spontaneous hypertension rat,SHR)心肌钙调神经磷酸酶/活化T细胞因子(calcineurin/nuclear factor of activated T cells, CaN/NFAT)信号通路的影响,以及A激酶锚定蛋白150(A-kinase anchoring protein 150,AKAP150)在其中的作用。方法:12周龄雄性SHR以及正常血压对照组大鼠(Wistar-Kyoto rat,WKY),随机分为正常血压安静组(WKY-SED),正常血压运动组(WKY-EX),高血压安静组(SHR-SED),高血压运动组(SHR-EX)。运动组进行12周中等强度跑台运动。12周后取心脏,HE染色、Langendorff离体心脏灌流、免疫组化、免疫细胞荧光、Western blot等方法进行实验。结果:1)经12周有氧运动,WKY和SHR运动组收缩压均显著低于各自安静组;2)与WKY-SED组相比,SHR-SED组左心室内压上升最大速率(maximal rate of increase in left ventricular pressure,+dp/dtmax)、左心室内压下降最大速率(maximal rate of decrease in left ventricular pressure, -dp/dtmax)绝对值显著降低,SHR-EX组与SHR-SED组相比,+dp/dtmax、-dp/dtmax绝对值显著升高(<0.01),左心室收缩压力(left ventricular systolic pressure,LVSP)升高(<0.01),LVSP-LVDP 升高(<0.01);3)SHR-SED组CaN和AKAP150的荧光强度高于WKY-SED组(<0.01),CaN表达高于SHR-EX组(<0.01);SHR-EX组AKAP150的荧光强度高于SHR-SED组(<0.01);4)SHR-SED组CaN、GATA结合蛋白4(GATA bind protein,GATA4)及AKAP150的蛋白表达高于WKY-SED组(<0.01),p-NFATc3/NFATc3的比值显著低于WKY-SED组;SHR-EX组CaN、GATA4的表达低于SHR-SED组(<0.01),p-NFATc3/NFATc3的比值和AKAP150的表达均高于SHR-SED组。结论:有氧运动下调SHR心脏CaN/NFAT信号通路活性、增加调节因子AKAP150的表达,是运动改善其心脏肥大的分子机制之一。
高血压心肌肥大;CaN/NFAT信号通路;有氧运动;AKAP150
高血压是多种心、脑血管疾病的重要病因和危险因素,迄今仍然是心血管疾病死亡的主要原因[9,20]。在心肌肥大发生发展过程中,细胞内钙信号传递途径是诱导心肌肥大的最重要信号转导通路之一[10]。胞内Ca2+增加是导致心肌肥大的最基本信号,是引起初级和次级应答基因变化的一个始动因素和媒介,而钙调神经磷酸酶/活化T细胞因子(calcineurin/nuclear factor of activated T cells, CaN/NFAT)信号通路在胞内Ca2+升高诱导的心肌肥大发生发展过程中起关键性作用[4,20,33]。活化T细胞核因子(nuclear factor of activated T cells,NFATs)是T细胞激活时调节基因的转录因子,它们会吞噬T细胞增殖所需的细胞因子,并在T细胞反应中刺激细胞生长[16]。哺乳动物心脏主要存在NFATc3,NFATc3受Ca2+和CaN的调控,去磷酸化后暴露核定位信号,在细胞核中与转录因子GATA结合蛋白4(GATA bind protein 4,GATA4)结合,而GATA4是介入心脏正常生长发育的关键转录因子,它能调节心脏基因表达,NFATc3与GATA4结合后引起与早期免疫反应有关的基因活化,胚胎基因被激活,导致一系列病理变化,形成病理性心肌肥大[5,13,37]。AKAP150(A-kinase anchoring protein 150)为A型锚定蛋白家族中的一员,参与心肌内钙离子循环[21]及调节β1-肾上腺受体(Beta 1-adrenal receptors,β1-AR)信号强度[22],且存在CaN的结合抑制域,过表达此抑制域可以减弱CaN/NFAT信号通路依赖的心脏肥大[6]。
大量研究表明[11,14,30,35],运动能够改善压力负荷等病理刺激引起的心肌肥大,但是,在自发性高血压心肌肥大进展中,有氧运动怎样改善这一病理过程以及是否通过调控CaN/NFAT信号通路目前还不明确,CaN的调控因子AKAP150在其中的作用也不清楚。本研究旨在从整体、器官、细胞及分子水平上观察有氧运动与心肌肥大的关系,并进一步研究CaN依赖的信号通路在大鼠心肌肥大中的作用及其调节机制,藉此为高血压心肌肥大提供实验依据。
1 材料和方法
1.1 大鼠运动模型的制备、实验分组
12周龄雄性自发性高血压大鼠(spontaneous hypertension rat, SHR)以及正常血压对照组(wistar-kyoto,WKY),购自北京维通利华实验动物技术有限公司;随机分为正常血压安静组(WKY-SED),正常血压运动组(WKY-EX),高血压安静组(SHR-SED)和高血压运动组(SHR-EX),每组各12只。

1.2 心脏离体灌流实验测定心脏功能
采用ML870B2 Langendorff离体心脏灌流系统检测大鼠心脏功能,大鼠腹腔注射戊巴比妥钠(50mg/kg),麻醉后快速取心脏挂于主动脉灌注管上固定,灌流液(mmol/L,NaCl 120;KCl 45;CaCl21.2;MgCl26H2O 1.2;KH2PO41.2;NaHCO320;Glucose 10;KOH调pH至7.4)以10ml/min的速度灌流,恢复自主跳动并稳定后插入球囊,连接电极,记录心室压、灌注压、心脏表面心电图等指标。所有指标采用Labchart7分析处理。
1.3 病理学指标
开胸取心脏,迅速剪去多余组织,称取心脏重量(heart weight,HW);沿房室环剪去心房及右室游离壁,称取左心室重量(left ventricular weight,LVW),计算LVW与HW之比即为左心室质量指数(left ventricular mass index,LVMI)。最后置于4%多聚甲醛固定液中固定,常规石蜡包埋,进行HE染色。横切组织,切片厚5μm;经脱蜡、水化、染色、脱水、透明、封片等步骤后在镜下拍照。
将处理好的左心室放在4%的多聚甲醛溶液中固定24 h,分别在20%和30%的蔗糖溶液中脱水12 h,将心脏取出,组织被OCT包裹迅速置于液氮中冷却,冠状切片。经免疫组化染色、苏木素复染、梯度酒精复染、二甲苯透明和封片后,每片随机抽取5个不相重叠的视野,1X71倒置相差显微镜(Olympus,Japan)拍照。Image Pro Plus软件进行平均光密度分析。
1.4 心肌细胞急性分离
麻醉后迅速取心置于4℃无钙台式液中(mmol/L,NaCl 135;KCl 5.4;MgCl21;NaH2PO40.33;Glucose 10;HEPES 5;pH用NaOH调至7.4,充混合气饱和)剪除多余组织。迅速挂于Langendorff离体心脏灌流仪上,无钙台式液灌流20 min,流速8 ml/min。分离心肌细胞:使用Ⅱ型胶原酶配制50 ml酶液,持续灌流30 min左右,剪下心尖部,置于保存液中,将细胞从组织中刮落。200目过滤网过滤入10 ml离心管中。加入保存液至10 ml静置15 min,弃上清,如此反复静置3次。
1.5 细胞免疫荧光
急性分离的心肌细胞4℃贴壁60 min后,4%多聚甲醛固定30 min,加入0.2%Triton X-100膜打孔10 min,10%山羊血清封闭后,分别滴加一抗Rabbit Polyclonal to Anti-CaN(浓度为1∶250,Alomone, Israel),Rabbit Polyclonal to Anti-AKAP150(浓度为1∶250,Alomone, Israel),4℃过夜。次日避光加入荧光二抗Alexa Fluor488 goat anti-rabbit IgG antibody(浓度为1∶500)室温孵育1 h后,用抗淬灭封片剂ProLong Gold Antifade Mountant封片,室温避光干燥保存,24 h后可用激光共聚焦系统(SP5TCS, Leica, Germany)采集信号。
1.6 蛋白免疫印迹分析
每组选取6只大鼠进行心肌CaN、NFATc3、p-NFATc3、GATA4和AKAP150蛋白免疫印迹分析,因NFATc3去磷酸化无法检测,故对p-NFATc3/NFATc3进行分析。大鼠腹腔麻醉,将处理好的左心室放入-80 ℃冰箱保存。称取100 mg组织,迅速加入500μL RIPA裂解液,用匀浆器在冰水浴中匀浆10次,每次4~5 s,间隔4~5 s。将匀浆液于4 ℃以13 000 g离心30 min,取上清待测。按照常规操作进行蛋白浓度的测定、电泳样品制备、聚丙烯酰胺凝胶(SDS-PAGE)电泳、转膜、5%BSA封闭2 h。加入用0.01 mol/L TBST稀释的一抗(anti-CaN 1:400,GAPDH 1: 1 000,anti-NFATc3 1:250,anti-p-NFATc3 1:500,anti-AKAP150 1:400,anti-GATA4 1:1 000),室温脱色摇床上摇动孵育1 h,4 ℃孵育过夜。0.01 mol/L TBST漂洗3次,加入用辣根过氧化物酶标记二抗孵育1 h。免疫蛋白活性由增强化学发光法检测,用Image LabTM Software软件进行半定量分析。
1.7 统计分析
2 结果
2.1 体重与血压
有氧运动前WKY-EX组和SHR-EX组收缩压与各自安静组比较均无显著性差异,SHR组的收缩压为209±14 mmHg,显著高于WKY组(144±13 mmHg,<0.01);12周有氧运动后,WKY-SED组(156±12 mmHg)高于WKY-EX组收缩压(132±14 mmHg,<0.05);SHR-SED组收缩压(222±11 mmHg)显著高于WKY-SED组(156±12 mmHg,<0.01);SHR-SED组收缩压显著高于SHR-EX组(196±18 mmHg,<0.01),说明经过有氧运动干预后自发性高血压大鼠的血压有显著的改善。
2.2 运动改善SHR心脏功能
左心室内压上升最大速率(maximal rate of increase in left ventricular pressure,+dp/dtmax)和左心室收缩压力(left ventricular systolic pressure,LVSP),可以评估心脏收缩功能;反映心脏舒张功能的指标包括左心室内压下降最大速率(maximal rate of decrease in left ventricular pressure,-dp/dtmax)和左心室舒张压力(left ventricular diastolic pressure,LVDP)。利用Langendorff离体心脏灌流系统的测试,结果显示:SHR-SED组与WKY-SED组相比,+dp/dtmax降低(<0.01),-dp/dtmax绝对值降低(<0.05),LVSP降低(<0.01),LVSP-LVDP降低(<0.05),表明自发性高血压大鼠的心脏功能显著较正常大鼠降低;12周有氧运动后,SHR-EX组离体心脏功能明显好于SHR-SED组,结果为+dp/dtmax升高(<0.01),-dp/dtmax绝对值升高(<0.05),LVSP升高(<0.01),LVSP-LVDP升高(<0.01)。结果如图1、表1所示。
2.3 运动对各组大鼠心脏形态的影响
各组大鼠心脏大体观可见图2A。利用HE染色的方法观察各组大鼠心肌形态的变化,结果发现:SHR-SED组心肌细胞肿胀,细胞间排列疏松,心肌纤维断裂、融合,个别视野心肌间质纤维化,横截面上可见心肌细胞直径增宽,单个心肌细胞面积明显增加;SHR-EX组的心肌细胞较安静组排列更整齐、致密,细胞横截面积及直径都相对减小(图2B)。
以LVW/HW比值作为心脏肥大指数反映大鼠心肌肥大的程度,结果显示:SHR-SED组、SHR-EX组与WKY-SED组相比肥大指数明显增加(表2)。

图1 离体心脏灌流左心室压力与最大上升/下降速率图
Figure1. Graph of Left Ventricular Pressure and Maximum Increase/Decrease Rate
注:图A为各组左心室压力-时间曲线;图B为各组dp/dt曲线图。

表1 各组大鼠离体心脏功能指标
注:与WKY-SED相比,#<0.05,##<0.01;与SHR-SED相比,*<0.05,**<0.01;下同。
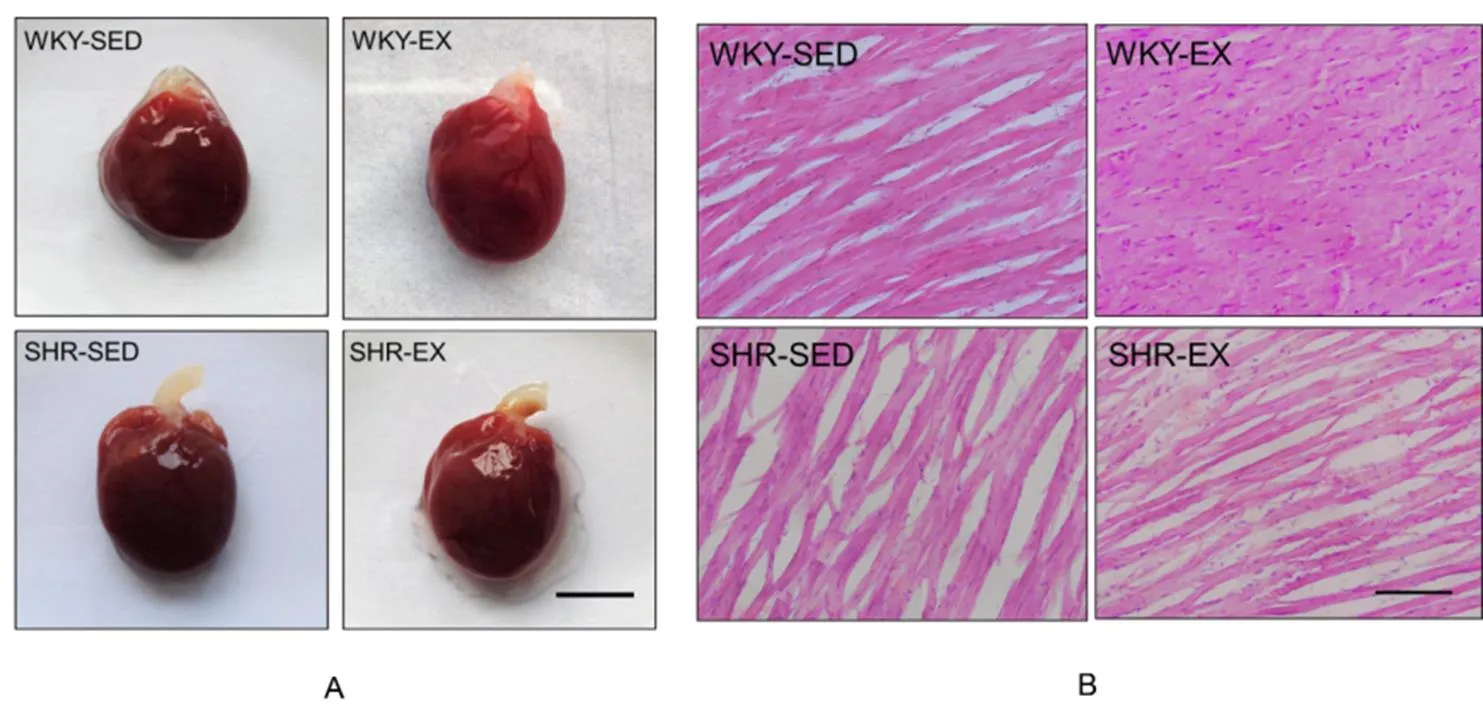
图2 有氧运动对大鼠心脏结构的影响
Figure 2. Effects of Aerobic Exercise on the Heart Structure of Rats
注:图A为各组大鼠心脏大体观察,标尺=5 mm;图B为各组大鼠心肌HE染色图(×400),标尺=20 μm。

表2 各组心脏肥大指数
2.4 运动对各组大鼠心肌信号通路蛋白表达的影响
利用Western blot技术检测了各组大鼠心肌内CaN的蛋白表达量,结果显示:SHR-SED组高于WKY-SED组(<0.01);SHR-SED组高于SHR-EX组(<0.01),WKY-SED组与WKR-EX组没有显著性差异,提示,SHR-SED组的CaN的表达显著增多,而经过有氧运动干预后CaN的表达显著下调。各组大鼠NFATc3总蛋白的表达没有显著性差异,但WKY-SED组p-NFATc3/NFATc3高于SHR-SED组(<0.05);SHR-EX组p-NFATc3/NFATc3高于SHR-SED组(<0.05),表明自发性高血压大鼠心肌中NFATc3去磷酸化显著高于正常血压安静组,而经过有氧运动干预后自发性高血压大鼠心肌中NFATc3的去磷酸化减少。检测各组大鼠心肌中GATA4的蛋白表达,结果显示:SHR-SED组高于WKY-SED组(<0.01);SHR-SED组高于SHR-EX组(<0.05),故SHR-SED组心肌中GATA4的表达显著上调,而有氧运动有效下调其表达。检测了各组大鼠心肌内AKAP 150的蛋白表达,结果显示:SHR-SED组高于WKY-SED组(<0.01);SHR-EX组高于SHR-SED组(<0.01);WKY-EX组高于WKY-SED组。以上结果表明,自发性高血压大鼠的AKAP150的表达显著增多,而有氧运动的干预不管是在自发性高血压大鼠或者是正常血压大鼠的心肌中均上调了AKAP150的表达(<0.01,图3)
2.5 运动对各组大鼠心肌组织CaN、AKAP150表达和分布的影响
免疫组织化学方法观察了各组大鼠CaN在左心室的表达和分布,结果显示:SHR-SED组CaN阳性强度高于WKY-SED组(<0.01);SHR-SED组高于SHR-EX组(<0.01);AKAP150的结果显示:SHR-SED组阳性强度高于WKY-SED组(<0.01);WKY-EX组高于WKY-SED组(<0.01);SHR-EX组高于SHR-SED组(<0.01,图4)。以上结果表明,自发性高血压大鼠心肌中CaN和AKAP150的表达较正常血压组显著增多,而有氧运动的干预能有效降低CaN的表达,上调AKAP150的表达。
2.6 运动对各组大鼠左心室心肌细胞内CaN和AKAP150表达及分布的影响
免疫荧光技术及激光共聚焦成像观察各组大鼠心脏单个心肌细胞CaN和AKAP150表达及分布。如图5A所示,CaN显示为红色荧光;AKAP150显示为绿色荧光,二者共定位显示为黄色荧光,如图5显示,SHR-SED组的黄色荧光最为明显,说明CaN与AKAP150的共定位最多。分析荧光强度表明,与WKY-SED组相比,SHR-SED组、WKY-EX组CaN和AKAP150荧光强度显著升高(<0.01,图5B、C);与SHR-SED组相比,SHR-EX组CaN荧光强度显著下降(<0.01),AKAP150显著升高(<0.01,图5C)。

图3 有氧运动对各组大鼠心肌信号通路蛋白表达的影响
Figure 3. Effect of Aerobic Exercise on Protein Expression of Signaling Pathway in Rats Myocardial
注:图A为各组大鼠心肌CaN、GATA4、AKAP150、NFATc3、p-NFATc3及对应GAPDH的Western blot图;图B、C、D、E分别为CaN、GATA4、AKAP150、p-NFATc3/NFATc3蛋白表达统计图。与WKY-SED相比,#<0.05,##<0.01;与SHR-SED相比,*<0.05,**<0.01;下同。

图4 有氧运动对各组大鼠心肌CaN、AKAP150表达及分布的影响
Figure 4. Protein Expression and Distribution of CaN、AKAP150 in Rats Myocardial
注:图A、B分别是各组大鼠心肌CaN、AKAP150的蛋白免疫组化染色图;图C、D分别CaN、AKAP150的蛋白表达统计图。棕色颗粒代表阳性反应,标尺=50 μm。

图5 各组大鼠心肌细胞CaN、AKAP150蛋白表达与分布
Figure 5. Expression and Distribution of CaN and AKAP150 in Rats Myocardial Cells
注:图A为各组荧光标记心肌细胞代表图,蓝色荧光为细胞核;图B、C为各组细胞CaN、AKAP150蛋白相对荧光强度统计图。
3 讨论
本研究采用Langendorff离体心脏灌流系统研究心脏功能,它的优势在于排除了神经、体液因素以及心脏前后负荷对心功能的影响[31]。该设备测得反映心脏功能的指标主要是左心室内压最大速率(maximal rate of increase in left ventricular pressure, ±dp/dtmax)和LVSP,其中,+dp/dtmax是评估心脏收缩功能的常用指标,可以反映心肌收缩性。-dp/dtmax可反映左心室的充盈程度、舒张功能及心室顺应性,常作为心肌舒张参数和评估心肌早期舒张功能改变的敏感指标[15]。有研究表明,SHR 8周龄时左心室收缩功能开始减退,12周龄时左心室舒张功能出现异常[17],故本研究所选择的12周龄SHR能够比较全面的了解其心功能的病理生理发展进程及干预效果。本研究显示,SHR-SED与WKY-SED组相比±dp/dtmax绝对值下降,这说明此阶段已出现明显的舒张功能损伤;SHR-EX组±dp/dtmax绝对值、LVSP、LVSP-LVDP升高,收舒功能均得到有效改善,表明有氧运动能有效改善高血压大鼠心脏功能。HE染色与肥大指数的结果均显示了SHR组心脏结构的变化。综上可知,从心脏大体形态、病理组织学和血流动力学等多方面表明SHR心肌肥大明显,心脏功能严重损害,而在12周规律有氧运动后从结构和功能方面都有明显的改善。
许多研究表明,CaN/NFAT信号通路在压力负荷引起的心肌肥大中有重要的作用[23,32,38]。CaN过表达能够明显增加心脏大小,并最终诱导心衰[25];使用CaN抑制剂后,抑制剂组心肌肥大较对照组明显改善[26];敲除CaN能够有效抑制肥大基因的表达,并且在一定程度上改善心肌肥大的病理进程[36]。而有氧运动能够减少心衰[18]、肥厚型心肌病[2]等心肌内CaN/NFAT信号通路的活化而改善心脏功能。Oliveria等[29]研究报道,运动可以减弱心肌细胞内NFATc3的转移,降低肥大因子GATA4的表达。本实验室前期研究表明[1],有氧运动能够有效抑制肠系膜动脉中CaN/NFAT信号通路的表达,改善血管功能。在此基础上本研究针对高血压对于心脏的影响进行进一步的研究,结果显示,SHR-SED组CaN及其下游信号GATA4的蛋白表达均显著高于WKY-SED组,p-NFATc3/NFATc3的比值显著低于WKY-SED组,即表示SHR-SED组心肌中NFATc3去磷酸化增多,免疫组化显示SHR-SED组CaN的分布较WKY-SED组更密集,阳性显色显著增多。表明CaN/NFAT信号通路是导致SHR心肌肥大的机制之一。SHR-EX组CaN/NFAT信号通路相关蛋白的表达及NFATc3的去磷酸化均显著低于SHR-SED组,这说明有氧运动有效降低了CaN/NFAT信号通路各蛋白的活性,而CaN/NFAT信号通路为病理性心肌肥大必不可少的致病因素,从而可知,有氧运动降低了SHR对于病理性刺激引起的心肌肥大的应答,改善了SHR病理性心肌肥大的发生发展。而在正常血压组的以往研究表明,由运动形成的生理性心肌肥大也存在CaN/NFAT信号通路的参与,但根据不同的运动方式和强度有着不同的变化[34]。本研究结果显示,WKY-EX组CaN的荧光强度较WKY-SED组增加,但是CaN/NFAT信号通路相关蛋白表达与WKY-SED组均无显著差异,提示,中等强度有氧运动对正常血压大鼠心肌中CaN/NFAT信号通路的影响较小。
AKAP150在心脏中的作用复杂,且因不同病理性刺激,可以结合不同的酶而调节产生不同的细胞功能[7]。有研究表明,AKAP150能够影响心脏重塑。例如交感神经刺激下培养的成年心肌细胞中,AKAP150与caveolin-3相互作用影响心肌细胞中钙瞬态的产生,由此推断它可能参与心肌细胞钙离子的循环[27],因为心肌细胞中钙离子的增多正是引起心肌肥大的中心环节[10]。早期研究发现,AKAP150存在CaN的结合域,可以非竞争性抑制CaN的活性,在高表达此结合域的情况下,能够抑制NFAT依赖的心肌肥大[3]。在敲除AKAP150的转基因小鼠中,CaN的活性增加,出现显著的心脏肥大和心功能不全[24]。此外,AKAP150与CaN的结合对于β1-AR的循环转运有非常重要的作用,使AKAP150通过调控心肌中β1-AR的信号强度来起到保护心脏的作用[2,22]。心肌梗死后,AKAP150与CaN形成的复合物可调控NFAT的核转位,下调心肌细胞内Kv通道[28]。提示,不同的病理性刺激下,AKAP150可能可以锚定CaN产生不同的作用。自发性高血压中AKAP150的研究较少,有关运动对其的作用也鲜有报道,但其与CaN/NFAT信号通路又有着密切的关系,故本研究对此进行了一些表象的研究。早期研究表明AKAP150存在非竞争性抑制CaN的抑制性结合域[3],而本研究结果显示,SHR-EX组CaN表达显著减少,AKAP150的表达显著高于SHR-SED组,CaN与AKAP150的结合增多,故可推测AKAP150的作用机制为通过结合CaN,抑制后者活性以保护心脏,而运动后AKAP150表达显著增多提示,有氧运动能促进AKAP150的表达,改善心肌肥大的病理进程。而本研究结果同样显示,SHR-SED组AKAP150的蛋白表达显著多于WKY-SED组,以往研究中并未有关于自发性高血压大鼠心肌中AKAP150变化的研究,但是有研究发现,敲除AKAP150的转基因小鼠出现心脏肥大和心功能不全[10];AKAP150敲除小鼠会产生年龄依赖性的心脏肥大、血管腔扩大和心功能障碍[12];而过表达AKAP150能够减弱限制型心肌病转基因小鼠的心肌肥大[6],以上可以得出AKAP150作为心脏保护作用的依据。故结合以往研究结果提示,在SHR心肌肥大代偿期,AKAP150有可能为代偿性增多,达到一种负反馈的调节作用,但若要详细系统的解释此结果还需进一步研究求证。另一方面本研究显示,WKY-EX组与WKY-SED组相比AKAP150蛋白表达明显增多,提示在生理性心肌肥大中,AKAP150可能参与其他信号通路来调控心肌细胞功能,其调控机制还需后续实验研究。
本研究表明,6月龄SHR-SED组表现出明显的心脏肥大,心脏收缩功能和舒张功能明显下降,心脏质量显著大于正常对照组,心肌组织排列紊乱、稀疏,心肌纤维断裂等,心肌细胞明显肥大,而经过12周有氧运动的SHR-EX组心脏结构、收缩功能和舒张功能较安静组均有显著改善。而在自发性高血压引起的心脏肥大中CaN/NFAT信号通路的激活,是对病理性刺激的一种应答反应,长期规律的有氧运动能有效降低此信号通路的活性,并同时增加AKAP150的表达,抑制CaN的活性,从而减少病理性应答,改善心脏功能。
4 结论
规律有氧运动通过下调6月龄SHR心脏CaN/NFAT信号通路活性、增加调节因子AKAP150的表达,改善心脏功能,是运动改善其心脏肥大的分子机制之一。
[1] 柏平. CaN/NFAT信号通路在有氧运动改善高血压血管功能中的作用[D].北京:北京体育大学,2017.
[2] BERNARDO B, WEEKS K, PRETORIUS L,. Molecular distinction between physiological and pathological cardiac hypertrophy: experimental findings and therapeutic strategies [J]. Pharmacol Ther, 2010, 128(1):191-227.
[3] COGHLAN V M, PERRINO B A, HOWARD M,. Association of protein kinase A and protein phosphatase 2B with a common anchoring protein[J]. Science, 1995, 267(5194):108-111.
[4] DIEDRICHS H, HAGEMEISTER J, CHI M,. Activation of the calcineurin/NFAT signalling cascade starts early in human hypertrophic myocardium [J].J Int Med Res, 2007,35 (6):803-818.
[5] OAKLEY D. General cardiology: The athlete’s heart [J]. Heart, 2001, 86(6):722-726.
[6] DE WINDT L J, LIM H W, BUENO O F,. Targeted inhibition of calcineurin attenuates cardiac hypertrophy in vivo[J]. Proc Natl Acad Sci U S A, 2001, 98(6):3322-3327.
[7] DIVIANI D, REGGI E, ARAMBASIC M,. Emerging roles of A-kinase anchoring proteins in cardiovascular pathophysiology [J]. Biochim Biophys Acta, 2016, 1863(7):1926-1936.
[8] EFENDIEV R, BAVENCOFFE A, HU H,. Scaffolding by a-kinase anchoring protein enhances functional coupling between adenylyl cyclase and TRPV1 channel[J]. J Biol Chem, 2013, 288 (6): 3929-3937.
[9] GBD 2015 MORTALITY AND CAUSES OF DEATH COLLAB ORATORS. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease study 2015[J].Lancet, 2016, 388 (10053): 1459-1544.
[10] GODFRAIND T. Antioxidant effects and the therapeutic mode of action of calcium channel blockers in hypertension and atheroscle-rosis [J]. Philos Trans R Soc Lond B Biol Sci, 2005, 360 (1464): 2259-2272.
[11] HAUTALA A, MÄKIKALLIO T, KIVINIEMI A,. Cardiova-scular autonomic function correlates with the response to aerobic training in healthy sedentary subjects[J]. Am J Physiol Heart Circ Physiol, 2003, 285(4):H1747-1752.
[12] ISHIGURO K, ANDO T, MAEDA O,. Cutting edge: tubulin alpha functions as anadaptor in NFAT-importin beta interaction [J]. J Immunol, 2011, 186(5):2710-2713.
[13] JIN L, SLIZ P, CHEN L,. An asymmetric NFAT1 dimer on a pseudo-palindromic kappa B-like DNA site[J]. Nat Struct Biol, 2003, 10(10):807–811.
[14] LIBONATI J R. Cardiac remoldeling and exercise training in hypertension [J]. Curr Hypertens Rev, 2011, 7(1):20-28.
[15] JI D, ZHANG L, LI C,. Effect of hydrox- ysafflor yellow A on human umbilical vein endothelial cells under hypoxia [J]. Vascul Pharmacol, 2009, 50(3-4):137-145.
[16] KIANI A, RAO A, ARAMBURU J. Manipulating immune responses with immunosuppressive agents thattarget NFAT [J]. Immunity, 2000, 12(4):359–372.
[17] KOKUBO M, UEMURA A, MATSUBARA T,. Noninvasive evaluation of the time course of change in cardiac function in spontaneously hypertensive rats by echocardiography [J]. Hypert-ens Res, 2005, 25(2):601-609.
[18] KONHILAS J, WATSON P, MAASS A,. Exercise can prevent and reverse the severity of hypertrophic cardiomyopathy [J]. Cire Res, 2006, 98(4):540-548.
[19] LEWINGTON S, LACEY B, CLARKE R,. The burden of hypertension and associated risk for cardiovascular mortalit in China [J]. JAMA Intern Med, 2016, 176(4):524-532.
[20] LIU C, TAN J, WANG Y,. L-type calcium channel blocker suppresses calcineurin signal pathway and development of right ventricular hypertrophy [J]. J Formos Med Assoc, 2005, 104 (11):798-803.
[21] LI L, LI J, DRUM B,. Loss of AKAP150 promotes pathological remodelling and heart failure propensity by disrupting calcium cycling and contractile reserve [J]. Cardiovasc Res, 2016, 113(2):147-160.
[22] LI X, NOOH M, BAHOUTH S,. Role of AKAP79/150 protein in beta1-adrenergic receptor trafficking and signaling in mammalian cells [J]. J Biol Chem, 2013, 288 (47):33797-33812.
[23] LI N, SI B, JU J,. Nicotine induces cardiomyocyte hypertrophy through TRPC3-mediated Ca2+/NFAT signalling pathway [J]. Can J Cardiol, 2016, 32(10):1260.
[24] LI X, MATTA S, SULLIVAN R,. Carvedilol reverses cardiac insufficiency in AKAP5 knockout mice by normalizing the activities of calcineurin and Ca MKII [J]. Cardiovasc Res, 2014, 104(2): 270-279.
[25] MOLKENTIN J. Calcineurin/NFAT signaling regulates the cardiac hypertrophic response in coordination with the MAPKs [J]. Cardiovasc Res, 2004, 63 (4):467-475.
[26] MOLKENTIN J, LU J, ANTOS C,. A calcineurin-dependent transcriptional pathway for cardiac hypertrophy [J]. Cell, 1998, 93(2):215-218.
[27] NICHOLS B, ROSSOW C, NAVEDO M,. Sympathetic stimulation of adult cardiomyocytes requires association of AKAP 5 with a subpopulation of L-type calcium channels [J]. Circ Res, 2010, 107 (6):747-756.
[28] NIEVES-CINTRÓNA M, HIRENALLUR-SHANTHAPPAB D, NYGRENB P,. AKAP150 participates in calcineurin/NFAT activation during the down-regulation of voltage-gated K+ currents in ventricular myocytes following myocardial infarction [J]. Cell Signal, 2016, 28 (7):733-740.
[29] OLIVEIRA R, FERREIRA J, GOMES E,. Cardiac anti-remodelling effect of aerobic training is associated with a reduction in the calcineurin/NFAT signaling pathway in heart failure mice [J]. J Physiol, 2009, 587(15):3899-3910.
[30] SCHULTZ R L, SWALLOW J G, WATERS R P,. Effects of excessive long-term exercise on cardiac function and myocyte remodeling in hypertensive heart failure rats[J]. Hypertension, 2007, 50(2):410-416.
[31] SUTHERLAND F J, HEARSE D J. The isolated blood and perfusion fluid perfused heart[J]. Pharmacol Res, 2005, 41(6): 613-627.
[32] SANGEETHA K, LAKSHMI S, NIRANJALI D,. Dexame–thasone promotes hypertrophy of H9C2 cardiomy-ocytes through calcineurin B pathway independent of NFAT activation [J]. Mol Cell Biochem, 2016, 411(1-2): 241-252.
[33] VANDEWALLE A, TOURNEUR E, BENS M,. Calcineu-rin/NFAT signaling and innate host defence: a role for NOD1-mediated phagocytic functions [J]. Cell Commun Signal, 2014, 12 (8):1-10.
[34] WILKINS B J, DAI Y S, BUENO O F,. Calcineurin/NFAT coupling participates in pathological but not physiological cardia hypertrophy[J].Circ Res,2004,94(1):110-118.
[35] YI L, MING Z, JIN J,. Long-term administration of pyridostigmine attenuates pressure overload-induced cardiac hypertrophy by inhibiting calcineurin signalling [J] . J Cell Mol Med, 2017, 9(21):2106-2116.
[36] YIN Z, WANG X, ZHANG L,. Aspirin attenuates angioten-sin II-induced cardiomyocyte hypertrophy by inhibiting the Ca2+/ Calcineurin-NFAT signaling pathway[J]. Cardiovasc Ther, 2016, 34(1):21-29.
[37] ZHU X, FANG J, GONG J,. Cardiac-specific EPI64C blunts pressure overload–Induced cardiac hypertrophy[J]. Hypertension, 2016, 67(5):866–877.
[38] ZHANG Y, YU H, MENG K,. Probing the Ca2+/CaM-induced secondary structural and conformational changes in calcineurin [J]. Int J Biol Macromol, 2014,64(2):453-457.
The Role of CaN/NFAT Signaling Pathway in Aerobic Exercise-induced Improvement of Cardiac Hypertrophy in Hypertension
JIA Qi, LI Li, SHI Li-jun, WU Ying
Beijing Sport University, Beijing 100084, China.
Objective: The purpose of this study was to investigate the effects of aerobic exercise on the CaN/NFAT signaling pathway in SHR myocardial cells, and the role of the AKAP150. Methods: 12-week-old male SHR and WKY rats were randomly assigned to sedentary groups (SHR-SED, WKY-SED) and exercise training groups (SHR-EX, WKY-EX). Exercise groups were performed a 12-week moderate-intensity treadmill running. After 12 weeks, the myocardial cells were enzymatically isolated. The experimental methods include HE staining, the Langendorff technique of isolated heart perfusion, immunohistochemistry, immune cell fluorescence, Western blot. Results: 1) After 12 weeks of exercise, SBP in both WKY-EX and SHR-EX were significantly lower than that of their sedentary counterparts. 2) Compared with the WKY-SED group, the SHR-SED group +dp/dtmax, -dp/dtmaxsignificantly decreased, and the SHR-EX group was significantly higher than the SHR-SED group, +dp/dtmaxsignificantly increased, -dp/dtmaxdecreased (<0.01), LVSP increased (<0.01). 3) The fluorescence intensity of CaN and AKAP150 in the SHR-SED group was higher than WKY-SED group (<0.01), and the fluorescence intensity of the SHR-EX group AKAP150 was higher than SHR-SED group (< 0.01), and the expression of CaN was lower than the SHR-SED group (<0.01). 4) The protein expression of CaN and AKAP150 in the SHR-SED group was higher than that in the WKY-SED group (<0.01). The expression of p-NFAT in the SHR-SED group was significantly lower than that the WKY-SED group. The expression of the SHR-EX group CaN be lower than the SHR-SED group (< 0.01), and the expression of p-NFAT and AKAP150 is higher than the SHR-SED group. Conclusion: Aerobic exercise reduced the activity of the CaN/NFAT signaling pathway and increased the expression of AKAP150 in the SHR myocardial, which is one of the molecular mechanisms to improve the hypertrophy of the heart.
G804.5
A
2017-12-19;
2018-12-06
国家自然科学基金项目(31771312);中央高校基本科研业务费专项资金资助项目(2017QN010)。
贾祁,女,硕士研究生,主要研究方向为运动和心血管生理学,Email: 980712411@qq.com。
吴迎,男,讲师,博士,主要研究方向为运动与心血管生理学,Email:wuying@bsu.edu.cn。
1000-677X(2018)12-0045-08
10.16469/j.css.201812005
