有氧运动通过中脑-纹状体多巴胺可塑性调节高脂饮食肥胖小鼠体重变化
2019-01-04牛亚凯赵旭东侯莉娟
陈 巍,李 娟,牛亚凯,赵旭东,侯莉娟
有氧运动通过中脑-纹状体多巴胺可塑性调节高脂饮食肥胖小鼠体重变化
陈 巍1,李 娟1,牛亚凯1,赵旭东2,侯莉娟2
1.河北师范大学 体育学院, 河北 石家庄 050021; 2.北京师范大学 体育与运动学院, 北京 100875
目的:观察8周有氧运动对肥胖小鼠自主活动、食物偏爱、纹状体多巴胺(dopamine, DA)水平及中脑-纹状体酪氨酸羟化酶(tyrosine hydroxyl lase, TH)表达的影响,从中脑-纹状体DA神经可塑性的角度探讨运动防治肥胖的神经生物学机制。方法:C57BL/6J雄性小鼠经高脂饮食诱导肥胖模型后,随机分为肥胖组(OG)与肥胖运动组(OEG)。普通饮食组分为对照组(CG)与运动对照组(CEG)。OEG小鼠与CEG小鼠接受8周跑台运动干预(5~13 m/min,50 min/次,5次/周)。采用旷场试验评价小鼠自主活动能力,食物偏爱试验测定高脂饮食偏爱,微透析-高效液相色谱-电化学技术检测纹状体DA及HVA水平,免疫组织化学及免疫印迹技术检测中脑-纹状体TH表达。结果:与CG比较,OG小鼠体重明显增加(<0.01),自主活动水平与能力显著下降(<0.01),高脂饮食偏爱显著升高(<0.01),纹状体DA水平明显下降(<0.01),中脑-纹状体TH表达显著下调(<0.05)。与OG比较,OEG小鼠体重显著降低(<0.01)、自主活动水平与能力提高(<0.05)、高脂饮食偏爱显著降低(<0.05)、纹状体DA水平升高(<0.05)、中脑-纹状体TH表达上调(<0.05)。结论:8周有氧运动干预可通过提高中脑-纹状体TH表达促进DA合成,增加纹状体DA水平,改善高脂饮食诱导肥胖小鼠自主活动水平与能力,降低高脂饮食摄入,进而达到控制体重的作用。中脑-纹状体DA神经可塑性可能是有氧运动防治肥胖的神经生物学机制之一。
有氧运动;高脂饮食;肥胖;多巴胺可塑性
前言
肥胖率的快速上升与社会环境因素紧密相关[11]。一方面,富含热量的适口性食物随处可及,由此引发的过度进食(overeating)显著提高了人体热量摄入[33]。另一方面,生产方式的高度自动化使人们身体活动水平严重不足(physical inactivity),导致能量消耗锐减[2],极大地增加了肥胖风险。另外,肥胖者自发性身体活动水平也显著减少,即使限制饮食或手术减重后,其身体活动水平也难以恢复[28,1]。因此,加强运动干预措施并减少过度进食是体重控制及肥胖防治的重要策略。多巴胺(dopamine, DA)是脑内一种重要的神经递质,主要参与躯体运动、精神活动及神经内分泌等功能的调节[14]。脑内DA神经元主要集中在中脑黑质致密部、腹侧被盖区及红核后区[14]。其中,黑质致密部的DA神经元投射至背侧纹状体形成黑质-纹状体系统,主要参与随意运动及目标导向性行为的调控[21]。腹侧被盖区与红核后区的DA神经元分别支配腹侧纹状体及前额叶皮层,构成了大脑边缘DA系统,主要与情绪及奖赏的调控过程有关[21]。现已证实,该系统DA神经传递缺陷与精神分裂症、药物成瘾、抑郁及肥胖均存在密切关系[21,25]。肥胖者自发性身体活动减少及过度进食可能与中脑-纹状体DA系统功能障碍有关[25,20]。合理进行运动干预,不但可提高肥胖者心血管功能、血糖控制能力、胰岛素敏感度及认知功能等,还可明显改善体成分,使超重及肥胖者保持良好的体适能水平及健康体重[13,22,34]。前期研究表明,中等强度的跑台运动可提高肥胖小鼠腹侧背盖区酪氨酸羟化酶(tyrosine hydroxylase, TH)表达[15]。提示,运动干预可促进DA合成,并对中脑DA神经元产生神经保护作用,这可能对缓解高脂膳食诱导的DA神经可塑性变化产生积极影响。因此,运动防治肥胖的神经生物学机制可能与运动调节中脑-纹状体DA神经可塑性,提高自发性活动水平并减少过度进食有关。为此,本研究以高脂饮食方案建立肥胖小鼠模型,观察8周中等强度的跑台运动对肥胖小鼠体重、自主活动能力、进食行为、纹状体DA及其代谢产物水平、中脑-纹状体系统TH表达的影响及其关系,从中脑-纹状体DA神经可塑性角度进一步揭示运动防治肥胖的神经生物学机制。
1 材料与方法
1.1 实验对象及分组
雄性C57BL/6J小鼠(6周龄,15.42±1.47 g)共60只,实验动物由北京维通利华实验动物技术有限公司提供。分笼饲养,自由饮水进食,明暗交替周期为12 h,动物房温度为25±2 ℃,相对湿度为50%±5%。小鼠适应性饲养7天后随机分为普通饲养组(RG, n=24)与高脂饲养组(HG,n=24),12周后将HG中的肥胖小鼠再随机分为肥胖组(OG, n=12)、肥胖运动组(OEG, n=12)。RG分为对照组(CG, n=12)与运动对照组(CEG, n=12)。
1.2 肥胖小鼠模型的建立
RG小鼠进食普通饲料(2.90 kcal/g,13%脂肪,64%糖,23%蛋白质);HG小鼠进食高脂饲料(4.20 kcal/g,51%脂肪,33%糖,16%蛋白质)。喂养12周后将HG小鼠中体重超过RG小鼠平均体重20%作为肥胖模型成功标准。各组小鼠保持原有饮食习惯,CEG与OEG小鼠进行跑台运动干预,CG与OG小鼠置安静跑台内同样时间,但不进行运动。实验期间,每24 h计算一次食物消耗量及能量摄入量。小鼠24 h能量摄入量(kcal)=24 h食物消耗量(g)×食物的能量密度(kcal/g)。
1.3 运动干预方案
运动干预采用电动跑台(成都泰盟,FT-200)训练,跑台坡度为0°,每次运动干预的前10 min跑速为5 m/min,然后以10 m/min的跑速运动30 min,最后10 min的跑速为 13 m/min,此运动强度约相当于58%~75%最大摄氧量时的运动强度[30]。每日训练1次,每周的周一~周五连续训练5天,周六、日休息,连续进行8周。正式运动干预前,所有小鼠均需预先接受适应性训练3~4次,15~20 min/次,速度为5~10 m/min。
1.4 自主活动能力测试
采用旷场试验(open-field test)测试小鼠的自主活动。将小鼠置于一个40 cm×30 cm×30 cm的白色敞箱中,让小鼠自由活动30 min,记录其自主活动情况,采用行为学分析软件(SMART 3.0)分析采集到的视频数据。分析指标包括活动总距离、活动总时间和活动速度等。旷场试验均安排在周日晚19:00~21:00进行,每两周进行一次测试。
1.5 食物偏爱测试
1.6 样品采集及处理
最后一次运动结束48 h后,每组取6只小鼠,用5%的水合氯醛溶液对小鼠腹腔注射(0.5 ml/10 g),深度麻醉后,眼球取血,以3 500 rpm离心10 min后,分离血清,分装后置4 ℃环境待测。然后打开胸腔,用输液针将生理盐水经左心室-主动脉插管灌流后,迅速取出脑组织,置液氮冷冻后-80 ℃保存。剖开小鼠腹腔,完整分离附睾周、肾周部位的内脏脂肪组织,称重并计算内脏脂肪率。“内脏脂率=(左右肾周脂肪+左右附睾脂肪)/体重×100%”。血糖水平采用血糖仪检测;胰岛素水平采用ELISA法测定,操作步骤严格按照试剂盒说明书进行。稳态模型评估胰岛素抵抗指数(HOMA-IR),HOMA-IR=空腹胰岛素(mIU/L)×空腹血糖(mmol/L)/22.5。
1.7 纹状体DA及其代谢产物水平检测
预先在小鼠纹状体埋植微透析探针导轨,每组选取6只小鼠,腹腔注射5%的水合氯醛麻醉(0.5 ml/10 g),固定于脑立体定位仪上。按小鼠脑立体定位图谱[27]在纹状体处(AP: +1.10 mm,ML:+1.50 mm, DV: -4.00 mm)植入导引管,螺丝钉及牙科水泥固定,小鼠苏醒恢复24 h后,恢复常规饲养,最后一次运动干预结束48 h后进行透析。透析时将探针插入导轨并与微透析泵相连。采样前调节恒流泵,将人工脑脊液以2 μl/min的速度持续灌入,纹状体处微透析探针收集透析液,弃前30 min的流出液后,每30 min收集一个样品,待采集过程稳定后,对小鼠腹腔注射安非他明(100 μg/100 g)检测其对DA及其代谢产物高香草酸(HAV)水平的影响,将采集到的样品置-80 ℃保存待测。实验结束后对探针回收率进行测定。微透析结束后,对脑组织进行冠状切片,尼氏染色观察探针导轨位置。采用高效液相色谱-电化学技术检测透析液中DA与HAV的水平。流动相:6.21 g NaH2PO4•H2O,5.40 g NaH2PO4,2.4 g柠檬酸,0.25 ml 100μmol/L EDTA溶液,0.184 g辛烷基磺酸钠,50 ml乙腈,超纯水定溶到500 ml。色谱柱:2.1 mm×150 mm;柱温:30 ℃;流速:0.2 ml/min;工作电压:0.52 V。精确称取待测物质标准品配置标准液,根据标准品所对应的峰面积绘制浓度-峰面积标准曲线分析DA与 HAV的含量。
1.8 中脑-纹状体酪氨酸羟化酶的定位表达检测
最后一次运动结束48 h后,每组选取6只小鼠,腹腔注射5%的水合氯醛麻醉(0.5 ml/10 g),取全脑,采用免疫组织化学方法检测中脑及纹状体TH定位及表达。将右脑进行OCT包埋,用冰冻切片机进行连续冠状切片,厚度约20 μm,将脑片附贴于涂有多聚赖氨酸的载玻片上置-20 ℃保存。染色前用PBS溶液冲洗10 min×3次,3% H2O2室温孵育30 min,PBS溶液冲洗10 min×3次,10%的山羊血清37 ℃封闭30 min,倾去血清;滴加一抗孵育(TH: 1/2 000, D2R: 1/1 000, DAT: 1/500, abcam),4 ℃过夜。PBS冲洗10 min×3次,用辣根酶标记的二抗孵育30 min,PBS溶液冲洗10 min×3次,DAB染色,透明,封片。奥林巴斯显微镜拍照,采用Image-Pro Plus 6.0软件统计高倍视野内阳性细胞数量或阳性纤维的平均光密度值。
1.9 中脑-纹状体酪氨酸羟化酶的蛋白表达检测
最后一次运动结束48 h后,每组选取6只小鼠,腹腔注射5%的水合氯醛麻醉(0.5 ml/10 g),取全脑后快速置于液氮中保存。采用western blot技术测定中脑-纹状体TH蛋白表达。待检测时取出保存的脑组织,在冰面上快速分离中脑及纹状体部位,将适量组织放置预冷的匀浆器充分研磨后加入适量裂解液裂解30 min,以12 000 rpm离心10 min取上清液分装,BCA法测定蛋白浓度。依次上样、电泳、转膜、封闭,加入稀释的单克隆抗体(TH:1/200, abcam),孵育过夜。加入辣根过氧化物酶标记的二抗,孵育60 min,将ECL工作液加置PVDF膜,室温下孵育5 min后用保鲜膜包好PVDF膜,经显影、曝光、洗膜、封闭。将β-actin单克隆抗体按1︰500稀释到一抗稀释液中,室温下摇动60 min,按上述方法得到内参条带。结果胶片采用凝胶图象处理系统分析目标带的分子量与积分光密度值。
1.10 统计学处理

2 研究结果
2.1 小鼠体重变化
如图1A所示,从第6周开始HG小鼠体重开始超过RG小鼠(<0.01)。第12周开始进行运动干预,与CG小鼠比较,OG小鼠体重显著升高(<0.01)。与OG小鼠比较,OEG小鼠从第15周体重开始出现显著下降(<0.01)。
2.2 小鼠能量摄入变化
如图1B所示,HG小鼠每日能量摄入显著高于RG小鼠(<0.01);运动干预开始后的第1周,OEG小鼠能量摄入低于OG小鼠(<0.05),从第14~20周每日能量摄入两组未见显著差异。与CG小鼠比较,CEG小鼠每日能量摄入量未见显著差异。
如图2所示,各组小鼠最终的内脏脂肪率与胰岛素抵抗指数存在显著差异。与CG小鼠比较,OG小鼠内脏脂肪率与胰岛素抵抗指数均增加,差异显著(<0.01<0.01)。与OG小鼠比较,OEG小鼠体脂肪率及胰岛素抵抗指数均显著下降(<0.05<0.01)。
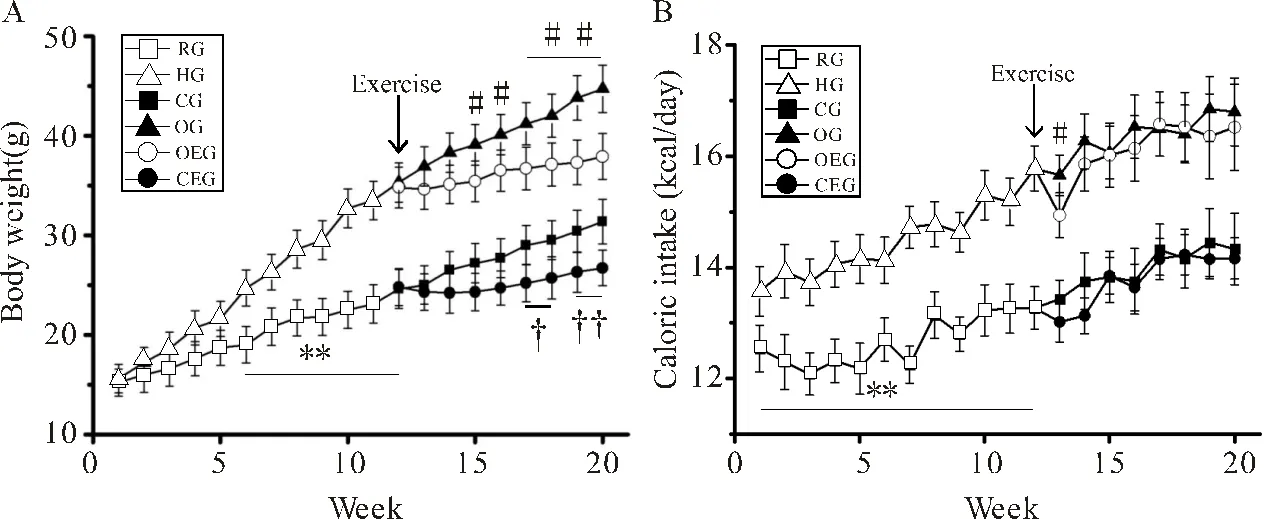
图1 小鼠体重及能量摄入的变化
Figure1. Changes in Body Weight and Energy Intake in Mice
注:(A):小鼠体重变化;(B):小鼠能量摄入量变化。HG与RG比较,**:<0.01;OEG与OG比较,#:<0.05,##:<0.01;CEG与CG比较,†:<0.05,††:<0.01。
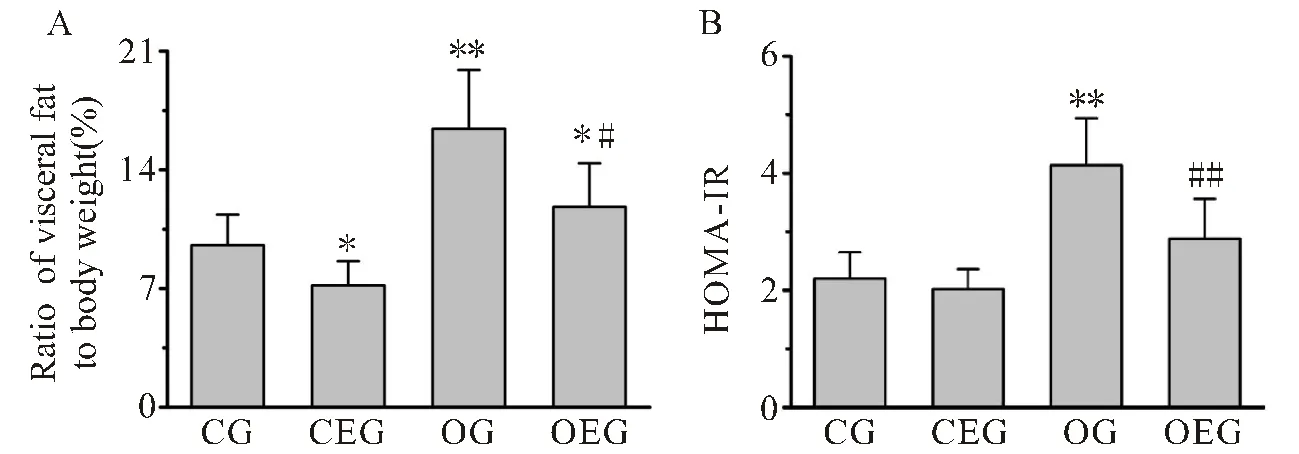
图2 小鼠内脏脂肪率与胰岛素抵抗指数的变化
Figure 2. Comparison of Visceral Fat Rate and Insulin Resistance Index in Mice
注:(A):小鼠内脏脂肪率比较;(B):小鼠胰岛素抵抗指数(HOMA-IR)比较。与CG比较,*:<0.05,**:<0.01;与OG比较,#:<0.05,##:<0.01。
2.3 小鼠自主活动能力变化
如图3所示,HG小鼠从第8周开始自主活动的总距离出现显著下降(<0.05),在第12周自主活动的时间及平均运动速度也出现显著降低(<0.01,<0.01)。在第20周,与CG比较,OG小鼠30 min内自主活动的总距离下降了46.77%(<0.01),自主活动的时间减少了37.56%(<0.01),平均运动速度下降了22.16%(<0.01)。与OG比较,OEG小鼠自主活动的总距离、活动时间及平均运动速度分别增加了37.28%、26.35%和19.22%,差异显著(<0.01,<0.05,<0.01)。
自20世纪90年代以来,政、产、学、研层面都积极推动中药产业现代化,总体上看,中药产业已经成为国家战略性产业。同时也应看到,作为我国传统产业,以中药产业现代化为主要内涵的产业升级仍然比较缓慢,面临诸多障碍因素。具体而言,主要表现在产业链、价值链和技术推动力层面。
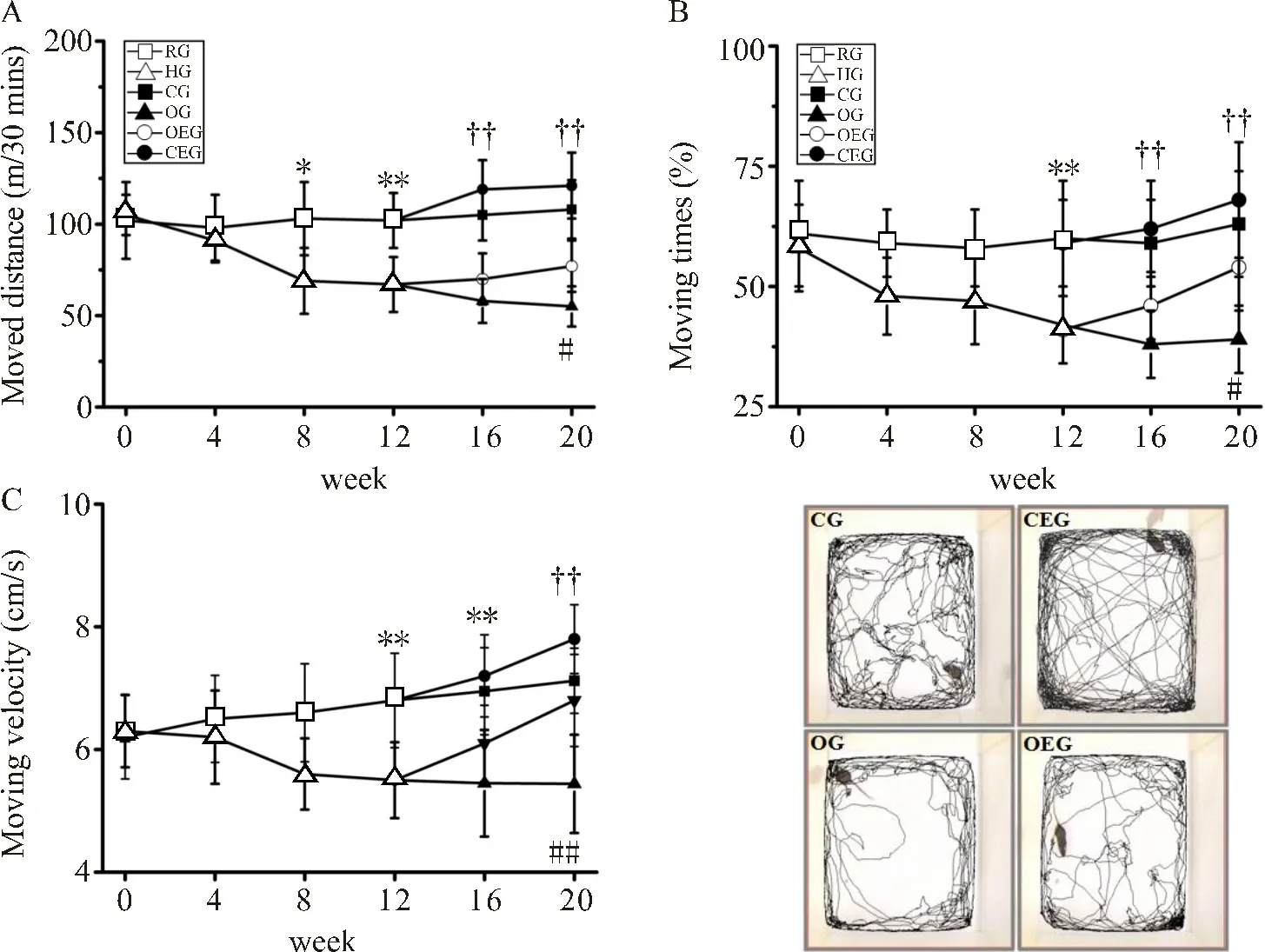
图3 小鼠自主活动能力比较
Figure 3. Comparisons of Autonomic Activity in Mice
注:(A):小鼠自主活动水平变化;(B):小鼠自主活动时间变化;(C)小鼠自主活动速度变化。HG与RG比较,*:<0.05,**:<0.01;OG与CG比较,††:<0.01;OEG与OG比较,#:<0.05,##:<0.01。
2.4 小鼠食物偏爱变化
如图4食物偏爱试验结果显示,OG小鼠对蔗糖与牛奶的偏爱度较CG显著降低(<0.01,<0.01),但对固态食物(高脂膳食)的偏爱却显著高于CG(<0.01)。与OG比较,OEG小鼠对蔗糖溶液及牛奶的偏爱显著升高(<0.01),对高脂膳食的偏爱却显著降低(<0.01)。
2.5 小鼠纹状体DA及其代谢产物水平变化
如图5A所示,OG小鼠纹状体DA水平无论是基础状态下,还是安非他明(AMPH)注射后均显著低于CG(<0.01),分别下降25.61%与19.62%。与OG比较,OEG小鼠纹状体DA水平在基础状态及安非他明注射后的60 min均显著升高(<0.05,<0.05)。但是,注射安非他明后180 min内,OG小鼠纹状体DA水平变化率较CG及OEG均明显增加(<0.01,图5B)。此外,在基础状态及注射安非他明后,OG小鼠纹状体HVA水平较CG显著下降(<0.05);与OG比较,OEG小鼠纹状体HVA水平在注射安非他明后60 min显著升高(<0.05,图5C)。各组小鼠纹状体HVA/DA的变化趋势一致,组间差异不显著(图5D)。

图4 小鼠食物偏爱变化比较
Figure 4. Comparison of Changes in Food Preference in Mice
注:小鼠对不同食物的偏爱,不同食物偏爱度=(24 h单位体重摄入该食物的能量/24 h单位体重总能量摄入)×100%。与CG比较,*:<0.05,**:<0.01;与OG比较,#:<0.05,##:<0.01。下同。
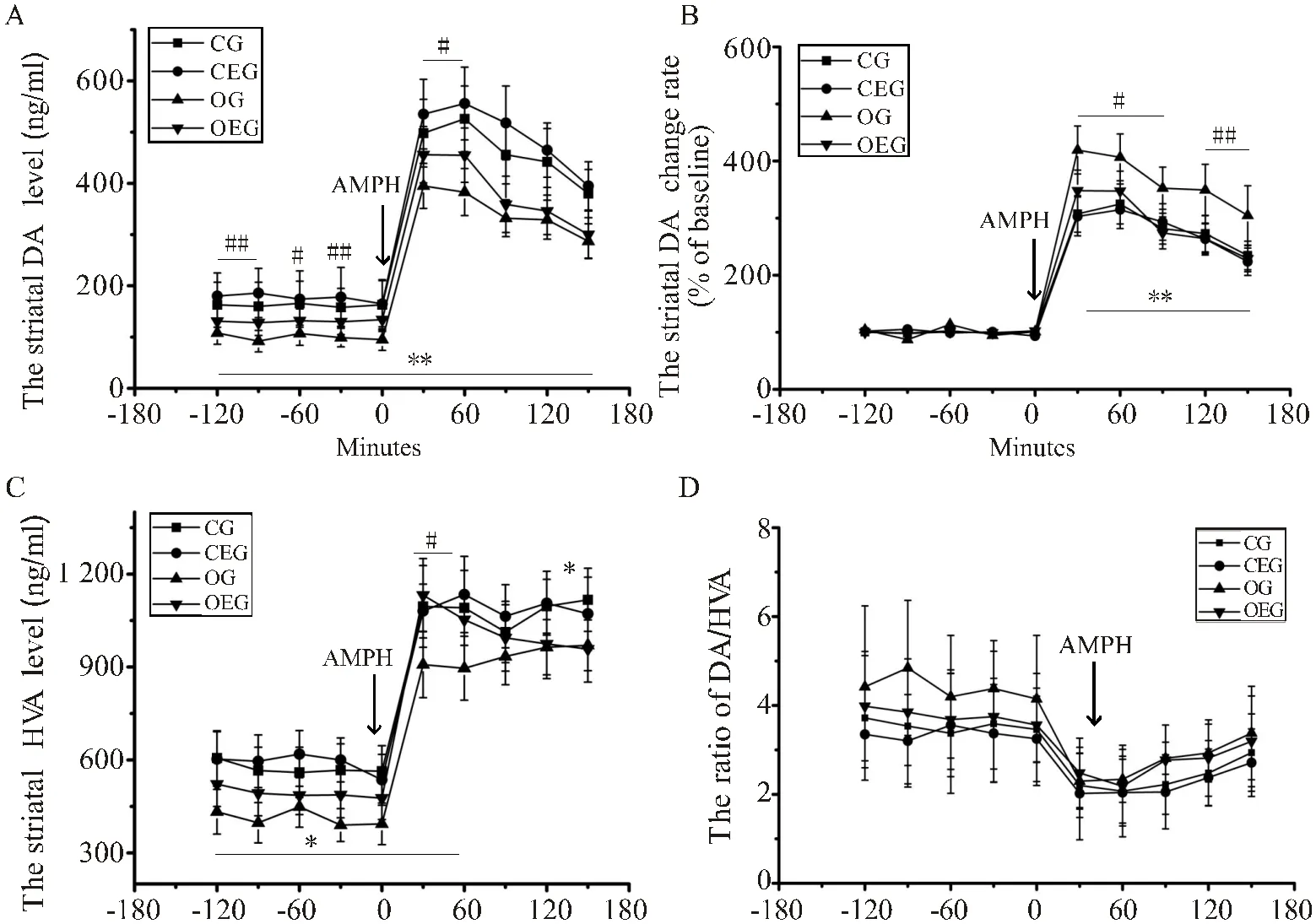
图5 小鼠纹状体DA及其代谢产物水平变化比较
Figure 5. Comparison of DA and Its Metabolites Levels Levels Changes in Striatum of Mice
注:(A):安非他明对小鼠纹状体DA水平的影响;(B):安非他明对小鼠纹状体DA水平的影响;AMPH:安非他明。与CG比较,*:<0.05,**:<0.01;与OG比较,#:<0.05。
2.6 小鼠中脑TH+细胞数量变化
如图6所示,中脑黑质致密部和腹侧被盖区TH+细胞的胞体呈棕黄色染色。与CG比较,OG小鼠的黑质致密部与腹侧被盖区TH+细胞数量分别减少了15.41%(<0.05)和18.75%(<0.05);与OG比较,OEG小鼠这两个部位的TH+细胞数量分别增加了12.62%(<0.05)和15.53%(<0.05)。
2.7 小鼠纹状体TH+纤维表达变化
如图7所示,小鼠纹状体处可见TH+纤维,呈棕黄色染色。与CG比较,OG小鼠背侧纹状体与伏隔核的TH+纤维表达分别减少16.36%(<0.05)和17.48%(<0.05);与OG比较,OEG小鼠这两个部位的TH+纤维表达分别增加了12.54%(<0.05)和14.13%(<0.05)。
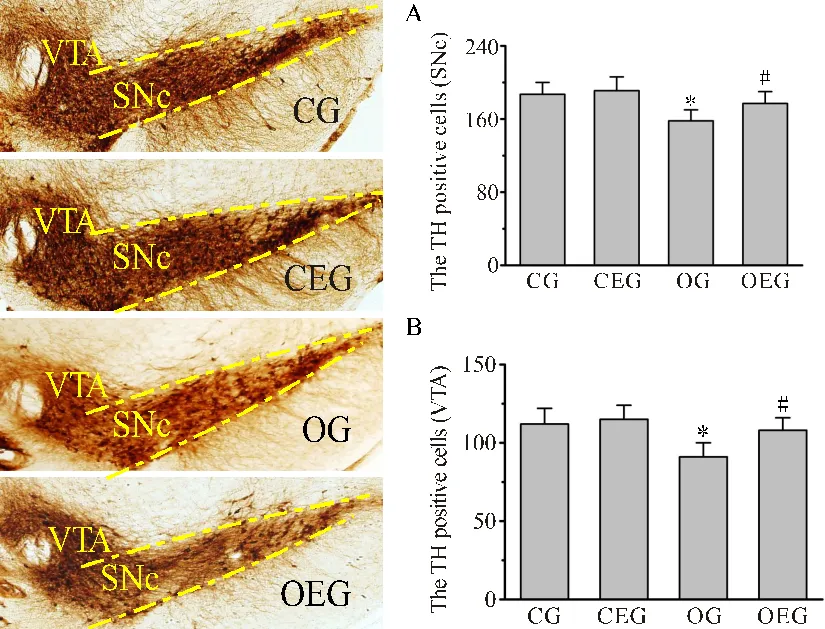
图6 小鼠中脑TH阳性细胞数量比较
Figure 6. Comparison of TH Positive Cells in the Midbrain of Mice
注:SNc:黑质致密部;VTA:中脑腹侧被盖区。与CG比较,*:<0.05;与OG比较,#:<0.05。
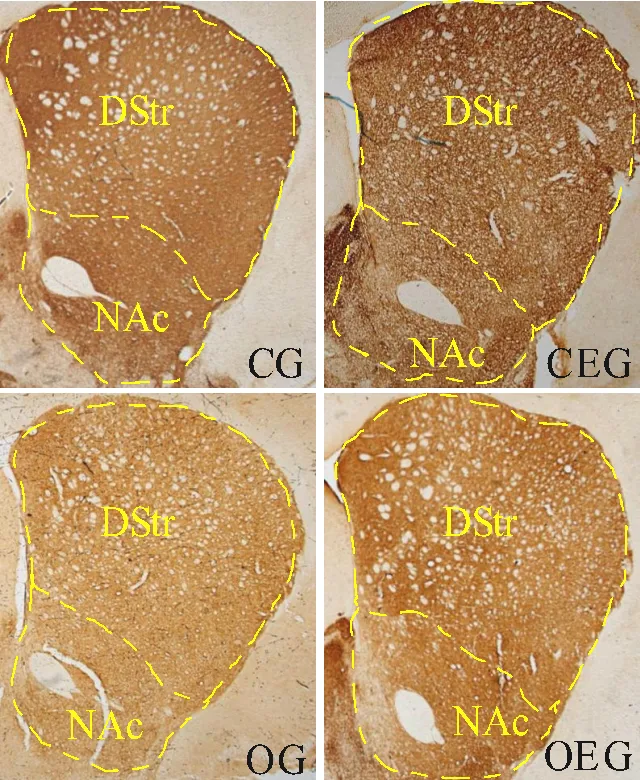
图7 小鼠纹状体TH阳性纤维表达比较
Figure 7. Comparison of TH Positive Fibers Expression in Striatum of Mice
注:DStr:背侧纹状体;NAc:伏隔核。与CG比较,**:<0.01;与OG比较,#:<0.05。
2.8 小鼠中脑-纹状体TH蛋白表达变化
如图8所示,与CG比较,OG小鼠中脑及纹状体TH蛋白表达分别下降了18.46%(<0.05)和16.35%(<0.05);与OG比较,OEG小鼠中脑与纹状体的TH蛋白表达分别增加12.23%(<0.05)和11.58%(<0.05)。

图8 小鼠中脑-纹状体TH蛋白表达比较
Figure 8. Comparison of TH Protein Expression in Mice's Midbrain-Striatum System
注:(A):小鼠中脑TH蛋白表达比较;(B):小鼠纹状体TH蛋白比较。与CG比较,*:<0.05;与OG比较,#:<0.05。
3 讨论
肥胖与低水平身体活动及过度摄取富含热量的适口性食物相关[2,33]。因此,增加身体活动水平,降低高能量食物的摄入作为肥胖防治的重要策略而备受推崇。美国运动医学会(ACSM)建议,超重和肥胖人群每日应保持60 min的中等强度身体活动,并相应减少500~1 000 kcal能量摄入。然而,对肥胖者来说,长期保持较高水平身体活动并控制能量摄入非常困难[10,32]。自发性身体活动与进食行为在很大程度上受中脑-纹状体DA通路调控。其中,黑质致密部DA能神经元主要投射至背侧纹状体,参与随意运动的启动与调节。腹侧被盖区的DA能神经元主要投射至腹侧纹状体,即伏隔核,此区域与奖赏有关的学习和记忆过程相关[21,14]。越来越多的研究发现,纹状体DA信号障碍与肥胖存在密切的关系[25]。肥胖形成过程中通常伴随着纹状体神经可塑性的多种变化,包括DA合成与释放的改变、DA受体与转运体表达以及神经元电活动异常等[12,16,17,26]。长期高脂饮食引起肥胖后,纹状体DA传递效能的变化,一方面可能导致自发性身体活动水平减少;另一方面可能会降低大脑奖赏系统对适口性食物的应答反应,个体通常需要增加食物摄入量以代偿纹状体DA水平的下降,这都将进一步加剧肥胖程度[25,16]。规律的运动锻炼不但可改善肥胖者血管功能、血糖控制能力、胰岛素敏感度及认知功能等,还可使超重与肥胖者保持健康体重,对肥胖防治具有重要意义[13,22,34]。神经可塑性(neural plasticity)是指中枢神经系统结构及功能具有对环境变化产生适应的能力。目前,运动防治肥胖的生物学机制是否与中脑-纹状体DA神经可塑性有关,尚未取得一致认识。
3.1 有氧运动可改善高脂饮食诱导肥胖小鼠自主活动能力及饮食偏爱
本研究发现,经过20周高脂饮食诱导的肥胖小鼠,其体重、内脏脂肪率、胰岛素抵抗均明显增加,自主活动水平与自主活动能力明显降低,同时对高脂饮食表现出较高的偏爱度。这在一定程度上将进一步促进能量正平衡,加剧肥胖程度。本研究采用中等强度的被动跑台运动干预,发现8周运动可明显减缓高脂饮食诱导的肥胖小鼠体重增长、降低内脏脂肪率、改善胰岛素抵抗。同时发现,运动干预还显著增加了肥胖小鼠的自主活动水平和自主活动能力,并降低了肥胖小鼠对高脂饮食的偏爱。值得注意的是,运动干预并未使小鼠的能量摄入发生明显变化,在运动干预开始后的第1周,肥胖小鼠能量摄入甚至出现暂时下降。因此,本研究推断,有氧运动干预减缓肥胖小鼠体重增长与其自主活动能力提高及高脂饮食减少有关。众多研究发现,肥胖者自发性身体活动水平明显下降[28,1]。日常身体活动能量消耗可占到一日能量总消耗量的20%以上,通过运动干预不但可增加能量消耗,而且可通过神经系统及骨骼肌肉系统的重塑提高自主活动能力,这可能是运动干预促进日常自发性身体活动水平的重要原因之一。越来越多的研究认为,除了增加能量消耗外,运动锻炼还可以调节肥胖者能量摄入。Fearnbach等人的研究证实,肥胖青少年进行45 min中等强度急性运动后其神经系统对食物相关刺激的反应程度出现降低[9]。还有研究发现,24周中等强度运动干预可以引起肥胖者脑岛与视皮质神经元对食物视觉刺激的反应显著降低,且变化程度与体重及体脂的降低程度呈正相关[7]。功能磁共振成像(fMRI)研究提示,急性运动和长期的运动锻炼均可减少奖赏、记忆及视觉处理等相关脑区对高热量食物线索的反应,从而减少肥胖者对食物线索的反应性与过度进食的倾向性[8,18]。由于自发性身体活动、进食行为受中脑-纹状体的DA系统的调控。由此,推测规律运动防治肥胖的神经生物学机制可能与纹状体DA水平改变有关。
3.2 有氧运动可缓解高脂饮食诱导肥胖小鼠纹状体DA水平下降
纹状体的DA主要来自中脑黑质致密部和腹侧被盖区的DA能神经元轴突终末的释放,突触间隙的DA通过与突触后受体结合发挥生物学效应[14]。本研究发现,基础状态下,高脂饮食诱导肥胖小鼠纹状体DA及其代谢产物HVA水平显著降低,这将引起纹状体DA信号传递效能下降,对肥胖小鼠的自主活动能力及进食行为将会产生深刻影响。为了检验中脑DA神经元对外源性刺激的反应能力,本研究对小鼠进行了腹腔注射安非他明。安非他明是一种弱碱,可促进DA从突触前囊泡释放至突触间隙,显著增加纹状体胞外DA水平[26]。研究结果发现,在基础状态与安非他明注射后,肥胖小鼠纹状体DA的绝对水平都低于对照组小鼠。但是注射安非他命明后,肥胖小鼠纹状体DA水平变化率却显著高于对照组小鼠。这可能由于DA神经元为了代偿纹状体DA水平的下降,通过增强神经元活动而实现的。DA神经元放电模式由单放电向爆发式放电转变可以引起突触后DA的大量释放[3]。胞内的DA在单胺氧化酶的作用下可转化为二羟基苯乙酸(DOPAC),后者在胞外可由儿茶酚氧位甲基转移酶(COMT)催化为HVA。因此,纹状体胞外HVA/DA在一定程度上可反映DA的代谢速率[3,5]。与对照组小鼠比较,肥胖小鼠纹状体HVA/DA未显著改变,提示,纹状体DA的代谢速率没有受到显著影响,DA水平下降可能主要是突触前DA合成减少所致。此外,本研究还发现,8周有氧运动可显著提高肥胖小鼠纹状体DA水平,并降低安非他明诱导的DA变化率。提示,运动干预可促进中脑-纹状体DA合成,并降低DA神经元对外源性刺激的反应。这可能是有氧运动增加肥胖小鼠自主活动并降低高脂饮食偏爱的重要原因之一。
3.3 有氧运动可上调高脂饮食诱导肥胖小鼠黑质致密部-背侧纹状体酪氨酸羟化酶表达
中脑DA合成的限速酶是TH。本研究发现,高脂饮食诱导的肥胖小鼠中脑黑质致密部的TH+细胞与背侧纹状体TH+纤维表达均显著减少。提示,肥胖小鼠黑质致密部-背侧纹状体通路DA传递效能降低,纹状体DA水平下降与此有关。黑质-纹状体DA系统最主要的功能是调控躯体运动[14]。纹状体内接受DA调节的中等多棘神经元可分为两种不同的亚群,分别参与基底神经节直接通路(direct pathway)与间接通路(indirect pathway)的构成[21]。其中,直接通路中表达多巴胺D1类受体的神经元投射至黑质网状部与苍白球内侧部,间接通路的神经元表达有D2类受体投射至苍白球外侧部。因此,DA释放至纹状体后通过兴奋直接通路,抑制间接通路减少基底神经节对丘脑的抑制,提高丘脑向皮层冲动的发放并启动运动[14,21]。Jang等人的研究也发现,高脂饮食喂养可下调小鼠黑质致密部与背侧纹状体TH表达水平,进而降低其自主活动水平[16]。众所周知,黑质-纹状体DA缺失与帕金森病的典型运动功能障碍有关。帕金森病动物模型黑质DA能神经元丢失可达到80%以上,纹状体DA水平也至少下降70%[15]。而在本研究中,肥胖小鼠黑质致密部TH+细胞及背侧纹状体的TH+纤维减少均未超过20%,纹状体DA水平减少也未达到30%。因此,推测高脂饮食诱导的肥胖小鼠纹状体DA水平下降的原因主要是DA合成速率下降,并非DA神经元变性所致。本研究还发现,8周有氧运动可显著增加高脂饮食诱导肥胖小鼠黑质致密部-背侧纹状体TH表达,表明有氧运动可通过促进黑质致密部-背侧纹状体DA合成增加肥胖小鼠纹状体DA水平,有效促进该通路的神经传递过程,增强基底神经节对躯体运动的调节能力。这可能正是有氧运动改善肥胖小鼠自主活动能力的神经生物学机制之一。
3.4 有氧运动可上调高脂饮食诱导肥胖小鼠腹侧被盖区-伏隔核酪氨酸羟化酶表达
中脑腹侧被盖区-伏隔核DA系统是大脑奖赏的核心通路[29]。伏隔核是腹侧纹状的重要组成部分,除接受中脑腹侧被盖区的DA神经纤维支配以外,还要接受前额叶皮层、海马、杏仁核等核团的谷氨酸能投射,伏隔核还发出γ-氨基丁酸能神经纤维返回至腹侧被盖区,也可投射至黑质网状部与腹侧苍白球,参与动机、奖赏及其他情绪活动的调控[19]。本研究结果显示,高脂饮食诱导肥胖小鼠腹侧被盖区-伏隔核TH+细胞与TH+纤维表达降低,这同样与纹状体DA水平下降有关。提示,高脂饮食诱导的肥胖小鼠腹侧被盖区-伏隔核DA传递效能下降。适口性食物及其相关信息的刺激可引起伏隔核部位DA释放增加,DA与突触后受体结合驱动个体产生觅食动机以及进食后的奖赏效应[19]。富含脂肪类的食物对哺乳动物而言是一种天然奖赏源,但长期暴露在高脂饮食环境中,其大脑奖赏系统对食物反应的敏感性也会随之降低,面对适口性的食物,个体通常需要增加摄食量以产生预期的食物奖赏[31]。前期研究发现,12周高脂饮食可降低小鼠中脑腹侧被盖区-伏隔核系统TH表达[4]。Geiger等人的实验也发现,过量摄入高脂膳食可降低啮齿类动物腹侧被盖区及伏隔核DA水平[21]。本研究还发现,8周有氧运动干预可显著上调高脂饮食诱导肥胖小鼠腹侧被盖区-伏隔核TH表达,增加其纹状体DA水平,同时降低对高脂饮食的偏爱。Moody等人的实验曾发现自主转轮运动可降低大鼠对适口性食物的偏爱[24]。有研究认为,自主运动之所以能够减少大鼠摄入高脂膳食并抑制其体重增加是因为运动产生的享乐效应(hedonic effects)可替代食物奖赏[23]。其原因可能与运动促进纹状体DA释放,在一定程度上补偿了肥胖动物纹状体DA不足。本研究采用中等强度的被动跑台运动干预,运动强度与运动时间均比较适中,正式运动干预前小鼠接受了适应性训练,运动过程中并未因受到其他刺激而产生过度应激,在运动训练中表现出较强的自主性。这也可能对肥胖小鼠产生一定的运动奖赏,会促进DA合成及释放以代偿伏隔核DA的不足,降低对高脂饮食的偏爱,进而改善饮食结构。
本研究认为,有氧运动促进高脂饮食诱导肥胖小鼠中脑DA合成的机制可能与神经保护作用有关。运动锻炼可以上调多种神经营养因子表达,进而对中脑DA神经元产生神经保护作用[15]。例如,脑源性神经营养因子(Brain-derived neurotrophic factor, BDNF)可能介导了这一重要过程[14,35]。同时,有氧运动缓解高脂饮食诱导肥胖小鼠中脑DA合成降低,在一定程度上解释了高脂饮食诱发肥胖后促进帕金森病风险,以及运动锻炼降低这种风险的原因。探讨肥胖者DA神经可塑性的运动调节机制,并以此为依据制定合理的运动干预措施,将有助于优化减肥运动处方,对降低肥胖及其相关疾病风险具有重要意义。
4 小结
综上所述,除增加能量消耗外,8周有氧运动干预可通过提高中脑-纹状体TH表达,促进DA合成,增加纹状体DA水平,改善高脂饮食诱导肥胖小鼠自主活动水平与能力,并降低高脂饮食摄入,进而达到控制体重的作用。中脑-纹状体DA神经可塑性可能是有氧运动防治肥胖的神经生物学机制之一。
[1] BERGLIND D, WILLMER M, ERIKSSON U,. Longitudinal assessment of physical activity in women undergoing Roux-en-Y gastric bypass [J]. Obes Surg, 2015, 25(1): 119-125.
[2] BOUCHARD C, BLAIR S N, KATZMARZYK P T. Less sitting, more physical activity, or higher fitness ? [J] .Mayo Clin Proc, 2015, 90(11): 1533-1540.
[3] BRANCH S, GOERTZ B, SHARPE A,. Food restriction increases glutamate receptor-mediated burst firing of dopamine neurons [J]. J Neurosci, 2013, 33(34): 13861-13872.
[4] CHEN W, WANG H J, SHANG N N,. Moderate intensity treadmill exercise alters food preference via dopaminergic plasticity of ventral tegmental area-nucleus accumbens in obese mice [J]. Neurosci Lett, 2017, 641: 56-61.
[5] CONE J J, ROBBINS H A, ROITMAN J D,. Consumption of a high fat diet affects phasic dopamine release and reuptake in the nucleus accumbens [J]. Appetite, 2010, 54(3):640.
[6] CORDEIRA J W, FRANK L, ESTEVES M S,. Brain-derived neurotrophic factor regulates hedonic feeding by acting on the mesolimbic dopamine system [J]. J Neurosci, 2010, 30(7): 2533-2541.
[7] CORNIER M A, MELANSON E L, SALZBERG A K,. The effects of exercise on the neuronal response to food cues [J]. Physiol Behav, 2012, 105(4): 1028-1034.
[8] EVERO N, HACKETT L C, CLARK R D,. Aerobic exercise reduces neuronal responses in food reward brain regions [J]. J Appl Physiol, 2012, 112(9):1612-1619.
[9] FEARNBACH S N, SILVERTT L, PEREIRA B,. Reduced neural responses to food cues might contribute to the anorexigenic effect of acute exercise observed in obese but not lean adolescents [J]. Nutr Res, 2017, 44: 76-84.
[10] FINLASON G, ARLOTTI A, DALTON M,. Implicit wanting and explicit liking are markers for trait binge eating. A susceptible phenotype for overeating [J]. Appetite, 2011, 57(3): 722-728.
[11] FINKELSTEIN E A, KHAVJOU O A, THOMPSON H,. Obesity and severe obesity forecasts through 2030 [J]. Am J Prev Med, 2012, 42(6): 563-570.
[12] GEIGER B M, HABURCAK M, AVENA N M,. Deficits of mesolimbic dopamine neurotransmission in rat dietary obesity [J]. Neuroscience, 2009, 159(4):1193-1199.
[13] GOULOPOULOU S, BAYNARD T, FRANKKIN R M,. Exercise training improves cardiovascular autonomic modulation in response to glucose ingestion in obese adults with and without type 2 diabetes [J]. Metabolism, 2010, 59(6): 901-910.
[14] HEGARTY S V, SULLIVAN A M, O'KEEFFE G W. Midbrain dopaminergic neurons: A review of the molecular circuitry that regulates their development [J]. Dev Biol, 2013, 379(2):123-138.
[15] HOU L J, CHEN W, LIU X L,. Exercise-induced neuroprotection of the nigrostriatal dopamine system in Parkinson’s disease [J]. Front Aging Neurosci, 2017, 9:358.
[16] JANG Y, LEE M J, HAN J,. A high-fat diet induces a loss of midbrain dopaminergic neuronal function that underlies motor abnormalities [J]. Exp Neurobiol, 2017, 26(2): 104–112.
[17] JOHNSON P M, KENNY P J. Dopamine D2 receptors in addiction like reward dysfunction and compulsive eating in obese rats [J]. Nat Neurosci, 2010, 13(5): 635-641.
[18] KILLGORE W D S, KIPMAN M, SCHWAB Z J,. Physical exercise and brain responses to images of high-calorie food [J]. Neuroreport, 2013, 24(17): 962-967.
[19] KOYMA S, KAWAHARADA M, TERAI H,. Obesity decreases excitability of putative ventral tegmental area GABAergic neurons [J]. Physiol Rep, 2013, 5:e00126.
[20] KRAVITZ A V, ONEAL T J, FRIEND D M. Do dopaminergic impairments underlie physical inactivity in people with obsesity ? [J]. Front Hum Neurosci, 2016,10:514.
[21] KREITZER A C, MALENKA R C. Striatal plasticity and basal ganglia circuit function [J]. Neuro, 2008, 60(4): 534-554.
[22] KUROSE S, TSUTSUMI H, YAMANAKA Y,. Improvement in endothelial function by lifestyle modification focused on exercise training is associated with insulin resistance in obese patients [J]. Obes Res Clin Pract, 2014, 8(1): 106-114.
[23] LIANG N C, BELLO N T, MORAN T H,. Wheel running reduces high-fat diet intake, preference and mu-opioid agonist stimulated intake [J]. Behav Brain Res, 2015, 284:1-10.
[24] MOODY L, LIANG J, CHOJ P P,. Wheel running decreases palatable diet preference in Sprague-Dawley rats [J]. Physiol Behav, 2015, 150:53-63.
[25] NAEF L, PITMAN K A, BORGLAND S L. Mesolimbic dopamine and its neuromodulators in obesity and binge eating [J]. CNS Spectr, 2015, 20(6): 574-583.
[26] NANEIX F, TANTOT F, GLANGETAS C,. Impact of early consumption of high-fat diet on the mesolimbic dopaminergic system [J]. eNeuro, 2017, 4(3).
[27] PAXINOS G, FRANKLIN K B J. The Mouse Brain in Stereotaxic Coordinates [M]. London: Academic Press, 2001.
[28] REDMAN L M, HEILBRONN L K, MARTIN C K,. Metabolic and behavioral compensations in response to caloric restriction: implications for the maintenance of weight loss [J]. PLoS One, 2009, 4(2): e4377.
[29] RICHARD M, PAUL J K. Role of striatal dopamine signaling in compulsive eating associated with obesity [J]. Curr Opin Behav Sci, 2016, 9:152-157.
[30] SCHEFER V, TALAN M I. Oxygen consumption in adult and aged C57BL/6J mice during acute treadmill exercise of different intensity [J]. Exp Gerontol, 1996, 31(3): 387-392.
[31] STICE E, SPOOR S, BOHON C,. Relation between obesity and blunted striatal response to food is moderated by TaqIA A1 allele [J]. Science, 2008, 322(5900): 449-452.
[32] SWIFT D L, JOHANNSEN N M, LAVIE C J,. The role of exercise and physical activity in weight loss and maintenance [J]. Prog Cardiovasc Dis, 2014, 56(4): 441-447.
[33] SWINBURN B A, SACKS G, HALL K D,. The global obesity pandemic: shaped by global drivers and local environments [J]. Lancet, 2011, 378(9793): 804-814.
[34] TANG D H, TAO S, MA J L,. The effect of short cardio on inhibitory control ability of obese people [J]. Int J Imag Syst Tech, 2017, 27(4): 345-353.
[35] WU S Y, WANG T F, YU L,. Running exercise protects the substantia nigra dopaminergic neurons against inflammation-induced degeneration via the activation of BDNF signaling pathway [J]. Brain Behav Immun, 2011, 25(1): 135-146.
Aerobic Exercise Modulate Body Weight through Midbrain-Striatal Dopaminergic Plasticity in High Fat Diet Induced Obese Mice
CHEN Wei1, LI Juan1, NIU Ya-kai1, ZHAO Xu-dong2, HOU Li-juan2
1.Hebei Normal University, Shijiazhuang 050021, China; 2.Beijing Normal University, Beijing 100875, China.
Objective: To explore the neurobiological mechanism of exercise to prevent obesity, the present study examine whether aerobic exercise had an effect on spontaneous physical activity, food preference, striatal DA level and midbrain-striatal TH expression in obese mice. Methods: C57BL/6J male mice were randomly divided into control group (CG), exercise group (CEG), obese group (OG), obese+exercise group (OEG). The mice in OEG and CEG underwent a treadmill exercise intervention (5-13 m/min, 50 min/ times, 5 times/week, 8 weeks). The spontaneous physical activity of mice was evaluated by the open field test, the food preference test was used to determine the preference of high-fat diet, the striatal DA and HVA levels were detected by high-performance liquid chromatography and electrochemistry, and the expression of the midbrain-striatal TH was detected by immunohistochemistry and western blotting. Results: The weight was significantly increased (<0.01), the level and capacity of spontaneous activity were significantly decreased (<0.01), the preference of high-fat diet was significantly increased (<0.01), the level of striatal DA was significantly decreased (<0.01), and the midbrain - striatal TH expression was significantly decreased (<0.05), in OG mice compared to CG. However, the weight was significantly reduced (<0.01), the level and capacity of spontaneous activity were increased (<0.05), the preference of high-fat diet was significantly reduced (<0.05), the striatal DA level was increased (<0.05), and the midbrain-striatal TH expression was up regulated, in OEG mice compared to OG (<0.05). Conclusion: An 8-week aerobic exercise intervention can inhibits body weight gain, promote DA synthesis by increasing the midbrain-striatal expression of TH, increase the striatal DA level and improve the capacity of spontaneous physical activity and dietary structure in obese mice induced by high fat diet. The exercise-induced midbrain-striatal dopaminergic plasticity may be one of the important mechanisms for this adaptation.
G804.5
A
2018-04-28;
2018-12-10
国家自然科学基金项目(31401018);河北师范大学博士(后)科研启动基金项目(L2018B24)。
陈巍,男,副教授,博士,主要研究方向为运动防治肥胖的神经生物学机制,Email:chenweibcg@163.com。
侯莉娟,女,副教授,博士,主要研究方向为运动生理学与神经生物学,Email:houlj@bnu.edu.cn。
1000-677X(2018)12-0053-09
10.16469/j.css.201812006
