CD4+细胞毒性T细胞在临床HIV感染中的研究进展
2019-01-03周明菊张和倩宋锦文王福生
李 静,周明菊,张和倩,宋锦文,张 超,王福生
经典的CD4+T细胞主要在抗体产生、抗原特异性CD8+T细胞活化、免疫调节等过程中发挥辅助功能。具有直接细胞毒性的CD4+T细胞最早在同种异体免疫排斥反应中得以描述,这种现象在很长时间内被认为是由于体外培养产生的假象[1]。经系列研究发现,CD4+细胞毒性T细胞(CD4+cytotoxic T cells, CD4 CTLs)在人和小鼠中广泛存在[2]。CD4 CTLs通过II类人类白细胞抗原(human leucocyte antigen-II, HLA-II)依赖、抗原特异性的方式识别靶细胞,分泌细胞毒性物质如颗粒酶、穿孔素等发挥杀伤效应。CD4 CTLs也进一步被证实在病毒感染[2]、肿瘤[2-4]、自身免疫病[2,5-6]、疫苗接种[7]等过程中发挥重要作用。尤其是在感染性疾病中,包括流感病毒、巨细胞病毒、EBV、人类乳头瘤病毒及HIV等都已有广泛报道。近年来,随着单细胞组学技术的应用,如单细胞转录组测序、质谱流式、T细胞受体(T-cell receptor, TCR)的单细胞层面测序分析等,大大促进了对CD4 CTLs谱系分化、功能特点的认识。在HIV感染中,新近研究表明CD4 CTLs在病毒控制中发挥了非常重要的作用,并展现出非常好的免疫治疗应用前景。本文将围绕近年来国内外有关CD4 CTLs及其在临床HIV感染中的作用的重要研究进展进行综述。
1 CD4 CTLs的表型与分化机制
经典的免疫学理论中T细胞在胸腺中发育成两个主要的亚群:HLA-II依赖的CD4+Th和HLA-I依赖的CD8+细胞毒性T细胞(CD8+cytotoxic T cells, CD8 CTLs)。CD4+Th主 要受Th诱导含有BTP / POZ结构域的Kruppel样锌指转录因子(Th-inducing BTB/POZ domaincontaining Kruppel-like zinc-finger transcription factor, ThPOK)控制,而CD8 CTLs主要受Runt相关转录因子3(Runt related transcription factor 3,RUNX3)调控。ThPOK和RUNX3互相拮抗,共同调控T细胞的分化[8]。CD4 CTLs的转录调控与CD8 CTLs更为接近,在CD4 CTLs中,ThPOK的活性受到抑制,RUNX3活性上调[2],这种转变也依赖锌指结构转录因子家族的成员MAZR对ThPOK 沉默子的调控[9]。
CD4+Th有非常高的异质性,可进一步分为Th0、Th1、Th2、Th9、Th17、Th22、滤泡辅助性T细胞(follicular helper T cell, Tfh)、调节性T细胞(regulatory T cells, Tregs)等亚群,不同的亚群分别对应不同的分化调控信号、关键转录因子、效应细胞因子和功能[7]。不同CD4+Th亚型细胞其表型也并不是一成不变,在特定生理、病理条件下还能够相互转化[2]。近年来研究发现,部分CD4+T细胞能够在胸腺外进一步分化为具有类似CD8 CTLs和NK细胞的直接细胞杀伤功能的亚群。CD4 CTLs在不同的病理条件下,主要在机体外周、肠道和肺等相应病灶部位存在[10],可从Th0[2,11]、Th1、Th2[2]、Th17[2]以及 Tregs[2,12]等效应性亚群分化而来。
CD4 CTLs的表型界定目前主要根据其功能性,包括类似CD8 CTLs和NK细胞中细胞杀伤功能相关的因子,如转录因子T-bet、Eomes,效应因子颗粒酶、穿孔素、CD107a和杀伤调控分子NKG2A、NKG2C、NKG2D、KLRG1等。一直以来,对CD4 CTLs的分化缺乏系统认识。Takeuchi等[10]发现,一小部分初始CD4+T细胞在激活后表达I类限制性T细胞相关分子(class I-restricted T cell-associated molecule, CRTAM),CRTAM+T细胞在培养后分泌IFN-γ,表达细胞杀伤毒性相关基因,在IL-2存在条件下,高表达穿孔素,并表现出细胞毒性功能,由此表明CRTAM+T细胞是CD4 CTLs的前体。值得注意的是,CRTAM也是CD8 CTLs和NK细胞的早期活化标志物[2]。此外,CD4 CTLs上低表达CD27和CD28,表现为已高度分化、终末期的T细胞表型,这可能与持续的抗原刺激与慢性炎症的微环境相关[2]。近来Patil等[13]通过单细胞转录组分析的研究显示,CD4+T细胞中毒性相关基因富集在CD4+TEMRA(CD3+CD4+CD45RA+CCR7-)亚群。此外,还鉴定出CD4+TEMRA亚群中IL-7Rhigh的细胞为CD4 CTLs的前体细胞。
2 CD4 CTLs的细胞毒性效应机制
2.1 经典途径 CD4 CTLs发挥作用的两种经典的细胞毒性效应机制与CD8 CTLs和NK细胞类似。第一种是Fas/FasL介导的途径,效应细胞表面表达的Fas配体(如FasL、CD95L、CD178)与靶细胞上表达的同源Fas受体CD95连接,靶细胞上Fas的三聚体导致胞内FADD/caspase8/c-FLIP诱导死亡信号复合体的重新招募,最终导致caspase3介导的凋亡细胞的死亡[7]。第二种是穿孔素/颗粒酶途径,细胞毒素颗粒在特异性TCR信号传导后发生胞吐作用,成孔蛋白穿孔素是这些颗粒中作用最好的细胞毒性分子,它能够将细胞毒素分子如颗粒酶和颗粒溶素直接转移到靶细胞中。上述两种途径并不互斥,可共同发挥作用,但其偏好会受到刺激信号强度及局部微环境的影响。例如,在高浓度特异性抗原且IL-2缺失的条件下,CD4 CTLs更倾向于采用Fas/FasL通路杀伤靶细胞;在低抗原浓度有IL-2存在的条件下,倾向于采用穿孔素/颗粒酶途径介导的杀伤[14]。
2.2 非经典途径 除上述的两种途径外,可能还存在其他非经典杀伤途径。研究发现,在同时有Fas/FasL和穿孔素表达缺陷的CTL中仍具有部分细胞毒活性,进一步对CD4 CTLs克隆和杀伤途径的杀伤性进行检测,发现穿孔素和Fas途径仅占其杀伤性的40%[15]。
2.2.1 分泌型、膜型的TNF-α和淋巴毒素 TNF-α和淋巴毒素(lymphotoxin, LT)都存在分泌型和膜型两种形式。它们都可以介导靶细胞的死亡。在CD4 CTLs膜上存在膜型TNF-α和LT,它们能以类似Fas/FasL的方式介导靶细胞的杀伤[16]。
2.2.2 与TNF相关的杀伤途径 与TNF类似稍弱的凋亡诱导物(TNF-like weak inducer of apoptosis,TWEAK)属于TNF超家族,由249个氨基酸组成,属于二型膜蛋白,胞内段与TNF极相似。可溶性TWEAK可诱导靶细胞凋亡,此杀伤途径可被caspase抑制剂所阻断。它也能表达于CD4 CTLs上,参与诱导靶细胞的凋亡,以此途径杀伤激活的巨噬细胞。其杀伤途径与TNF类似,但杀伤能力较弱。
TNF相关凋亡诱导配体(TNF-related apoptosis-inducing ligand, TRAIL),也属于TNF超家族,具有与FasL类似的诱导靶细胞凋亡的能力。其分布比FasL更广泛,能诱导许多细胞,尤其是血源性细胞的凋亡。TRAIL可表达于CD4 CTLs表面,参与诱导激活的巨噬细胞的凋亡,也可杀伤对Fas/FasL途径有抗性的黑色素瘤细胞[16]。
2.2.3 其他 Ohminami等[17]发现一个急性髓性白血病相关的DEK-CAN 融合蛋白特异性CD4 CTLs克隆,能以一种非Fas、非穿孔素、非凋亡的方式,对靶细胞进行直接快速的杀伤。这可能是一种全新的CTL杀伤途径。
3 HIV感染中CD4 CTLs的表型及功能特点
3.1 CD4 CTLs与CD8 CTLs的协同作用 CD8 CTLs介导的特异性细胞免疫被认为是宿主控制急性及慢性感染最重要的途径。已有研究报道,在HIV感染急性期,CD8 CTLs的出现伴随着病毒载量的急剧下降[18]。研究发现,HIV特异性CD8 CTLs识别的表位主要处于包膜蛋白区,而包膜蛋白区具有非常高的变异性,因此病毒极易发生逃逸[19]。首先,病毒能够通过多种方式逃逸CD8 CTLs的识别,例如下调被感染宿主细胞表面的HLA-I的表达[20],此外,病毒还能够产生和积累突变的表位,逃逸CD8 CTLs的识别和杀伤[21]。HIV感染导致CD4+T细胞进行性减少和免疫缺陷,但在多种病毒感染过程中,CD4 CTLs也被证实对疾病的控制至关重要。CD4 CTLs对靶细胞的识别依赖HLA-II,相较CD8 CTLs依赖的HLA-I、HAL-II递呈的抗原可以有更大的多样性和数量[22],降低了病毒逃逸识别表位的可能性[23]。因此CD4 CTLs是宿主抗病毒细胞免疫的重要补充,与CD8 CTLs发挥协同作用。
3.2 CD4 CTLs与HIV感染控制的关系 目前CD4 CTLs相关的研究主要是HIV感染的临床病例观察,尚无临床试验开展。最近越来越多的研究表明,HIV特异性CD4+T细胞在控制HIV复制中可能起关键作用[24-26],尤其在HIV特异性CD8+T细胞应答效率较低的情况下[27]。在HIV-1感染的初期,效应性CD4+T细胞的出现,不仅与急性期病毒载量的变化曲线相关,并且与早期病毒载量的最低值相关,表明它参与了病毒的早期控制[7,28]。许多研究团队针对HIV感染的不同阶段进行了研究,在早期的研究者中,Appay等[29]检测到HIV-1感染初期的患者体内有大量表达穿孔素、GzmA、GMP-17/TIA-1的CD4+T细胞,在慢性感染期会升至更高水平。Johnson等[28]发现在HIV-1感染的疾病早期(primary HIV-1 infection, PHI)的HIV特异性 CD107a+CD4+T细胞中,CD107a+IFN-γ+CD4+T细胞与HIV特异性CD8 CTLs共享转录谱,包括GzmA、B、K和穿孔素的表达,最重要的是HIV特异性CD107a+CD4+T细胞表现出与HIV特异性CD8 CTLs类似的杀伤活性[28]。除此之外,Soghoian等[27]对PHI的未治疗个体进行了纵向研究,发现在感染12个月内病毒复制得到控制的个体与病毒未得到控制的个体相比,HIV特异性CD4+T细胞显著扩增。与非控制者相比,病毒控制者(即长期无进展者)在Gag特异性CD4+T细胞上具有更高的脱颗粒标记CD107a的表达,并且在基线期时有GzmA+HIV特异性CD4+T细胞应答[7,27],同样的现象在猿猴免疫缺陷病毒(simian immunodeficiency virus, SIV)动物感染模型中也得到验证,在删除了CD8+T细胞的猕猴中,CD4 CTLs能够控制SIV的复制[30]。Sacha等[31]发现,在精英控制者恒河猴体内用抗体去除CD8+T细胞后,可重新建立Gag和Nef特异性的CD4+T细胞应答实现对病毒的控制。总之,以上这些研究结果肯定了CD4 CTLs在控制HIV复制和延缓疾病进展方面的作用,详情见表1。
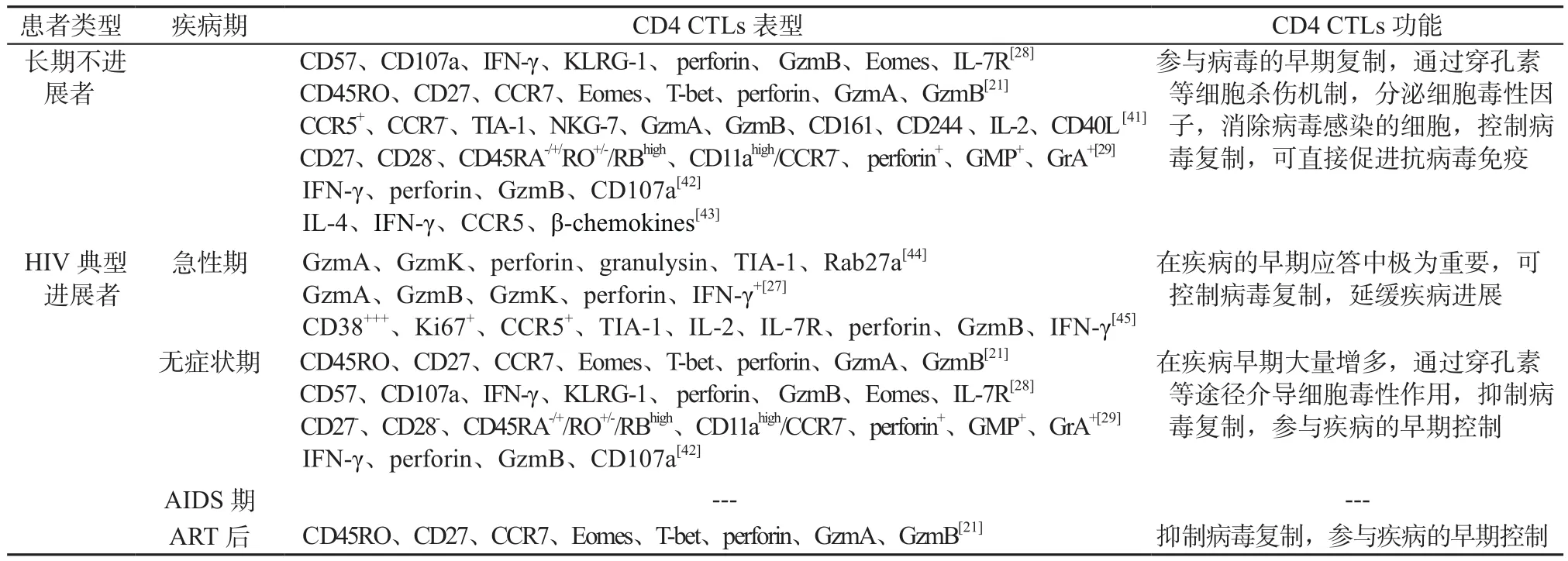
表1 CD4 CTLs在不同类型的HIV患者中的表型及功能Table 1 Phenotype and function of CD4 CTLs in different groups of HIV patients
HLA的基因型与HIV的感染控制极其相关。最为熟知的是在精英控制者中HLA-B57、HLA-B27、HLA-B81等HLA-I类分子亚型与HIV感染更好的控制相关[32]。此外,Benati等[33]最早报道了一类能够识别HIV主要免疫表位Gag293的CD4 TCR,这类TCR能够与多类HLA-DR分子结合,因此也被称作公共TCR。CD4+T细胞的公共TCR具有非常高的抗原结合活性,其存在也是很多精英控制者共有的基因型特征。Galperin等[34]进一步的研究表明,这类公共TCR接受不同HLA-DR递呈的Gag293后,赋予CD4+T细胞毒性功能,可直接杀伤HIV感染的细胞。广泛的HLA-DR交叉限制很可能在HIV感染中具有保护作用,因为它增加了单个个体表达多种限制性HLA-DR等位基因的表位检测概率,转移表达高亲和力公共TCR的CD4+T细胞可促使HIV感染的靶细胞裂解,可作为免疫治疗的工具在遗传背景不同的患者身上实施,以达到HIV的功能性治愈。
HIV也能够通过CD4分子和共受体感染CD4 CTLs细胞。随着疾病的进展,CD4 CTLs的数量也会随着总CD4+T细胞的减少而减少。这点艾滋病与其他感染性疾病有所不同,因此预期CD4 CTLs在HIV感染疾病慢性进展期的作用较小,相关的研究并不多。目前尚无关于CD4+T细胞计数低于50的患者研究。经过抗反转录病毒治疗(anti-retroviral therapy, ART)的患者,其体内HIV特异性CD4 CTLs在疾病早期增多,抑制病毒的复制,控制疾病进展[21](如表1)。在HIV感染中,CD4 CTLs除了对病毒感染细胞进行直接识别和杀伤外,也能以非细胞毒性机制发挥作用,Buggert等[21]近期发现体内T-bet和Eomes双阳性的CD4 CTLs细胞是产生β-趋化因子的主要CD4+T细胞亚群,其分泌的β趋化因子MIP-1α和MIP-1β能够竞争性结合CCR5,抑制HIV入侵。另有文献报道,CD4 CTLs与常规CD25+FoxP3+CD4+T 细胞相比对HIV感染更耐受[35],机制也可能如此,因此有研究认为这些功能特性提高了机体对HIV感染的抵抗力[36]。
3.3 CD4 CTLs在HIV疫苗设计中的应用 在探索HIV治愈策略中诱导保护性抗体和CD8+T细胞应答是预防HIV感染的主要疫苗策略,而特异性CD4+T细胞反应是诱导产生有效抗体和CD8+T细胞应答的关键。部分病毒特异性CD4+T细胞可能作为HIV感染的首要靶点,在猕猴艾滋病模型中,疫苗诱导的病毒特异性CD107a-CD4+T细胞在感染HIV后大量减少,但这项研究同时发现,疫苗诱导的CD107a+CD4+T细胞在病毒攻击后较少耗竭,这意味着诱导这群细胞可能是治疗艾滋病的另一种途径[37]。有研究证实记忆性CD4+T的次级免疫效应功能高度依赖于炎症环境,而IL-12和I型IFN的阻断对记忆性CD4+T细胞的效应性分化有相反作用,进一步探讨炎症环境是如何影响它的次级免疫效应将使人们更好的了解目前的疫苗策略。记忆性CD4+T细胞在参与首次和次级免疫应答过程中介导的保护机制可能是不同的,在制定有效的疫苗接种策略时须更好的了解记忆性CD4+T细胞介导的病原体清除的功能机制,同样对相关细胞因子作用途径的研究也十分必要[38]。
3.4 组织中CD4 CTLs的特点 关于HIV-1感染者外周血方面的研究已有较多报道[8],淋巴细胞主要存在于淋巴器官中,外周血中淋巴细胞的含量仅占总淋巴结的2%,而淋巴器官又是HIV主要的病毒库[21,39],所以淋巴结中是否也存在特异性的CD4 CTLs,以及其在HIV-1感染中发挥的作用是一个非常重要的问题。另有研究报道,在肠道黏膜组织中及炎症部位可显著观察到CD4 CTLs的存在,并可能在抗感染和免疫反应中发挥作用[10]。
新近研究发现,在HIV感染者外周血中存在大量的CD4 CTLs,但在急性感染早期淋巴结中仅存在极少量的CD4 CTLs,而在慢性期的淋巴结中几乎不存在,所以HIV特异性CD4 CTLs可能并不是淋巴结中控制病毒的主要成分。淋巴结中β趋化因子的产生缺乏,也说明了其在HIV的控制中作用甚微。在感染后病毒血症高峰期间,HIV特异性CD4 CTLs应答在外周血中最高,且与T-bet、穿孔素、MIP-1α等的产生增加相符[21]。值得注意的是,先前研究表明淋巴结中的T细胞在获得细胞毒性后从组织进入血液,尽管慢性淋巴细胞脉络丛脑膜炎病毒感染患者淋巴结中特异性CD8+T细胞在急性感染期间可脱粒,但它们并不能有效的杀伤靶细胞[21,40]。该研究结果也适用于慢性HIV感染患者的数据,表明不同亚群的CD4+T细胞在淋巴结和外周血之间存在着脱粒现象,但细胞毒性分子表达水平低且免疫突触受损,它们倾向于CXCR5+表型,提示是一种独特的Tfh亚群脱粒,这种与众不同的表型,至少不是与细胞毒性因子和β趋化因子分泌功能相关,意义还有待进一步研究。本文对文献中已报道的在HIV感染中CD4 CTLs的表型及功能等做了梳理,详见表1。
4 小 结
CD4 CTLs是一种非常重要的免疫效应细胞,广泛参与感染性疾病的免疫应答过程。在HIV感染中,病毒特异性CD4 CTLs通过分泌多种细胞毒性介质发挥杀伤作用以保护机体,但是它优先耗尽的事实使人对其有效的促进HIV控制的能力产生怀疑;CD4 CTLs在HIV感染早期可以控制病毒的复制,但在疾病急性期病毒特异性CD4+T细胞介导的各种短期和长期抗病毒作用的相互作用仍须深入探索;在慢性感染期它依然存在,在感染晚期可能启动免疫功能来控制病毒血症,但最终会丧失,提示可能存在替代因子在疾病进展的后期发挥作用,但这些反应的动力学和特征尚未得到评估;表达抗原高亲和力、广泛交叉限制性的公共TCR CD4+T细胞,分化为CD4 CTLs直接杀伤HIV感染的细胞,能够控制HIV的控制者是否表现出MHC-II介导的选择压力,是否可通过治疗干预来增强这些反应,这些都值得进一步研究,为HIV感染的治愈探索新策略。
