微生物法测定大米中叶酸含量的研究
2019-01-03郭莹莹王哲明丁松乔
◎ 赵 平,郭莹莹,杨 光,王哲明,丁松乔
(1.黑龙江省质量监督检测研究院,黑龙江 哈尔滨 150028;2.国家农业标准化监测与研究中心(黑龙江),黑龙江 哈尔滨 150028)
叶酸是一种水溶性维生素,为维生素B复合体之一,又叫维生素B9,人类如果缺乏叶酸,会引起巨幼红细胞贫血与白细胞减少症。天然叶酸广泛存在于动植物类食品中,尤以肝及绿叶蔬菜中含量比较多[1-2]。
大米是人们生活中的主食之一,其富含丰富的B族维生素,可为人体提供所需的维生素。本实验应用微生物法来测定分析大米中原生叶酸的含量,以鼠李糖乳杆菌为测试菌种,叶酸是其生长必需的营养素,利用其对叶酸的特异性,通过其生长测定大米中原生叶酸的含量,建立大米中原生叶酸含量测定的方法[3-5]。
1 实验材料与方法
1.1 实验试样
大米,产地为黑龙江。
1.2 实验试剂与实验菌种
叶酸标准品(≥99%),磷酸氢二钠,抗坏血酸,盐酸,氢氧化钠,木瓜蛋白酶,α-淀粉酶,鸡胰腺,0.85%氯化钠溶液,叶酸测定用培养基,乳酸杆菌肉汤培养基,鼠李糖乳杆菌Lactobacillus casei spp.rhamnosus(ATCC 7469)。
1.3 实验设备与仪器
天平(感量0.1 mg),恒温震荡培养箱,离心机,电热鼓风干燥箱,生化培养箱,液体分装泵,pH计,洁净台,分光光度计,微量移液器,高压蒸汽灭菌釜,涡旋振荡仪。
1.4 实验方法
1.4.1 玻璃器皿的准备
将玻璃仪器清洗干净,然后烘干备用。
1.4.2 实验菌种的制备
将鼠李糖乳杆菌Lactobacillus casei spp.rhamnosus(ATCC 7469)甘油管(实验室保存)无菌操作转接至乳酸杆菌肉汤中,37 ℃摇床培养24 h,备用。
塔巴林,藏语意为“解脱园”,修建于清乾隆三十六年(1771年),相传是噶丹东竹林寺第三世扎唐活佛倡建。当时,在距寺院约有五里的林地中,有一处尼姑庵,只有几名尼姑住在简易木棚中修习。另外在奔子栏镇支央村有一处小的尼姑庵,也只有几名尼姑,僧舍也极其落魄。鉴于迪庆境内没有一座像样的尼姑寺,三世扎唐活佛决定合并两处小的尼姑庵,用内地买来的布匹换下现今的寺址(寺址原来是东竹林寺所在地),并命名为“塔巴林”,为广大女性信徒提供了一处修行地。
1.4.3 试样的制备与提取
准确称取大米试样(经粉碎,过筛)10 g,至150 mL锥形瓶中。加入20 mL磷酸盐缓冲液Ⅱ(14.2 g磷酸氢二钠,用1 000 mL水溶解。临用前按1.0 g/100 mL加入抗坏血酸,用氢氧化钠溶液调pH至7.7~7.9),混匀后加50 mL水和1.0 mL甲苯。加盖后121 ℃灭菌15 min,然后迅速冷却。加1mL木瓜蛋白酶溶液,于(36±1)℃保温3 h后100 ℃加热3 min,冷却。加1 mL α-淀粉酶溶液,(36±1)℃保温2 h后加4 mL鸡胰腺,加盖,(36±1)℃保温16 h后100 ℃加热3 min,冷却。用1 mol/L盐酸调pH至4.5,用水稀释定容到100 mL。过滤得到澄清滤液,然后吸取1 mL澄清滤液用磷酸盐缓冲液Ⅲ(14.2 g磷酸氢二钠,用1 000 mL水溶解。临用前按1.0 g/100 mL加入抗坏血酸,用氢氧化钠溶液调pH至6.7~6.9)定容至100 mL。同时做空白对照。
1.4.4 叶酸标准曲线管制备
取试管分别加入实验用水(GB/T 6682-2008规定的二 级 水)5.0、5.0、4.0、3.0、2.0、1.0、0.0、2.0、1.0、0.0 mL,每支试管中加入5.0 mL叶酸测定用培养基,再按相应顺序加入叶酸标准工作液(0.05 ng·mL-1)0.0、0.0、1.0、2.0、3.0、4.0、5.0 mL 和标准工作液(0.1 ng·mL-1)3.0、4.0、5.0 mL,相当叶酸含量为0.00、0.05、0.10、0.15、0.20、0.25、0.30、0.40 ng和0.50 ng,每个梯度做3支平行管,试管加塞,121 ℃灭菌5 min。
1.4.5 试样系列管的制备
取4支试管,分别加入4.0、3.0、2.0、1.0 mL水,试样提取液,1.0、2.0、3.0、4.0 mL,然后加入5.0 mL叶酸测定用培养基。每个梯度做3支平行管。试管加塞,121 ℃灭菌 5 min。
1.4.6 接种液的制备
菌种活化好后,将菌悬液无菌条件下离心弃去上清,用无菌生理盐水离心洗涤菌体,弃上清,反复2~3次。以生理盐水做对照,用分光光度计测试菌液透光率,将菌液透光率调至为73%,备用。
试管灭菌后,冷却,每支试管以无菌操作方式接入调好的菌液50 µL,标准曲线管中未接种叶酸标样的S1空白管除外。置37 ℃生化培养箱中培养20 h。
1.4.8 叶酸标准曲线的测定与绘制
目测检查试管,S1未接种菌液管应是澄清的,如有混浊出现,则无效。用涡旋振荡器混合每一支试管中培养液后,将培养液移入比色皿中波长550 nm处测定吸光度。以吸光度OD值为横坐标,叶酸标准品的含量(ng)为纵坐标绘制标准曲线。
以S2接种空白管为空白调零,测试每支试管的OD值。
通过叶酸标准曲线,用OD值来计算每毫升培养液中叶酸的含量,并计算该编号的叶酸含量的平均值。用该平均值计算得出全部编号的总平均值为Cx。
叶酸含量

式(1)中:X为叶酸含量,µg/100g;Cx为总平均值,ng;m为质量,g;f为稀释倍数;EB为鸡胰腺空白管中叶酸含量,ng/mL。
2 结果与分析
2.1 叶酸标准曲线的绘制
培养20 h后,OD值在叶酸含量为0~0.5 ng范围内的线性良好,以吸光度为横坐标(x)、叶酸含量为纵坐标(y)绘制叶酸标准曲线为y=1.3024x2+0.4676x,r=0.996 6,如图1所示。

图1 吸光度与叶酸含量标准曲线图
2.2 重复性试验
同一批次大米样,精密称取10次,依照此方法测定叶酸的含量,结果表明方法的重现性良好,见表1。由表1可得,10次检测的平均值为12.4 µg/100 g,RSD为0.03%。
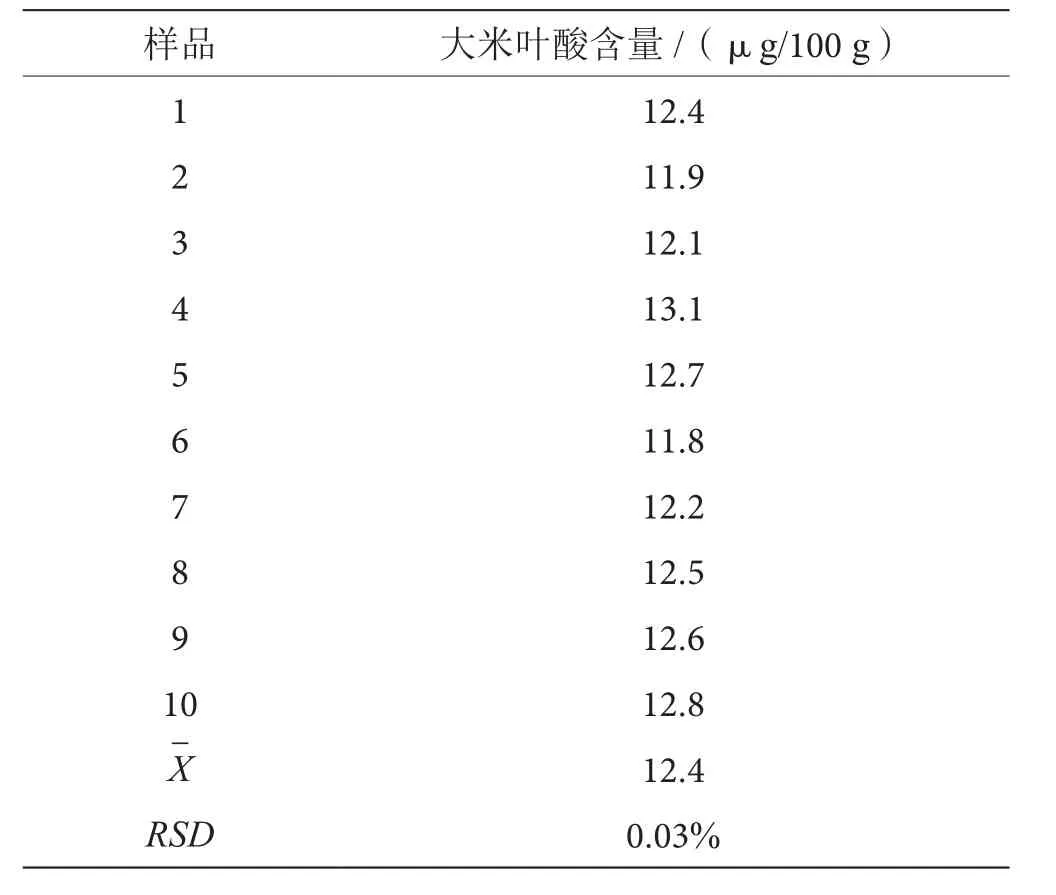
表1 重复性试验结果表
2.3 回收率试验
精密称取同一批次大米样品6份,2份样品做平行实验测出大米的本底叶酸含量,其余4份样品进行加标实验,测定叶酸含量并计算叶酸加标回收率,结果计算得出回收率分别为98.9%、98.4%、97.8%、95.3%,平均回收率为97.6%,RSD为0.016%。
3 结论
本实验通过利用微生物法对大米中原生叶酸含量的测定分析,测得大米样品中原生叶酸含量的RSD为0.03%(n=10),平均回收率达97.6%。表明微生物法测定大米中原生叶酸含量的方法重现性好、精密度高、可靠性强、灵敏度高、样品的制备与叶酸提取操作简单,适用于大米中原生叶酸含量的测定。
