分枝杆菌病噬菌体33D基因组学特征及抗结核潜力*
2019-01-03邬亭亭魏强郭述良刘平罗永艾
邬亭亭 魏强 郭述良 刘平 罗永艾
(1.成都市第三人民医院呼吸内科,四川 成都 610031;2.重庆医科大学附属第一医院呼吸与危重症医学科,重庆 400016;3.成都市天府新区人民医院内二科,四川 成都 610213;4.重庆市长寿区人民医院呼吸内科,重庆401220)
作为全球结核高负担国家之一,我国结核疫情依然严峻。近年来分枝杆菌噬菌体在结核诊断及治疗研究中取得巨大突破[1-3],为结核病的防治带来曙光。但是有研究[4]发现,分枝杆菌噬菌体基因组中包含一些外来基因。噬菌体将一个细菌的基因导入到另一个细菌的现象为细菌转导。噬菌体通过细菌转导将分枝杆菌基因组中的某些与疾病相关的外来基因注入宿主菌基因组中,可能与人类疾病相关。而溶原性噬菌体是此过程最重要的媒介。因此,测序分枝杆菌噬菌体33D全基因组,并对其进行生物信息学分析,全面认识33D基因遗传背景,排除溶原性噬菌体和含有致病基因的噬菌体,为分枝杆菌噬菌体鸡尾酒疗法治疗结核分枝杆菌感染提供理论依据。
1 材料与方法
1.1 材料
1.1.1 宿主菌及噬菌体 耻垢分枝杆菌 mc2155由王国治教授(中国食品药品检定研究院)赠送;分枝杆菌噬菌体33D由Félix d’Hérelle噬菌体中心(加拿大拉瓦尔大学)惠赠。
1.1.2 主要试剂 OADC增菌液(美国sigma公司),罗氏培养基(中国珠海贝索公司),7H9/7H10培养基(美国BD公司),λ噬菌体基因组提取试剂盒(中国北京艾比根生物技术有限公司)。
1.2 方法
1.2.1 噬菌体扩增 7H9/7H10琼脂培养法培养48 h,在平皿中加5ml缓冲液,孵育1~2 h,回收全部缓冲液,0.2μm无菌过滤器过滤液体除菌。
1.2.2 噬菌体DNA提取 使用λ噬菌体基因组提取试剂盒提取噬菌体33D DNA,具体操作参照说明书进行。检测DNA含量及纯度,核酸蛋白测定仪检测OD260/OD280 比值,达1.7~1.9符合酶切和测序要求。
1.2.3 噬菌体33D基因组DNA限制性酶切及凝胶电泳 酶切:取合格的33D噬菌体DNA样本,做单酶切。琼脂糖凝胶电泳:参照文献[5],制备琼脂糖凝胶电泳。以Marker和未酶切的33D DNA作为对照。
1.2.4 鸟枪法测序 北京六合华大基因科技股份有限公司采用鸟枪法完成测序反应和序列拼接。测序得到的DNA序列采用Phred/PhraD/Consed软件包组装,PCR扩增连接重叠群(contig)间的缺口。
1.2.5 噬菌体33D基因组序列信息 用DNAStar软件包分析33D 的全基因组长度、基因平均长度和密度、GC含量、编码氨基酸平均长度和密度。
1.2.6 噬菌体33D基因预测 使用Glimmer3.0软件预测33D基因
1.2.7 基因功能注释 通过蛋白序列比对进行基因注释。使用BLAST(blastall 2.2.21)将基因的序列与各数据库swissport(版本号:Release 56.1),nr(版本号:2010016),kegg(版本号:Release 54),cog(版本号:20090331)进行同源比对,得到对应的功能注释信息。
2 结果
2.1 噬菌体33D基因组酶切图谱 用BamHI、EcoRI、HindIII对33D的基因组进行单酶切,酶切产物经琼脂糖凝胶电泳结果,见图1。BamHI能切开33D DNA,表明33D基因组为双链DNA。
2.2 噬菌体33D基因组DNA的制备 经核酸蛋白测定仪检测噬菌体33D的DNA OD260/OD280为1.80~1.90,浓度大于200 ng/μl,满足测序要求。33D DNA脉冲场电泳见图2。
2.3 噬菌体33D基因文库的构建 文库送检结果见表1。
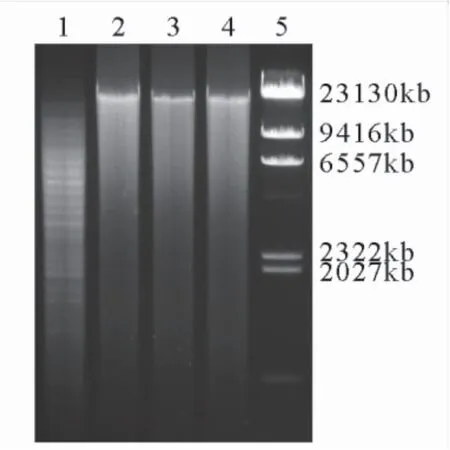
图1 噬菌体33D DNA酶切电泳图
Figure1Electrophoresisof33DDNAdigestedwithBamHI,HindIIIandEcoRI
注:1.噬菌体33D DNA被BamHI酶切条带(5μL); 2.噬菌体33D DNA; 3.噬菌体33D DNA被HindIII酶切条带(5μL); 4.噬菌体33D DNA被EcoRI酶切条带(5μL); 5. λDNA/HindIII对照

图2 噬菌体33D DNA脉冲场电泳Figure 2 Pulsed field gel electrophoresis of Phage 33D DNA注:1.噬菌体33D 基因组; 2.噬菌体Legendre基因组;3.对照
2.4 菌噬菌体33D基因组序列特性 噬菌体33D全基因组全长50036 bp,为线性dsDNA,平均GC含量67.91%。采用Glimmer3.0基因预测软件预测噬菌体33D共有84个假定基因,基因总长度为45735 bp,平均基因密度为0.91,平均基因DNA长度为544.46 bp。这些推定基因共编码15161个氨基酸,每个氨基酸平均长度180.49个氨基酸。

表1 噬菌体33D文库质检Table 1 Quality of Phage 33D Genomic Library
2.5 噬菌体基因预测及注释 Glimmer3.0软件分析预测了33D有84个假定基因。基因定位、氨基酸大小等信息见表2。通过BLAST同源检索对比分析,发现33D有72个基因编码序列与噬菌体TM4的基因编码序列高度匹配,可归为TM4噬菌体一簇。通过比对发现17个基因功能的明确。与噬菌体DNA复制相关基因:Gene 6、7、8、9和gene 14;与调节相关基因:gene 28;gene47 和gene 48编码裂解酶;噬菌体的结构基因:gene57、 59、60、61、64、70、74、75和gene 76。确定噬菌体33D为烈性噬菌体,未发现存在致病基因。噬菌体33D的motif-3基序的氨基酸序列与TM4 标尺蛋白中motif-3模块完全一致,见图3。噬菌体33D基因分布和功能见表2和图4。
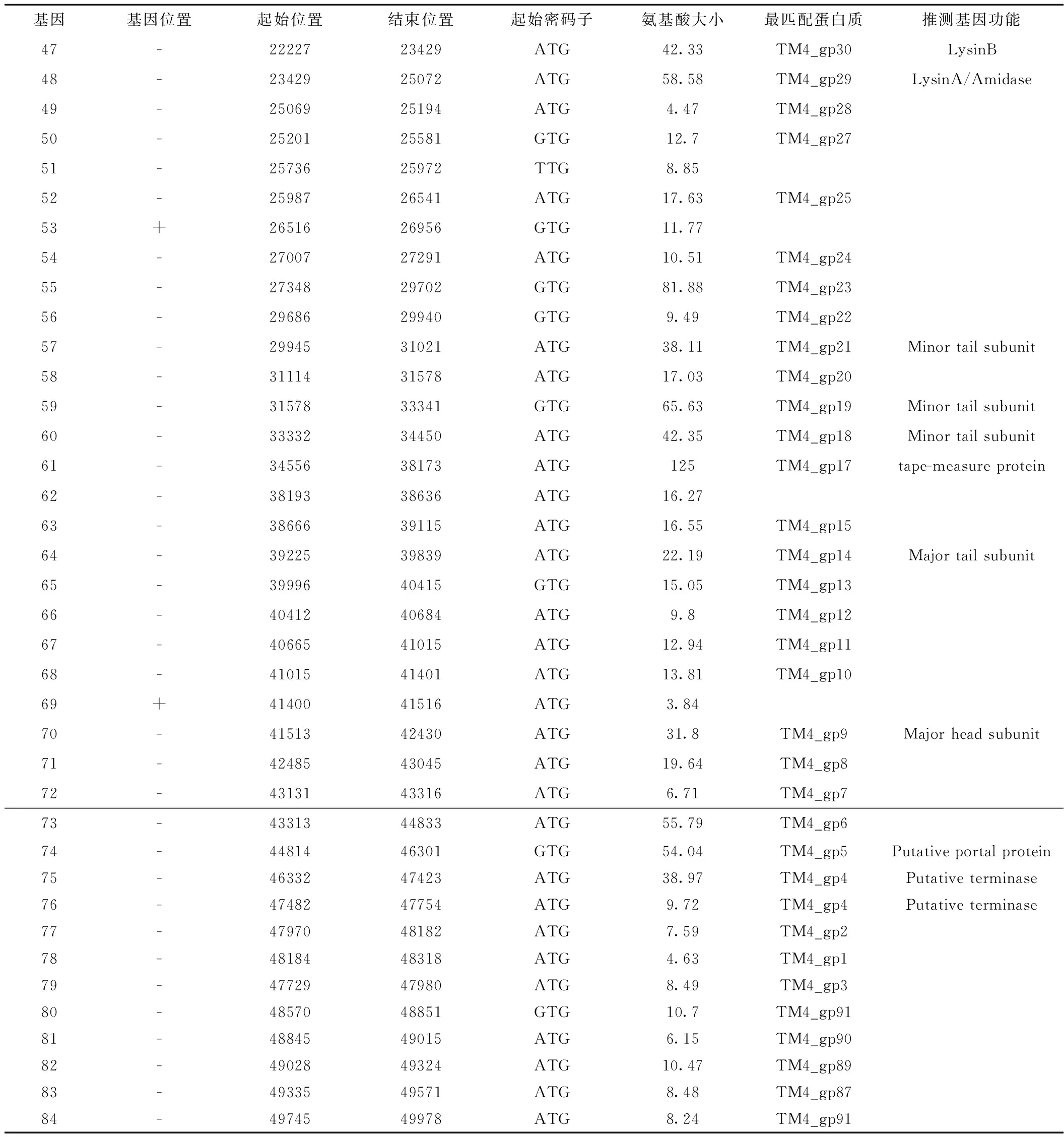
基因基因位置起始位置结束位置起始密码子氨基酸大小最匹配蛋白质推测基因功能47-2222723429ATG42.33TM4_gp30LysinB48-2342925072ATG58.58TM4_gp29LysinA/Amidase49-2506925194ATG4.47TM4_gp2850-2520125581GTG12.7TM4_gp2751-2573625972TTG8.8552-2598726541ATG17.63TM4_gp2553+2651626956GTG11.7754-2700727291ATG10.51TM4_gp2455-2734829702GTG81.88TM4_gp2356-2968629940GTG9.49TM4_gp2257-2994531021ATG38.11TM4_gp21Minor tail subunit 58-3111431578ATG17.03TM4_gp2059-3157833341GTG65.63TM4_gp19Minor tail subunit 60-3333234450ATG42.35TM4_gp18Minor tail subunit61-3455638173ATG125TM4_gp17 tape-measure protein62-3819338636ATG16.2763-3866639115ATG16.55TM4_gp1564-3922539839ATG22.19TM4_gp14Major tail subunit65-3999640415GTG15.05TM4_gp1366-4041240684ATG9.8TM4_gp1267-4066541015ATG12.94TM4_gp1168-4101541401ATG13.81TM4_gp1069+4140041516ATG3.8470-4151342430ATG31.8TM4_gp9Major head subunit71-4248543045ATG19.64TM4_gp872-4313143316ATG6.71TM4_gp773-4331344833ATG55.79TM4_gp674-4481446301GTG54.04TM4_gp5Putative portal protein75-4633247423ATG38.97TM4_gp4Putative terminase 76-4748247754ATG9.72TM4_gp4Putative terminase77-4797048182ATG7.59TM4_gp278-4818448318ATG4.63TM4_gp179-4772947980ATG8.49TM4_gp380-4857048851GTG10.7TM4_gp9181-4884549015ATG6.15TM4_gp9082-4902849324ATG10.47TM4_gp8983-4933549571ATG8.48TM4_gp8784-4974549978ATG8.24TM4_gp91

图3 噬菌体TM4、Halo和33D标尺蛋白motif-3模体的氨基酸序列比对图Figure 3 Sequence alignments of motif-3 in phage tape-measure proteins注:a.噬菌体TM4; b.噬菌体33D; c.噬菌体 Halo.
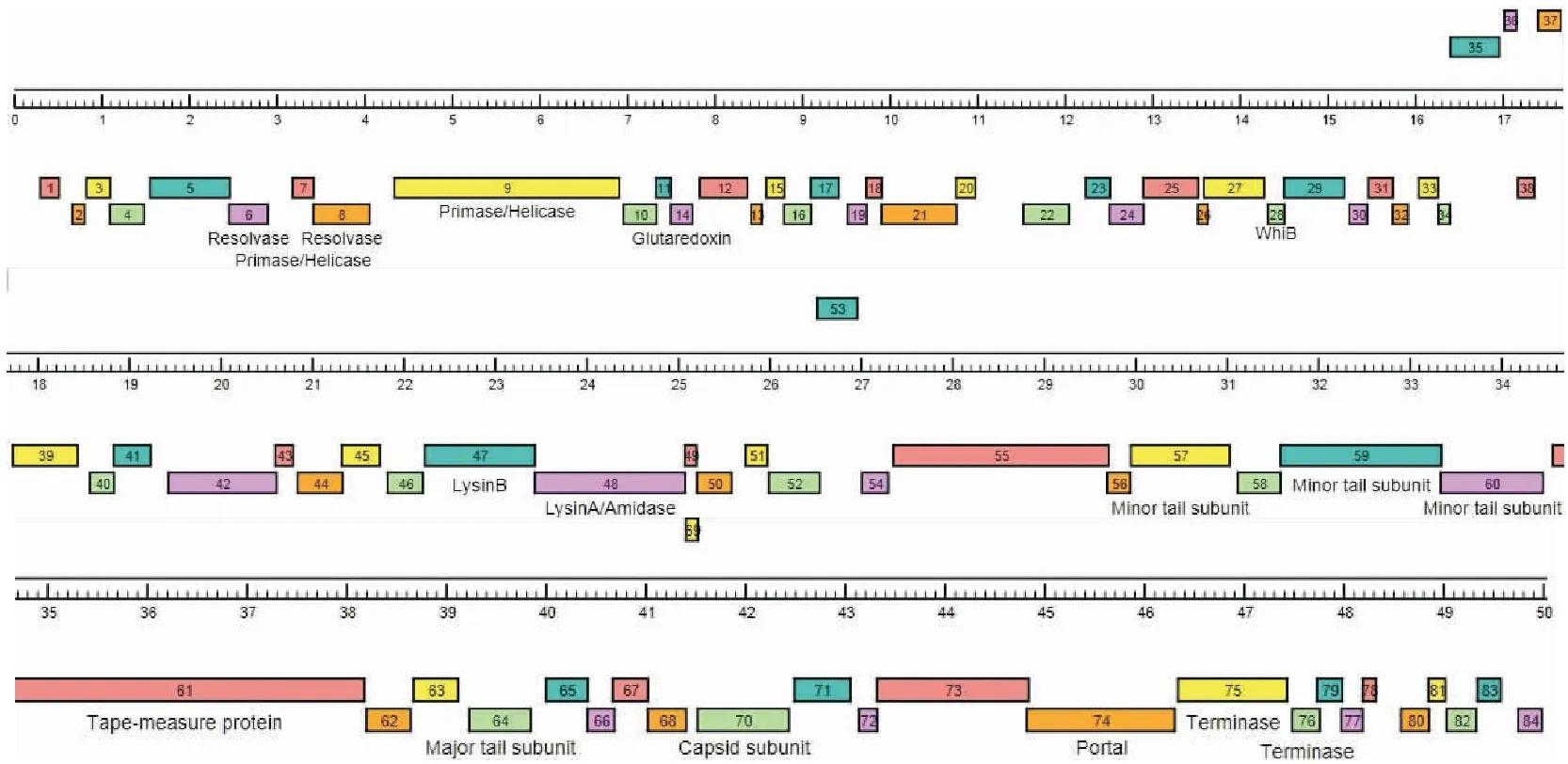
图4 分枝杆菌噬菌体33D基因组注释图Figure 4 Genome map of mycobacteriophage 33D注:彩色方块标示预测基因;彩色方块下方注释基因功能;彩色方块上注释基因号
3 讨论
本研究对噬菌体33D进行全基因组的测序和生物信息学分析,明确该株噬菌体的遗传信息,排除溶源性噬菌体和含有致病基因的噬菌体,为分枝杆菌噬菌体鸡尾酒疗法抗结核分枝杆菌感染的进一步开发利用提供理论依据。
噬菌体33D的基因密度均大于90%,全基因组大小50036bp,符合原核生物基因密度高,基因组小的特点。与之前报道的和我们测序的其他分枝杆菌噬菌体基因组大小41901~164602bp一致[6-10]。测序结果显示33D为线性双链DNA,与限制性酶切实验结果一致。
33D 84个推定基因中有72个与分枝杆菌噬菌体TM4的基因高度匹配,可以归为TM4一簇[7]。33D有17个基因的编码产物与已知功能的蛋白质同源。末端酶与双链病毒病毒包装和基因剪切相关,许多双链噬菌体均有此酶[11-13]。噬菌体33D编码末端酶的是gene 75和gene 76。噬菌体感染宿主菌,利用末端酶的大、小亚基将单个基因组插入衣壳蛋白中[14]。噬菌体33D编码尾部蛋白的基因有gene 57、59、60、61和gene64。对比噬菌体Halo的gene 16和TM4的gene 17编码的标尺蛋白,发现33D的gene 61编码的尾部标尺蛋白含有Motif 3基序。Motif 3[4,15-16]与Rpf相似是一种肽聚糖水解酶基序。Rpf能促进结核休眠菌复苏通过水解结核菌细胞壁肽聚糖[17-21]。休眠菌是结核病复发和恶化的重要原因[22]。Pedulla等[4]和我们的前期实验[16]发现具有Motif 3基序的噬菌体TM4能促进结核休眠菌复苏,并最终将其杀灭。我们推测同噬菌体TM4一样33D具有杀灭结核休眠菌的潜力。此外,噬菌体的尾丝蛋白还与噬菌体对宿主菌受体选择性结合相关[23]。
同D29、TM4的裂解模块相同,33D的裂解模块也包括Lysin A和Lysin B。33D的gene48编码溶菌酶Lysin A。gene 47编码溶菌酶Lysin B。溶菌酶是双链DNA噬菌体生物合成末期产生的一类蛋白,可通过溶解肽聚糖[24]和甘露糖[25],破坏分枝杆菌细胞壁,裂解细菌。溶原性噬菌体在感染细菌后通过自身整合酶将基因组插入宿主基因组中,并表达阻遏蛋白,使噬菌体保持溶原状态[26],通常不能裂解宿主。除此之外,溶原性噬菌体存在安全性隐患,其整合酶可将外源基因整合到真核细胞中。烈性噬菌体是天然的杀菌物质,从杀菌效果及安全性双重考虑噬菌体鸡尾酒疗法的候选噬菌体只能是烈性噬菌体。本研究确定33D噬菌体同TM4一致为烈性噬菌体,未发现阻遏蛋白样基因,亦未发现明显的致病基因。
通过测序及生物信息学分析,我们发现分支杆菌噬菌体33D的基因组与TM4高度匹配,为TM4簇。我们前期研究[10]33D生物学特性发现,无论是在噬菌体的制备还是在裂解能力及对耐药MTB的宽噬率等诸多方面,噬菌体33D都要优于TM4。因此,我们有理由相信噬菌体33D具备良好的抗结核潜力。
4 结论
噬菌体33D为裂解性噬菌体,33D噬菌体基因组无致病基因,具有抗结核潜力,可作为“鸡尾酒疗法”的候选噬菌体。
