长链非编码RNA DRAIC调控miR-223对胃癌细胞迁移和侵袭的影响
2019-01-03邓清张铁泉乐问津黄强李宓
邓清 张铁泉 乐问津 黄强 李宓
(荆州市第一人民医院肝胆外科,湖北 荆州 434000)
胃癌是全世界范围内消化系统最常见的恶性肿瘤之一,其肿瘤类型主要为腺癌[1]。据世界卫生组织统计,中国男性胃癌发病率占所有恶性肿瘤的第七位,死亡率约占所有恶性肿瘤的10%[2-3]。随着临床研究不断进展,胃癌的临床诊断率不断提升,但是关于晚期胃癌的治疗和预后检测仍进展不大。因此,探讨胃癌发病进展的准确分子机制是目前研究的热点。
长链非编码RNA(LncRNA)是一类具有超过200个核苷酸序列的非编码RNA,参与不同种类恶性肿瘤的进展过程[4]。对于胃癌,LncRNAH19及lncRNAMEG3已被明确为胃癌的活性致癌基因,对胃癌细胞的生物学行为有直接的影响[5]。 据报道,目前已有多种LncRNA与肿瘤进展途径相关,包括PCGEM1[6]、SOCS2-AS1[7]、PlncRNA-1[8]和DRAIC[9],都有可能成为有效的肿瘤标志物。有学者证明lncRNA H19通过阻断AR和E3泛素连接酶MDM2之间的相互作用来阻止AR泛素化和降解,达到抑制胃癌细胞的生长[10]。
最近的研究表明,miR-223可能在各种恶性肿瘤中起关键调控作用。据以前的研究,在前列腺癌中miR-223下游的两个转录物可以直接促进前列腺癌细胞凋亡[11]。在最新的研究中指出,miR-223可以通过靶向AKT/mTOR信号通路来阻碍肝细胞癌的发展[12]。然而目前仍然缺乏关于miR-223功能的确切机制。为了探索长链非编码DRAIC和miR-223在胃癌中的功能及其相关影响,本文分析两者在胃癌中的表达情况及生物学行为的检测(包括细胞迁移和侵袭实验),旨在为胃癌患者提供一个潜在的新的治疗和预后靶标。
1 材料与方法
1.1 细胞株及实验材料 人胃癌细胞株BGC-823、AGS、HCG-27及SGC-7901细胞购买于复旦大学细胞所,在含有10%胎牛血清和1%青霉素-链霉素的DMEM培养基中培养。DRAIC-siRNA和阴性对照(NC)购自中国上海GenePharma生物有限公司;脂质体Lipofectamine 2000模拟物购自上海吉凯基因公司;TRIrizol购自美国Ambion公司;逆反转录试剂盒(FSQ-101)购自日本TOYOBO公司;PCR试剂盒购自美国Kapa公司。选择2016年1月~2016年12月 在本院接受胃癌切除术的患者得到新鲜的胃癌和相邻正常组织,手术切除后立即将组织放置液氮冷冻,储存于-80℃冰箱保存备用。来自病理科的胃癌组织均获得了医院保护人类受试者委员会的批准,并获得了所有患者的知情同意书。
1.2 定量实时PCR(qPCR)分析 将SGC-7901细胞接种在12孔板中,生长至50%融合以进行siRNA转染,90%用于质粒转染。根据制造商的方案,使用Lipofectamine 2000转染质粒和siRNA。在转染后第3d,收获细胞,并使用TRIZOL试剂提取总RNA。使用ImProm-II TM逆转录系统对总RNA水平进行qPCR分析。所有反应用Step-One Plus实时PCR系统进行,使用2-△△Ct计算法分析qPCR的实验数据。实验重复3次。DRAIC-siRNA的siRNA序列:F:(正向)5’-AATGAGGCGAGGGCTGGGGAACCTA-3’,R:和(反向)5’-TTGAGGGCGGAGGGTCGGAaatGGC-3’。miR-204,F:的前引物(正向)5’-AATGAGGGTGGGGGCGAGCGAAGGT-3’,R:和(反向)5’-AATGCGGATGCGGGAGGGGCGGGAGC-3’。
1.3 荧光素酶报告基因测定 验证DRAIC和miR-223的相关关系使用双荧光素酶测定,将24孔板中的DRAIC和NC细胞与0.4mg萤火虫荧光素酶报告载体和0.08mg含有海肾萤光素酶(Promega)的pRL-TK对照载体共转染,使用 siPORTneoFX(Ambion,Austin,TX),根据使用方法操作,在转染后48h制备裂解物。 使用双光发光报告基因测定(Applied Biosystems)测量荧光素酶活性。将萤火虫荧光素酶活性标准化后测定海肾萤光素酶活性。实验重复3次。
1.4 蛋白质印迹测定 使用RIPA缓冲液提取总细胞裂解物,通过配置12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白质,并转移到PVDF膜,用5%脱脂奶粉封闭,并在4℃下与一抗(浓度1:1000)一起孵育过夜。 随后将膜与二抗孵育,最后用ECL底物试剂盒检测,实验重复3次。
1.5 划痕愈合实验 将胃癌细胞接种于6孔板,待细胞融合度生长在90%时,用200μl消毒枪头垂直划线,并在显微镜下测量划痕的初始距离(0 h),在恒温孵箱中孵育72h后,测量划痕的距离,并计算细胞的迁移率。细胞迁移率的计算公式=[迁移距离D(0h)-迁移距离D(72h)]/ 迁移距离D(0h)。实验重复3次。
1.6 Transwell侵袭实验 将Transwell小室置于24孔板内,将Transwell小室内膜均匀涂抹Matrigel胶100μl,37℃孵育20min,逐步消化、离心、计数细胞后,按照2.5×104/ ml用无血清培养基将胃癌细胞稀释,制成细胞悬液;按照每孔200μl的细胞悬液加入Transwell上室;孵育24h后使用甲醛固定细胞,结晶紫染色15min,使用棉签去除小室内膜上的细胞,然后于显微镜下计数,观察4个高倍视野(×40)下穿过滤膜的细胞数。实验重复3次。
1.7 流式细胞仪分析 流式细胞术检测SGC-7901胃癌细胞凋亡情况。将SGC-7901细胞以2×105/孔的浓度接种在6孔板中,分别用NC和DRAIC-siRNA转染,转染72h后,通过FITC标记的AnnexinV/碘化丙啶细胞凋亡检测试剂盒检测凋亡细胞情况。实验重复3次。

2 结果
2.1 DRAIC在胃癌组织、癌旁正常组织和胃癌细胞株中的表达情况 qPCR检测结果表明,与癌旁正常组织相比,胃癌组织中DRAIC表达水平明显较高[(2.12±0.28) vs (0.59±0.15)],差异均有统计学意义(P<0.05),见图1A;DRAIC在SGC-7901细胞株中表达水平比其他细胞株明显增高[(1.91±0.17) vs (1.21±0.15)vs(0.77±0.13) vs (0.82±0.18)],差异均有统计学意义 (P<0.05),见图1B。综合上述试验结果,我们推测DRAIC在胃癌中可能扮演一定的促癌作用,并挑选SGC-7901为进一步生物学功能实验的细胞株。
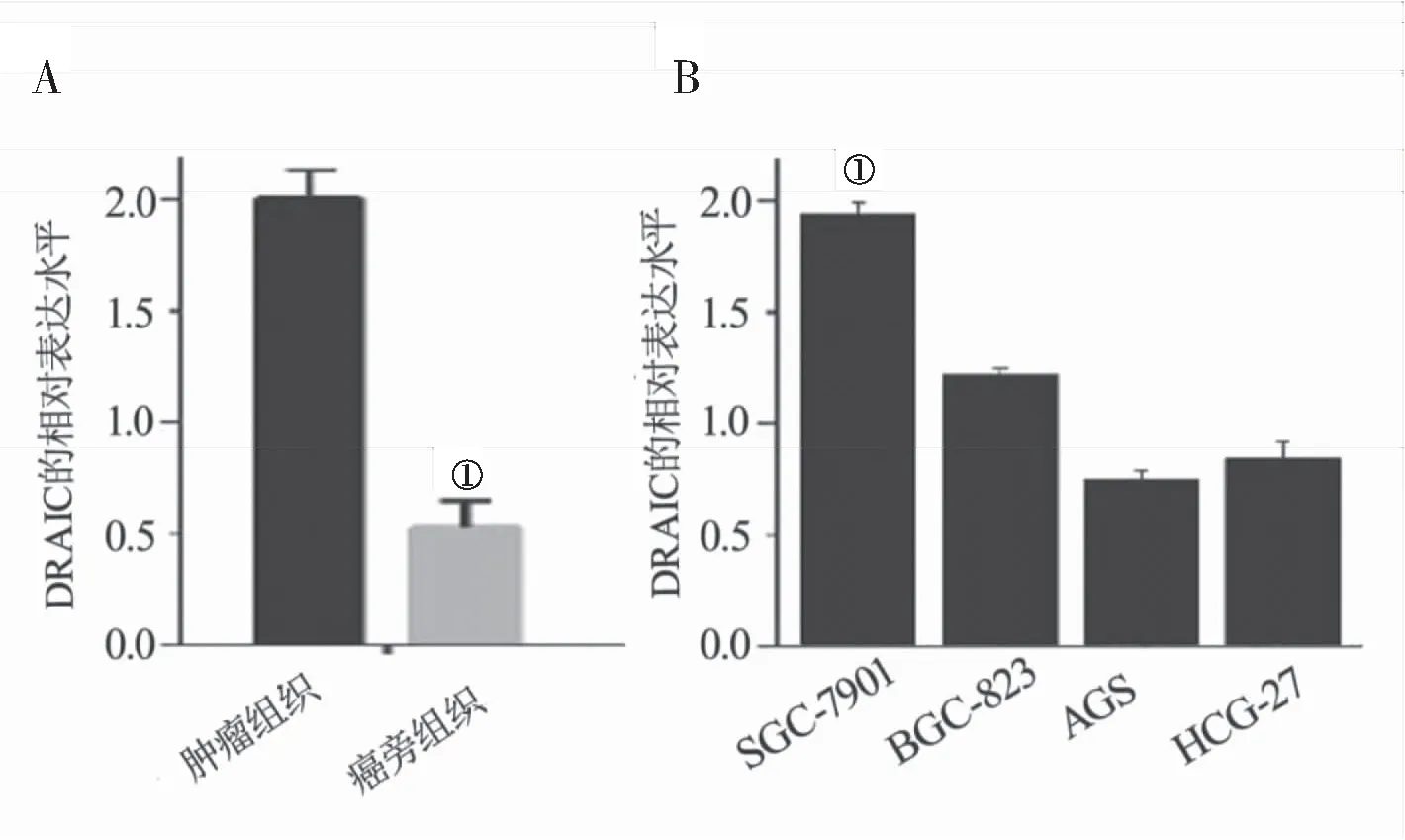
图1 DRAIC在胃癌组织和细胞株中的表达情况Figure 1 DRAIC expression in gastric cancer tissues and cell lines注:A. DRAIC在胃癌组织和正常组织中的表达情况;B. DRAIC在不同胃癌细胞株中的表达情况,①P<0.05
2.2 DRAIC和miR-223之间的调控关系 通过生物信息学预测网站筛选与DRAIC有直接作用的miRNA分子,miR-223的3’UTR与DRAIC具有相似的结合位点。进一步通过双荧光素酶验证DRAIC与miR-223的 3’UTR结合调控情况,将DRAIC与miR-223共转染到293T细胞中,双荧光素酶报告基因结果显示,DRAIC可以明显抑制野生型miR-223-3’UTR的荧光素酶活性,但不能调控突变型miR-223-3’UTR的活性,见图2,表明DRAIC能与miR-223的3’UTR特异性结合,且可调控miR-223的表达活性。
2.3 DRAIC调控胃癌细胞细胞周期和凋亡行为 细胞凋亡实验显示,DRAIC-siRNA实验组的细胞凋亡速率明显高于NC对照组的细胞凋亡比率[(16.33±2.16)% vs(10.05±1.98)%],差异有统计学意义(P<0.05),见图3A;抑制DRAIC的表达后阻滞于G1期细胞增多[(71.14±8.36)% vs(66.77±6.57)%],S分裂期细胞减少[(19.92±3.15)% vs(21.94±4.21)%],差异均有统计学意义(P<0.05),见图3B,表明抑制DRAIC的表达后,胃癌细胞的凋亡行为得到一定程度的促进。

图2双荧光素酶实验检测DRAIC和miR-223之间的相互关系
Figure2LuciferaseassaytodeterminethecorrelationbetweenDRAICandmiR-223
注:与突变型比较,①P<0.05
2.4 DRAIC调控胃癌细胞的迁移和侵袭行为 Transwell侵袭实验结果显示, 抑制DRAIC的表达后,DRAIC-siRNA组细胞的侵袭数目明显少于NC组[(128.6±18.2)vs(31.5±7.6)],差异有统计学意义(P<0.05),见图4A, 表明抑制DRAIC的表达在一定程度上可以抑制胃癌细胞的侵袭能力。划痕愈合实验结果显示, 抑制DRAIC的表达后,胃癌细胞的迁移能力受到一定的抑制;72h后,DRAIC组细胞的迁移比率明显低于NC组[(82.45±7.62)% vs(22.31±4.42)%],差异有统计学意义(P<0.05),见图4B,表明抑制DRAIC的表达在一定程度上可以抑制胃癌细胞的迁移能力。
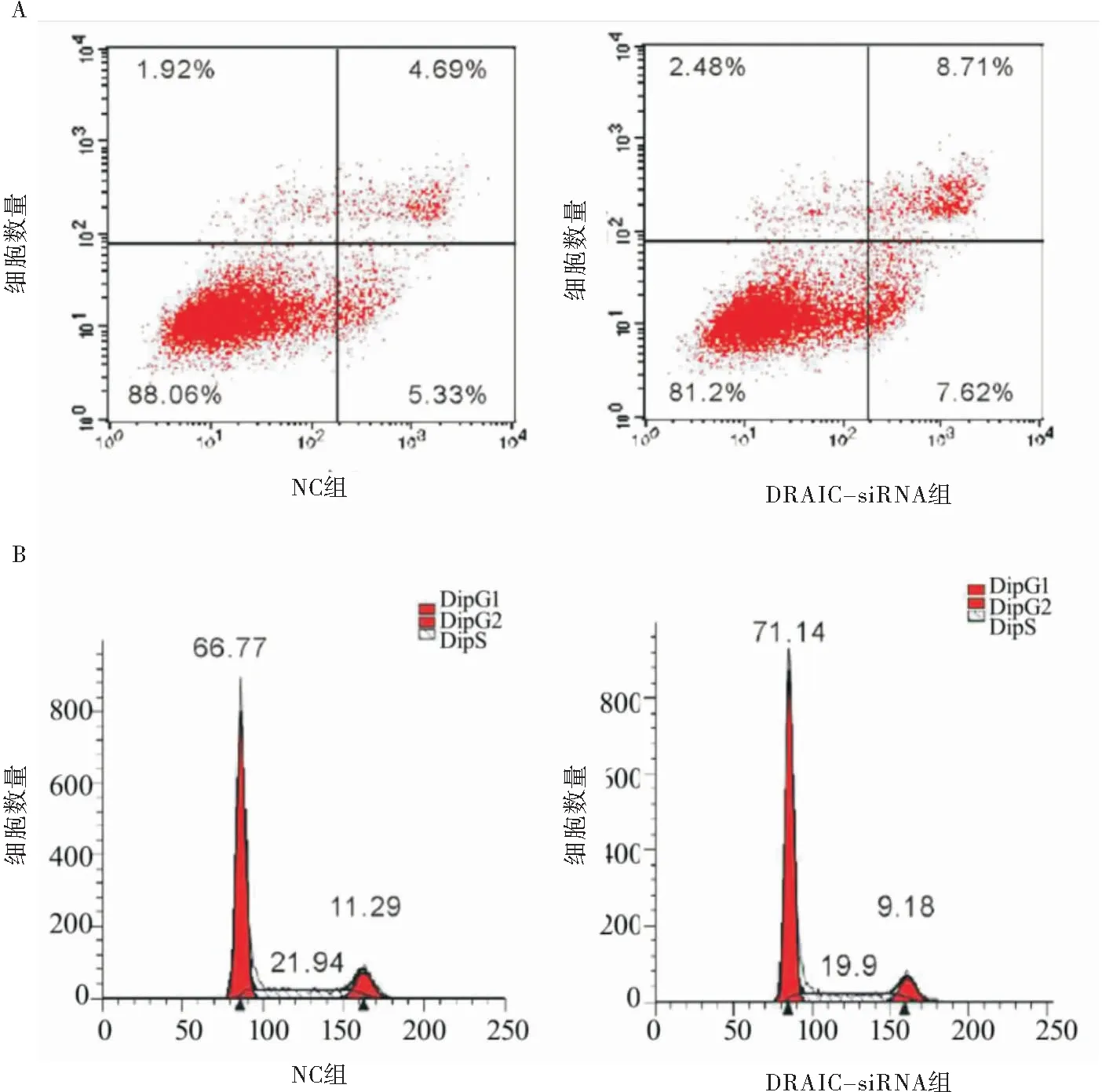
图3 DRAIC和miR-223之间的调控关系Figure 3 The regulatory relationship between DRAIC and miR-223注:A.流式细胞术检测DRAIC对胃癌细胞凋亡行为的影响;B.流式细胞术检测DRAIC对胃癌细胞细胞周期进程的影响
3 讨论
胃癌是全球消化系统死亡率第二高的恶性肿瘤,在亚洲每年大约有60%的患者被诊断为胃癌,其中中国的发病率约占全球胃癌患者总数的42%[14]。尽管目前胃癌的手术技术有所改善,且辅助治疗方式不断进步,但是胃癌的死亡率仍居高不下,这主要是因为早期胃癌诊断困难和晚期胃癌发生远处转移[15-16]。因此,需要提高对胃癌机制的认识和特异性生物分子标志物的识别,有助于胃癌的早期预测和临床疗效的改善。
据报道,LncRNA参与不同种类的恶性肿瘤的进展过程[17]。在胃癌中,众多的LncRNA与肿瘤转移信号通路途径相关,从而可以作为胃癌发生发展的检测因子。有学者发现,LncRNA中的LINC01138和SUZ12P1可以在一定程度上促进前列腺癌的增殖[18]。同时有研究指出,GAS5可以通过调节CCL1的表达参与膀胱移行细胞癌的侵袭行为[19]。Hotair通过结合YBX1负调节人神经胶质瘤细胞的存活和增殖能力[20]。在胃癌中关于肿瘤调控因子有众多的组织类型差异,通过使用公共数据库发现,胃癌组织样品中DRAIC的表达显著上调。
为了深入了解DRAIC在胃癌细胞中的更多潜在作用,本实验首先检测了DRAIC在胃癌组织和细胞株中的表达情况,然后检测DRAIC对胃癌细胞株迁移和侵袭行为的具体影响。之前相关研究指出,DRAIC相关基因与翻译延伸、蛋白质生物合成、RNA剪接、蛋白质结合与核糖体的结构成分相关,主要参与调节转录、信号转导、修饰依赖性蛋白质分解代谢、蛋白结合和锌离子结合等细胞因子行为,表明DRAIC在胃癌的发展过程中扮演核心的调控作用。
图4DRAIC调控胃癌细胞的迁移和侵袭行为
Figure4DRAICregulatesthemigrationandinvasionofgastriccancercells
注:A.Transwell侵袭实验检测DRAIC对胃癌细胞侵袭能力的影响; B.划痕愈合实验检测DRAIC对胃癌细胞迁移能力的影响
本实验证实了SGC-7901胃癌细胞的迁移和侵袭能力被DRAIC因子所调控,且和miR-223分子的表达相关。值得注意的是,miR-223已被报道是前列腺癌中的肿瘤调控因子,发挥一定的抑癌作用[21]。本研究中miR-223在胃癌中扮演的作用与之前前列腺癌中的报道不一致,推测可能miR-223具有一定的组织特异性,在不同类型的肿瘤组织中表达存在差异。
4 结论
本研究结果显示,DRAIC在胃癌中的高表达和miR-223共同调控胃癌的发生发展及迁移转移行为,这有可能成为预测胃癌进展、预后和监测治疗效果的分子标志物。
