调节性T细胞在结直肠癌患者手术及化疗前后外周血中的变化及意义
2019-01-03沈军权张汝一甄运寰
沈军权,张汝一,甄运寰,修 瑾
(1.余姚市人民医院,肛肠外科,浙江 余姚 315400;2.贵州医科大学附属医院 肛肠外科,贵州 贵阳 550004)
结直肠癌是现代社会最常见的消化道恶性肿瘤,其发病率在男性中排第3位,在女性中排第2位[1],俨然已成为了一个世界性的社会公共问题。在近一个世纪中,外科手术作为CRC主要治疗手段,其5年生存率长期徘徊在50%左右[2]。随着肿瘤免疫机制研究的深入,发现调节性T细胞与肿瘤的发生、发展密切相关[3-4],极大地丰富了人类对于肿瘤免疫逃逸机制的认识,为肿瘤生物治疗疗效不佳提出了新的解释,也为肿瘤的治疗提供了新的思路。近年来国内外的Treg研究主要集中在肿瘤组织及外周血中的表达,但对肿瘤患者——特别是CRC患者,手术及化疗后Treg的变化与肿瘤进展的相关性研究较少报道。本文从CRC入手,进一步研究手术及化疗后Treg的变化特点及临床意义。
1 资料和方法
1.1 病例选择 选取2015年5月—2016年1月在贵州医科大学附属医院就诊的CRC患者,均签署知情同意书。纳入标准:(1)术前有病理活检结果证实为CRC;(2)影像学排除远处转移;(3)入院前未进行过放化疗或生物治疗;(4)均拟行原发灶根治性切除术;排除标准:(1)近期有感染、疫苗接种病史;(2)乙肝、丙肝、梅毒、HIV阳性;(3)合并有结直肠腺瘤;(4)合并有血液系统疾病或其他部位肿瘤;(5)有自身免疫系统疾病或近期使用过免疫抑制剂;(6)有严重心、肝、肺、肾等重要脏器功能不全患者;(7)怀孕或哺乳期患者。剔除标准:(1)术后出现严重手术并发症;(2)术后化疗出现严重并发症,化疗不能持续者;(3)术后自行放弃化疗者及不按期参与化疗者。本研究获得贵州医科大学附属医院伦理委员会批准。
1.2 入组患者临床资料 入选经结肠镜及活检结果证实为CRC的初治患者15例为观察组,其中男9例,女6例;年龄37~70岁,平均56.13±8.98岁;肿瘤部位:直肠7例,结肠8例;癌细胞分级:低级别4例,高级别11例;侵润深度:T10例,T21例,T311例,T43例;淋巴结转移(N):N08例,N14例,N23例;远处转移(M):M(-)15例,M(+)0例;TNM分期:I期1例,II期7例,III期7例,V期0例。术后2周开始予以“5-Fu”为基础的三周方案进行化疗(癌细胞分级参照2010 版WHO结直肠癌组织学分级标准。TNM分期是参照2010年第七版AJCC癌症分期手册)。
1.3 对照组选择 选取14例同期在贵州医科大学附属医院健康中心参加体检的健康者作为对照组,其中男6名,女8名,年龄41~68岁,平均51.71±9.17岁。其中外周血中免疫及生化指标未见异常,既往无肿瘤手术史、息肉切除史、传染病史及自身免疫系统疾病史。
1.4 检测
1.4.1 主要实验试剂及实验器材 CD4-FITC 、CD25-ECD 、鞘液来自美国贝克曼库尔特公司。FoxP3-PC7来自美国eBioscience公司。溶血剂来自美国BD公司。PBS(磷酸盐缓冲液)自制。流式细胞仪(型号:FC500)来自美国贝克曼库尔特公司。
1.4.2 标本采集及检测 采集健康者体检当天的清晨空腹静脉血2 mL,分成两管,用EDTA-K2抗凝管收集,当天送检;同法采集CRC患者术前1天、术后2周、术后10周(第2次化疗后2周)的外周血液样本。用流式细胞术检测外周血中CD4+CD25+Foxp3+Treg在CD4+T淋巴细胞中的构成比,严格按照说明书操作。
1.5 观察指标 观察患者与健康者外周血中CD4+CD25+Foxp3+Treg在CD4+T淋巴细胞中的构成比,对比患者手术前后相关炎症指标(IL-6、CRP、WBC)变化。
1.6 统计学分析 所得实验数据采用SPSS17.0软件进行处理,应用GraphPad Prism5.1软件进行作图,计量资料数据均采用Mean±SD表示;两组间比较用t检验,三组及以上比较用ANOVA分析,相关性用Pearson检验;P<0.05被认为有统计学意义。
2 结果
2.1 外周血中Treg表达情况 在CRC患者外周血中,CD4+CD25+Foxp3+Treg占CD4+T细胞的比例为(6.92±2.12)%,健康者为(4.66±0.92)%,两者差异有统计学意义(P<0.05);见图1。不同年龄、性别、肿瘤部位、癌细胞分级、淋巴转移、肿瘤分期的CRC患者间,其外周血中CD4+CD25+Foxp3+Treg表达水平差异无统计学意义(P>0.05),见表1。
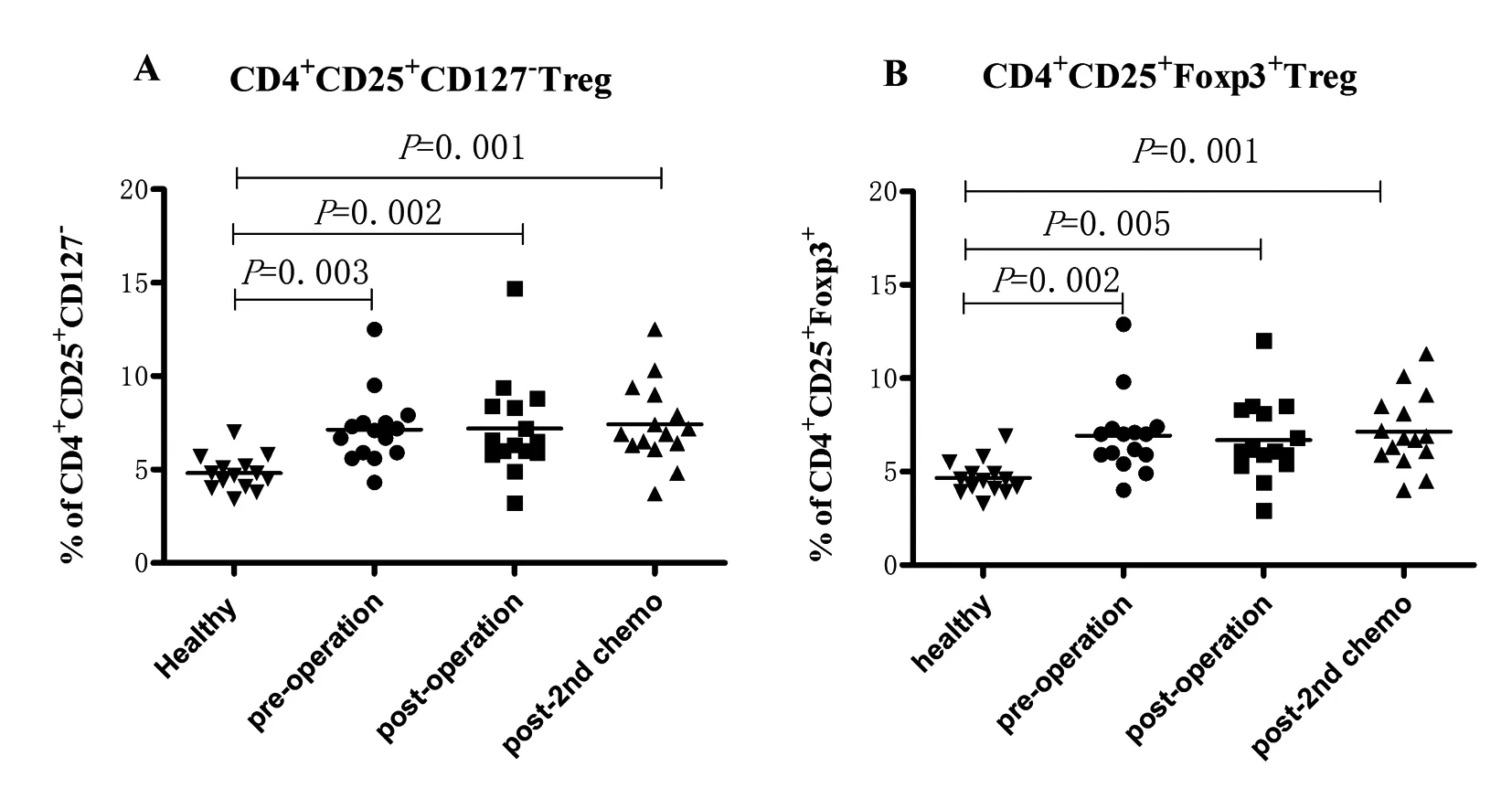
Healthy为健康对照组,pre-operation为肿瘤组术前,post-operatioan为肿瘤组术后,post-2nd- chemo为肿瘤组术后行2周期化疗后图1 CRC患者和健康者外周血中Treg的表达水平

临床病理特征例数CD4+CD25+Foxp3+TregP年龄(岁)≤5677.97±2.56>5686.00±1.130.07性别男97.02±1.17女66.77±3.210.86肿瘤部位直肠77.31±2.55结肠86.56±1.760.52癌细胞分级低级别117.10±2.09高级别46.43±2.430.68淋巴结转移N=087.05±2.94N=146.58±0.74N=237.03±0.580.94TNM分期Ⅰ-Ⅱ87.05±2.94Ⅲ-Ⅳ76.77±0.580.80
2.2 手术及化疗对Treg的影响 术前,CRC患者外周血CD4+CD25+Foxp3+Treg占CD4+T细胞的比例为(6.92±2.12)%,手术后为(6.69±2.15)%,经“5-Fu”为基础的三周方案进行2周期化疗后为(7.14±1.99)%,手术前后及化疗前后均无显著变化(P>0.05),见图1。
2.3 手术前后相关炎症指标变化结果 术前IL-6(4.81±5.46 pg/L)、CRP(5.82±11.40 mg/L)、WBC(6.20±1.80 G/L)与术后第1天(76.42±75.46 pg/L、71.68±35.77 mg/L、14.58±4.54 G/L比较,差异均有统计学意义(P<0.05);术后2周均降至术前水平。
3 讨论
Treg是一群具有独特免疫调节功能的T细胞亚群,目前已经确定CD4+CD25+为其主要表型,且只有具备Foxp3表达的细胞才是Treg[5]。Treg是具有免疫调节功能的细胞,有免疫抑制性及免疫无能性[6-7]。这些作用对于其维持机体免疫耐受和免疫应答稳态等方面发挥着重要作用。
近年研究发现[8-9],在肺癌、卵巢癌等肿瘤患者的外周血Treg显著高于健康者,肿瘤局部Treg数量较周围正常组织亦明显增加,且肿瘤切除后Treg恢复到正常水平,肿瘤复发时Treg也同样增多;提示Treg参与了肿瘤的发生、发展,且数量与肿瘤进展呈正相关,与预后呈负相关。在结直肠癌方面,Ling等[10]研究发现Treg在CRC患者外周血比例显著高于健康者,同时在自体的肿瘤组织中Treg数量较非恶性大肠组织明显增高,亦证明Treg参与了CRC的发生、发展。但国内外对CRC患者经手术及化疗后,随着肿瘤负荷的减轻,外周血中Treg会发生怎样变化,是否与预后呈正相关,却鲜有报道;且以往由于对Treg定义不明确,大多研究主要集中于CD4+CD25+Treg的研究。本实验我们从Treg的特异转录因子Foxp3入手,分析Treg在肿瘤患者手术及化疗前后外周血中的变化及意义。
Treg在正常人体的外周血中以一定的比例存在,以维持机体的免疫平衡,但到目前为止,仍未进行大规模普查,尚未有统一的参照标准。本实验采集14位健康体检者的外周血,测得CD4+CD25+Foxp3+Treg占CD4+T细胞的比例(4.66±0.92)%,与其他文献报道相符[11],可以作为对照基础进行下一步研究。在研究中我们发现CD4+CD25+Foxp3+Treg占CD4+T细胞的比例较健康对照组是显著升高的,与国外研究相符[12-13],说明CRC跟其他肿瘤一样,确实存在Treg产生的免疫抑制效应,使机体产生免疫耐受,最终导致肿瘤的发生。同时分析发现CD4+CD25+Foxp3+Treg在外周血中的表达水平与患者的年龄、原发肿瘤部位、癌细胞分级、淋巴转移及TNM分期无关(见表1),与Shen等[14]报道一致,说明该研究尚不能肯定外周血Treg对预后的直接意义。
进一步对CRC患者手术后2周、10周(术后第2次化疗结束后2周)的外周血中CD4+CD25+Foxp3+Treg进行纵向分析,发现Treg并没有随着肿瘤负荷的减少而明显下降(见图1)。对比其他肿瘤,如乳腺癌、肺癌等,国内外研究报道术后2周,外周血中Treg出现明显下降。考虑可能肿瘤部位不同、手术创伤不同、引起全身炎症反应及抗炎反应不同。Treg在炎症反应中,被诱导增值,通过产生调节性细胞因子、接触抑制剂竞争细胞因子等产生抑制炎症作用[15],从而保护人体避免遭受过度炎症因子的损害。本实验对CRC患者手术前后外周血中炎症指标IL-6、CRP、WBC检测发现,虽术后2周炎症因子基本恢复至术前水平,但机体免疫功能可能仍处于不稳定或失衡状态,故CD4+CD25+Foxp3+Treg没有随着肿瘤负荷的减低而下降。术后10周,外周血Treg仍未明显下降;而Gareth Betts等[13]对58例CRC患者术后3个月、6个月、12个月进行跟踪随访,发现外周血中Treg术后3个月明显下降,12个月下降至正常水平;但这58例CRC患者均未参加术后化疗,从中提示化疗具有一定免疫调节功能,抑制了机体的免疫功能。化疗是一种全身性治疗手段,对肿瘤细胞具有强大杀伤力,对原发、残留、扩散及转移的细胞均有杀伤作用,但同时其也有药物选择性不强的缺点,对全身其他细胞也可造成不同程度的损害。因本实验未对CD4+T细胞及Treg的绝对数量进行检测,故无法证明化疗是否导致Treg绝对数量的下降,但Treg在外周血中比例较术前无明显变化,提示其免疫功能仍受抑制。
从本实验中我们大胆推测,术后早期可能是生物免疫治疗的最佳时间;过去我们的生物免疫治疗效果不佳,是因为患者大多已属肿瘤晚期,往往是其他治疗如手术、化疗无法取得效果的状态下,继而求助于生物治疗,但遗憾的是目前尚未见此方面的大量文献报道。我们下一步将对联合检查多种免疫活性细胞,包括NK细胞、NKT细胞、树突状细胞、CD8+CD28+/CD28-细胞、Treg以及一系列正负血清细胞因子(IL-10、TGF-β、IL-12、IFN-γ),更深入研究结直肠癌患者的手术前后免疫功能变化,从而探讨术后生物治疗的最佳时间,为建立新的免疫功能综合疗效评价奠定基础。
