alpha-1抗胰蛋白酶在 Stanford A 型主动脉夹层血管重构中的作用及分子机制的研究①
2019-01-03李继军夏利民田爱丽陆树洋亚尔麦麦提穆萨阿迪力江居麦
李继军 夏利民 宋 凯 田爱丽 陆树洋 亚尔麦麦提·穆萨 阿迪力江·居麦
(喀什地区第二人民医院心胸外科,喀什 844000)
主动脉夹层是心血管外科最为凶险的疾病,死亡率非常高,发病后病情进展迅速,超过 20%的患者在入院接受治疗之前即已发生主动脉夹层破裂死亡[1,2]。主动脉夹层的凶险程度远远高于脑梗、心梗和恶性肿瘤,已成为明显影响人们健康的重要医疗和社会问题[3]。主动脉夹层的发病机制目前尚不明确,现多认为主动脉夹层的发生是多种炎性细胞和炎性因子参与的以细胞外基质降解及血管重构为主要特征的病理过程,是遗传、环境、血流动力学和免疫等多种因素共同作用的结果[4,5]。蛋白水解酶与蛋白酶抑制剂的平衡在维持血管壁结构稳定,阻止血管壁结构重构方面发挥了不可忽视的作用[6]。α-1抗胰蛋白酶(α-1anti trypsin,α1AT或AAT)是具有蛋白酶抑制作用的一种急性时相反应蛋白,其主要功能是抑制多形核蛋白细胞释放的溶酶体蛋白水解酶[7]。已有文献报道,AAT缺乏与诸多肺部疾病密切相关[8,9],如廖玉婷等[10]研究认为,AAT主要通过抑制Caspase-3活性,可以有效保护肺内皮损伤。还有研究报道AAT缺乏与慢性肝炎、肝硬化的发生密切相关[11]。尚有文献提及,颅内夹层动脉瘤发生与α-1抗胰蛋白酶缺乏有密切关系[12]。关于AAT在 Stanford A型主动脉夹层中的作用及分子机制,尚未见国内外文献报道。
1 材料与方法
1.1研究对象 选取2012年4月~2016年4月在我院行手术治疗的 Stanford A 型主动脉夹层患者8例、平均年龄(56.5±7.2)岁。升主动脉瘤患者8例、平均年龄(57.1±6.8)岁。正常组8例、平均年龄(56.8±6.6)岁。三组患者在年龄、性别等方面无统计学差异。
纳入标准:收集所有在我院行手术治疗的 Stanford A 型主动脉夹层、升主动脉瘤患者的升主动脉血管组织标本,全血及血清标本;正常血管组织标本取自心脏移植患者供心修剪下来的升主动脉血管组织,血清标本取自健康志愿者。
排除标准:具有可以导致主动脉夹层明确病因机制的疾病,如马凡综合征、巨细胞动脉炎、大动脉炎、二叶式主动脉瓣畸形等,应排除。
1.2方法
1.2.1组织收集 术中切除的部分升主动脉血管组织,经生理盐水反复将血渍漂洗干净,采用锐利刀片沿血管的长径及横径分别留取1 cm×0.5 cm 两块组织,使用传统Trizol法提取血管组织总RNA,经逆转录后使用RT-qPCR法检测组织中AAT基因表达水平。使用RIPA提取血管组织全蛋白,在蛋白水平检测组织AAT水平。
1.2.2血清收集 用凝血管采集全血,采血后两小时内分离血清。使用AAT测定试剂盒检测所有组别血清中AAT含量。
1.2.3人血管内皮细胞的分离与培养 将手术中切下的带有内膜的升主动脉组织标本无菌条件下转移至超净台中,将其放至培养皿中,PBS 缓冲液反复清洗去除血渍。向培养皿中加入 0.25%的胰酶3~4 ml,将冲洗干净的血管组织标本内膜浸渍在胰酶中1~2 min,收集消化液,采用 20%DMEM 等量液体中和胰酶,采用滤网过滤取出组织块。收集到的内皮细胞采用 20% DMEM 培养,培养条件37℃5%CO2培养箱。
1.2.4实验分组 实验分为胰酶干预组、MMP-2/9干预组及空白对照组,细胞接受前述干预因素处理前,一组细胞采用 AAT 预处理 12 h,另外一组采用 PBS 预处理做对照。72 h后收集细胞提取蛋白,检测不同组别中凋亡相关蛋白Caspase-8、Caspase-3表达水平。
1.2.5Stanford A 型主动脉夹层动物模型的建立 采用比格犬作为实验模型,穿刺股动脉留置鞘管,隔日向血管腔内注射 0.125%胰蛋白酶200 μl/kg,同时使用微量缓释渗透泵皮下泵人 AngⅡ,较高剂量组1 000 ng/(kg·min),持续灌注14 d;对照组泵入生理盐水14 d。氯胺酮+地西泮(1∶1)麻醉比格犬后,暴露右侧颈部及与右侧腹股沟备皮、消毒,作长约2~3 cm切口,模型组背部皮下埋置AngⅡ缓释泵,对照组埋置 0.9%氯化钠缓释泵。上述模型建立成功后,将实验动物分为AAT干预组和生理盐水对照组。采用静脉注射人工合成AAT对实验动物进行干预,200 μl/kg隔日一次,持续14 d,对照组动物采用生理盐水注射。
1.2.6病理学检查 切取病变升主动脉血管组织,经4%甲醛固定后,行HE染色和VG染色,观察各组病变血管组织中炎性细胞浸润情况,弹力胶原纤维分布情况等。另留取一部分血管组织作分子生物学检测用。
1.2.7Caspase家族蛋白和基因检测 使用RT-qPCR法和Western blot法从基因和蛋白表达水平上定量检测经过AAT干预处理后血管组织中的Caspase-8、Caspase-3的活性,比较各组间的差异。
1.3统计学分析 采用SPSS20.0软件对所有数据进行统计学处理及分析,各组数据应用方差分析、t检验及秩和检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1不同组别血管组织AAT mRNA表达水平 RT-PCR结果显示AAT mRNA在不同组别中均有表达,AAT在升主动脉瘤患者血管中较正常人血管中表达显著上调(P<0.05),AAT在Stanford A 型主动脉夹层患者中表达水平有所下调(P<0.05),且AAT在三组不同类型血管组织中具有差异性表达。结果见图1所示。
2.2不同组别血管组织AAT 蛋白表达水平 两组独立Western blot结果显示:在三种不同类型人血管组织中均有不同程度的AAT蛋白表达,其中在升主动脉瘤患者血管中AAT表达量最多,在Stanford A 型主动脉夹层中AAT较正常血管中略有下降。结果见图2所示。
2.3三组不同类型人血清AAT含量比较 使用AAT血清测定试剂盒检测不同组别人群血清中AAT含量,结果显示:在升主动脉瘤患者血清中含有大量的AAT,与正常组相比具有显著差异(P<0.05),同时,Stanford A 型主动脉夹层患者血清AAT含量有所下降同样与正常组相比具有显著差异(P<0.05)。结果见表1所示。
2.4AAT 对血管内皮细胞保护作用及机制 使用Western blot检测AAT预孵育后暴露于蛋白酶压力下的原代血管内皮细胞,结果显示:在对照PBS预孵育12 h的组别中,分别使用胰蛋白酶和MMP-2/9均能有效刺激激活Caspase家族蛋白Caspase-3、Caspase-8的表达,其中MMP-2/9的刺激效果优于胰蛋白酶的作用,使用AAT预孵育12 h后原代在MMP-2/9压力的作用下,其组织表达的Caspase家族蛋白Caspase-3、Caspase-8较PBS预孵育组别中显著下调。结果如图3所示。
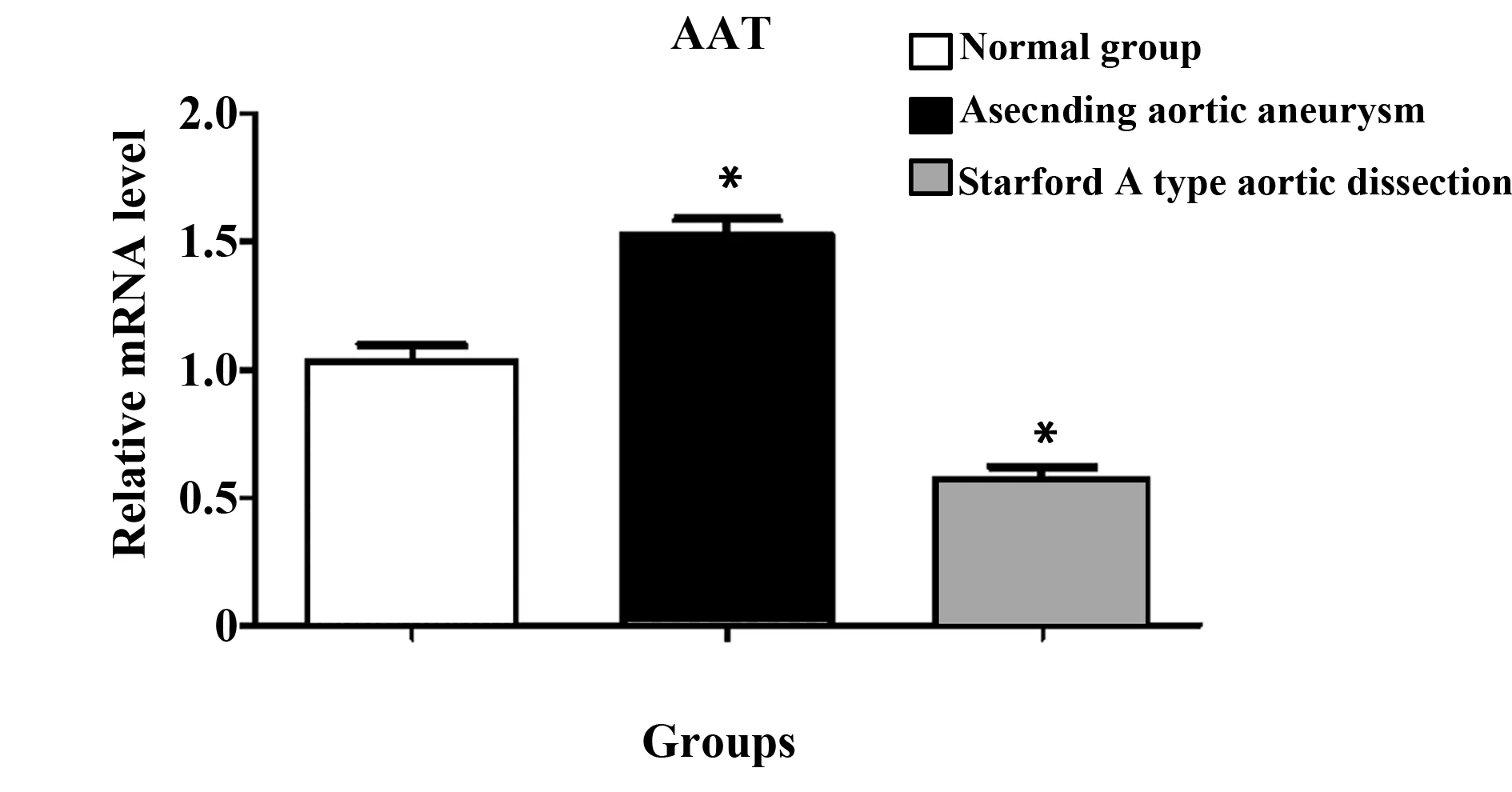
图1 不同组别血管组织AAT mRNA表达水平Fig.1 Expression of AAT mRNA in vascular tissueNote: *.P<0.05.
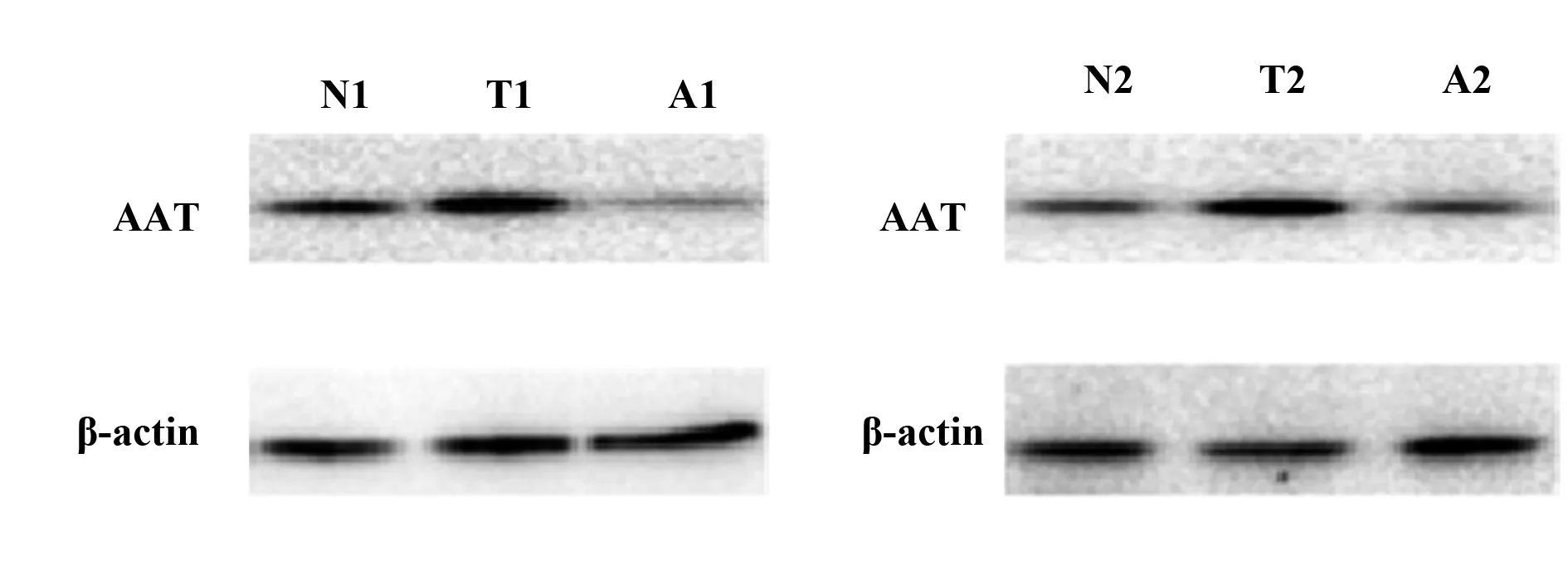
图2 不同组别血管组织AAT 蛋白表达水平Fig.2 Expression level of AAT protein in vascular tissue
2.5动物造模后血管组织Caspase家族mRNA表达水平比较 外界给予AngⅡ和胰蛋白酶后检测动物血管组织Caspase家族蛋白基因表达水平,结果显示:仅使用AngⅡ缓释造模后Caspase-3、Caspase-8 mRNA在AAT治疗组明显低于生理盐水组,AngⅡ缓释外加血管注射胰酶后,生理盐水组Caspase-3、Caspase-8 mRNA显著高于单纯AngⅡ造模组,同时AAT治疗组中Caspase-3、Caspase-8 mRNA显著下降,结果如图4所示。
表1三组不同类型人血清AAT含量比较
Tab.1ComparisonofserumAATcontentofdifferenttypesofpeople

GroupsAAT(mg/L)Normal group1 504.76±320.11Ascending aortic aneurysm2 613.28±434.09Stanford type A983.82±367.84
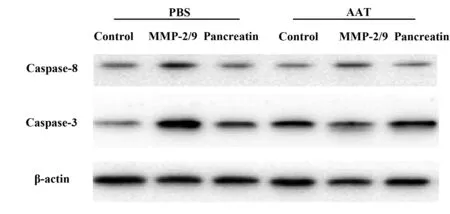
图3 AAT保护MMP-2/9诱导的血管内皮细胞凋亡Fig.3 AAT protects MMP-2/9 induced apoptosis of vascular endothelial cells

图4 动物血管组织Caspase家族mRNA表达水平比较Fig.4 Comparison of mRNA expression level in Caspase family of animal vascular tissue
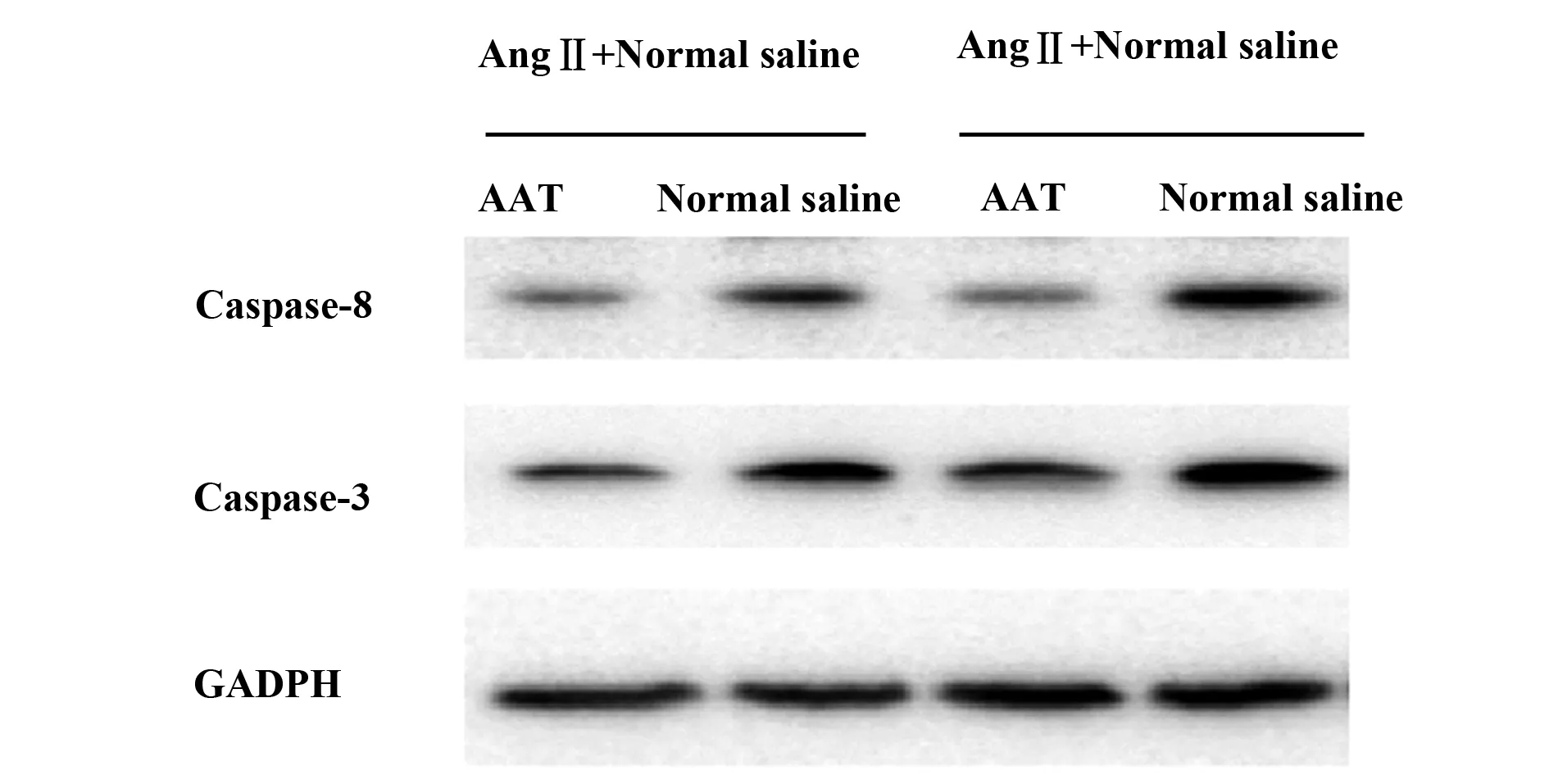
图5 动物血管组织Caspase家族蛋白达水平Fig.5 Level of Caspase family albumen in animal vascular tissue
2.6动物造模后血管组织Caspase家族蛋白表达水平比较 外界在动物皮下缓释AngⅡ和血管注射胰酶能够有效诱导Stanford A 型主动脉夹层模型,结合细胞凋亡在Stanford A 型主动脉夹层中的重要作用,我们研究发现,单纯给予AngⅡ虽能够激活Caspase凋亡家族蛋白Caspase-3、Caspase-8的表达,但是其刺激效果弱于AngⅡ联合胰酶造模,同时给予AAT后,与对照组生理盐水相比AAT在二者模型中均能有效降低Caspase-3、Caspase-8蛋白水平,差异显著。结果见图5所示。
3 讨论
主动脉夹层是心血管外科最为凶险的疾病,死亡率非常高,发病后病情进展迅速,其中A型主动脉夹层发病于升主动脉,累及升主动脉及降主动脉,A型主动脉夹层患者发病后3个月内死亡率可达90%,远超过一般心脑血管疾病[1-3]。但是目前对于主动脉夹层的发病机制研究尚不清楚,患者血管组织炎症细胞浸润及炎症因子的大量释放在血管夹层形成及发展中具有重要的作用。已有研究证明,血管重构导致的血管内膜增厚、细胞外基质退行性病变、弹力纤维的减少以及平滑肌和血管内皮细胞凋亡,都将促进主动脉夹层形成[13]。同样,蛋白酶和蛋白酶抑制剂的平衡在维持血管壁结构稳定,阻止血管壁结构重构方面发挥了不可忽视的作用。
α-1 抗胰蛋白酶(AAT)作为一种最主要的蛋白酶抑制物,其占血清中抑制蛋白酶活力的90%左右,AAT在血清中的含量对于机体具有重要的生理作用。已有文献报道,AAT主要通过抑制Caspase-3活性,可以有效保护肺内皮损伤[10]。我们研究发现AAT在A型主动脉夹层、主动脉瘤患者及正常人体血管中均有不同程度的表达,且在主动脉瘤患者血管组织中表达显著上升,而在A型主动脉夹层患者中其AAT的表达较正常组显著下调,其mRNA及蛋白水平的变化说明AAT在主动脉疾病的发生和发展中扮演着重要角色,同时差异性表达有助于研究AAT在不同类型血管疾病中的作用。通过提取人体血管内皮原代细胞,能够在体外条件下模拟AAT对血管内皮细胞的保护作用,研究发现使用胰酶和MMP-2/9均能有效刺激内皮细胞发生细胞凋亡,且MMP-2/9的刺激效果显著优于胰酶的作用,这一研究成果与Hu等[14]的结果相似。使用AAT预孵育12 h其对于Caspase家族蛋白Caspase-3、Caspase-8的表达起显著的抑制作用,说明AAT能够通过抑制Caspase家族蛋白的激活进而缓解胰酶或MMP-2/9引起的血管内皮细胞凋亡。为了更进一步研究AAT对于主动脉血管的保护作用,我们借鉴以往的实验方案使用皮下缓释AngⅡ和血管内注射胰酶的方法在比格犬中制备主动脉夹层模型[15-17],获得动物模型后静脉注射AAT治疗后我们发现,在体内动物模型中生理盐水对照组同样存在Caspase家族蛋白的激活表达和对应mRNA表达水平的上调,这说明在动脉夹层模型体内同样存在Caspase家族蛋白Caspase-3、Caspase-8的激活,同样在AAT干预治疗组中Caspase-3、Caspase-8的基因和蛋白水平下调,说明AAT能够通过抑制Caspase家族蛋白的激活进而抑制血管内皮细胞的凋亡,最终保护血管组织,阻止其形成动脉夹层。