HOXD10基因抑制结直肠癌细胞生长的机制研究
2019-01-03郗昌磊龚治林周启昌曹龙磊王沛云
郗昌磊 龚治林 周启昌 于 杰 叶 辉 曹龙磊 王沛云
(荆州市中心医院肛肠外科,荆州 434020)
结直肠癌是常见的消化道恶性肿瘤之一,近些年的发病率呈现出上升的趋势,其发生发展是一个多基因、多步骤的复杂过程,涉及抑癌基因、癌基因、信号通路等的变化,研究引起结直肠癌发生的分子机制对于该病的诊疗具有重要意义[1]。HOXD10基因是同源异形盒基因家族中的一员,可通过对肿瘤的增殖、转移、侵袭等机制进行调节而发挥抑癌作用[2]。有研究表明,在乳腺癌、胃癌等多种恶性肿瘤中HOXD10的表达减少,并在上皮来源的肿瘤转移及侵袭中发挥重要作用[3,4]。而过表达HOXD10可降低鼻咽癌细胞的侵袭及迁移能力[5]。HOXD10在结直肠癌中的研究相对较少,有研究显示,结直肠癌中HOXD10的低表达与肿瘤的浸润转移存在密切联系,miR-10b可通过靶向HOXD10促进结直肠癌细胞的侵袭[6,7],过表达HOXD10对结直肠癌细胞增殖凋亡、免疫的影响及机制研究得尚未清楚。本研究通过将过表达HOXD10的质粒转染结直肠癌细胞,旨在研究其对细胞增殖、凋亡、免疫抑制因子VEGF和TGF-β1表达及Notch信号通路的影响。
1 材料与方法
1.1试剂和仪器 DMEM培养基、胎牛血清均购自美国Bibco;LipofectamineTM2000购自美国Invitrogen;pcDNA3.1真核表达载体购自天根生化有限公司;MTT试剂购自日本DOJINDO;Annexin V-FITC/PI细胞凋亡试剂盒购自南京凯基;HOXD10、TGF-β1、VEGF、Notch1、Jagged1和Hes1抗体均购自美国SANTA CRUZ;酶标仪购自上海拜格生物;流式细胞仪购自美国BD。
1.2方法
1.2.1细胞培养及转染 人正常结肠NCM460细胞及结直肠癌HCT116、HT29、CaCO2细胞在含有10%胎牛血清的DMEM培养液中,置于5%体积分数的CO2培养箱中37℃培养。实验选择生长状态良好的细胞。转染前1 d在6孔板的每孔中接种1×106个HT29细胞,细胞达90%汇合时,参照脂质体LipofectamineTM2000转染说明进行转染,随机将细胞分为三组,阳性转染组(pcDNA3.1-HOXD10组)取质粒2 μg质粒加入250 μl的DMEM培养基中,获得A液,取4 μl的LipofectamineTM2000加入250 μl的DMEM培养基中获得B液,室温静置5 min,混匀A液和B液,室温静置20 min,将混合液均匀的滴加在细胞培养基中,轻轻晃动以使混合均匀,阴性对照组(pcDNA3.1组)转染pcDNA3.1空质粒2 μg,操作同pcDNA3.1-HOXD10组,同时设置加入原培养液的为空白对照组,转染后培养48 h,用于后续实验研究。
1.2.2蛋白质印迹(Western blot) 采用RIPA裂解液提取细胞总蛋白,Bradford法对蛋白浓度进行检测,取总蛋白40 μg上样,经12%的SDS-PAGE,电泳后将凝胶取出,转印仪将蛋白转移至PVDF膜,5%脱脂奶粉封闭转好的膜1 h,加入稀释好的HOXD10、TGF-β1、VEGF、Notch1、Jagged1和Hes1抗体(皆为1∶1 000稀释),4℃摇床孵育过夜,洗膜,加入HRP标记的山羊抗兔IgG(1∶2 000稀释),室温孵育1 h,ECL显色,凝胶成像系统进行结果观察。以GAPDH作为内参,实验重复3次。
1.2.3MTT法检测细胞活力 接种生长至对数期的HT29细胞(5×104个/ml)于96孔板,每孔中加入100 μl,常规培养过夜,按照1.2.1分组及方法转染,每组设置5个重复孔,收集转染48 h的细胞,每孔加20 μl的MTT溶液(5 mg/ml),培养箱中37℃培养4 h停止培养,将培养液弃去,加入150 μl的DMSO溶液在每个细胞孔中,振荡10 min,酶标仪检测各孔吸光度值(OD值,570 nm)。实验重复3次。
1.2.4Annexin V-FITC/PI双染法检测细胞凋亡 收集转染48 h的细胞,PBS洗涤细胞,收集(1~5)×105个细胞,500 μl的Binding缓冲液悬浮细胞,加入FITC标记的Annexin V 5 μl,充分混匀后加入PI 5 μl,混匀后避光条件室温反应5~15 min,流式细胞仪检测细胞凋亡率。实验重复3次。
2 结果
2.1结直肠癌细胞HOXD10的表达 HOXD10在结直肠癌细胞的蛋白表达如图1所示,结直肠癌HCT116、HT29、CaCO2细胞中HOXD10的表达均显著低于在NCM460细胞表达(P<0.05)。
2.2转染效果 pcDNA3.1-HOXD10转染HT29细胞48 h,Western blot检测各组细胞HOXD10的蛋白表达,结果如图2所示,转染 pcDNA3.1-HOXD10的HT29细胞HOXD10表达显著高于空白对照组(P<0.05),而pcDNA3.1组和空白对照组间差异无统计学意义(P>0.05)。
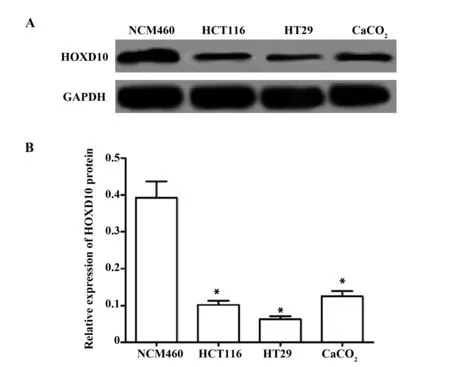
图1 HOXD10在结直肠癌细胞的蛋白表达Fig.1 Protein expression of HOXD10 in colorectal cancer cellsNote: A.HOXD10 protein expression electrophoresis map;B.HOXD10 protein relative expression quantity;compared with NCM460 cell,*.P<0.05.
2.3过表达HOXD10抑制HT29细胞活力 各组细胞活力检测结果如图3所示,与pcDNA3.1组比较,pcDNA3.1-HOXD10组细胞活力显著降低(P<0.05)。
2.4过表达HOXD10诱导HT29细胞凋亡 各组细胞凋亡率检测结果如图4所示,与pcDNA3.1组比较,pcDNA3.1-HOXD10组细胞凋亡率显著升高(P<0.05)。
2.5过表达HOXD10下调HT29细胞免疫抑制因子VEGF和TGF-β1表达 各组细胞中免疫抑制因子VEGF和TGF-β1的蛋白表达结果如图5所示,与pcDNA3.1组比较,pcDNA3.1-HOXD10组VEGF和TGF-β1的蛋白表达均显著降低(P<0.05)。
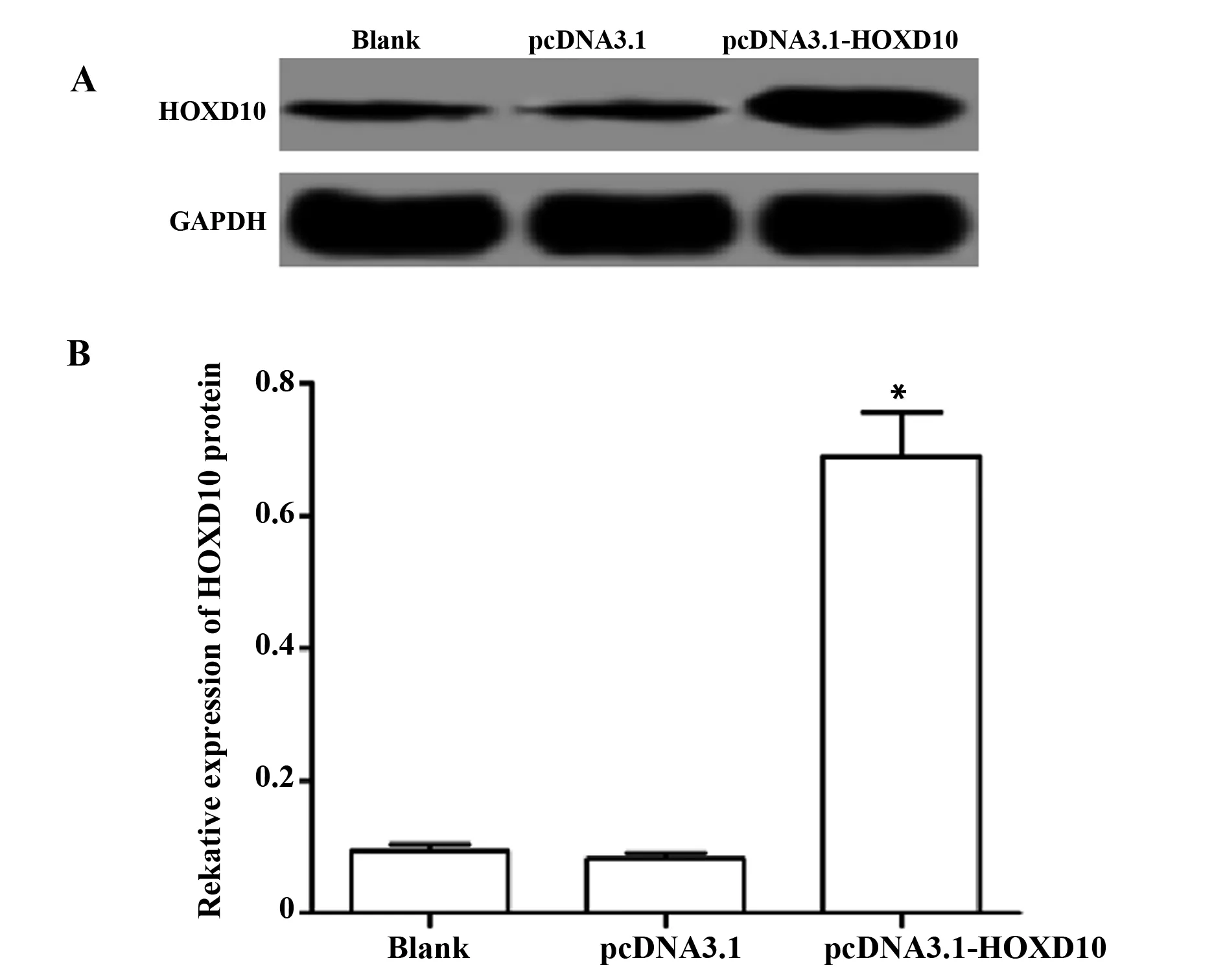
图2 pcDNA3.1-HOXD10转染HT29细胞的效果Fig.2 Effect of pcDNA3.1-HOXD10 transfection on HT29 cellsNote: A.HOXD10 protein expression electrophoresis map;B.HOXD10 protein relative expression quantity;compared with blank control group,*.P<0.05.
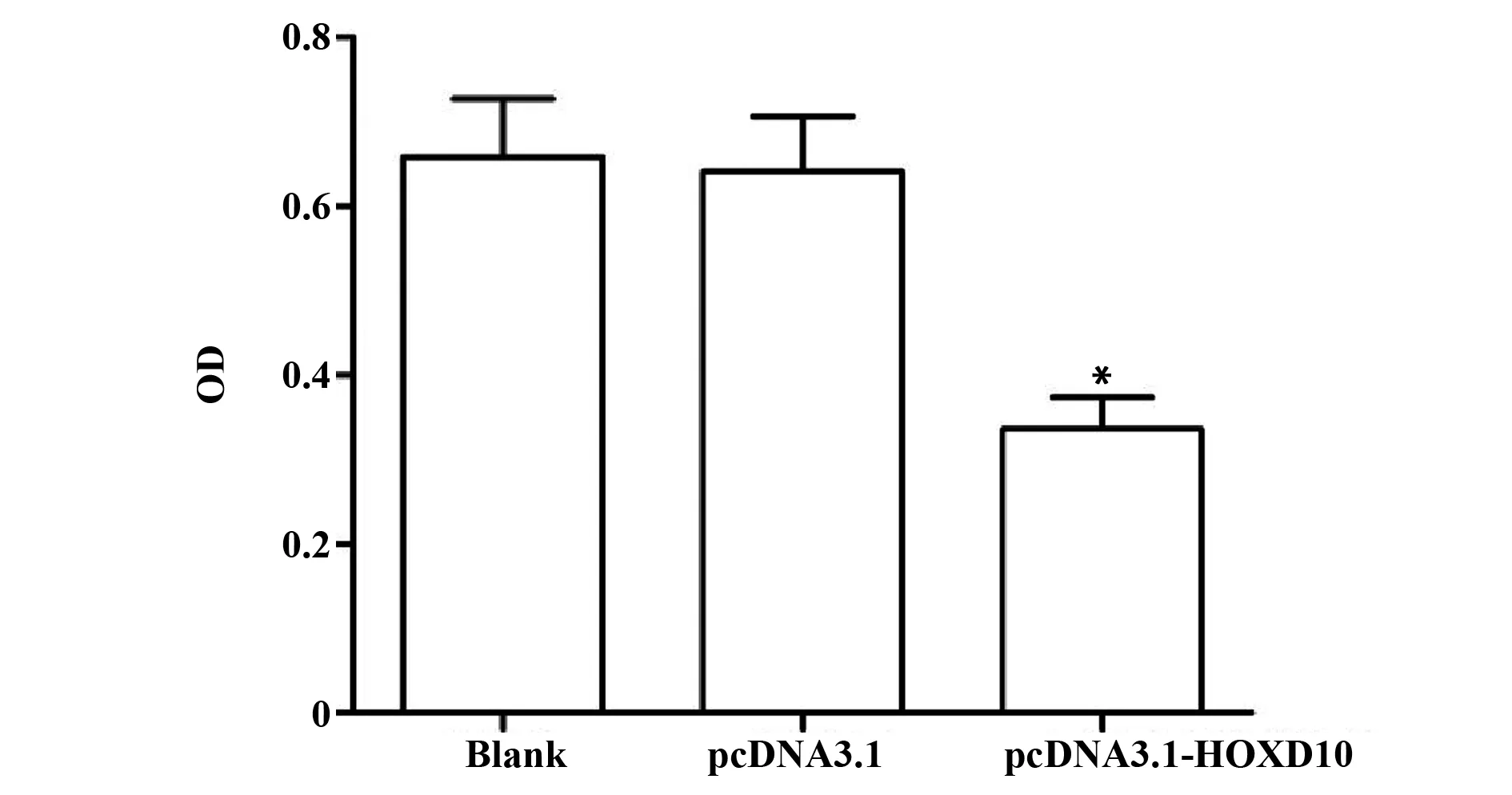
图3 过表达HOXD10对HT29细胞活力的影响Fig.3 Effect of overexpression of HOXD10 on activity of HT29 cellsNote: Compared with the pcDNA3.1 group,*.P<0.05.
2.6过表达HOXD10下调HT29细胞Notch信号通路 Western blot检测各组细胞Notch信号通路受体Notch1、配体Jagged1及下游靶基因Hes1的蛋白表达,结果如图6所示,与pcDNA3.1组比较,pcDNA3.1-HOXD10组Notch1、Jagged1和Hes1的蛋白表达均显著降低(P<0.05)。
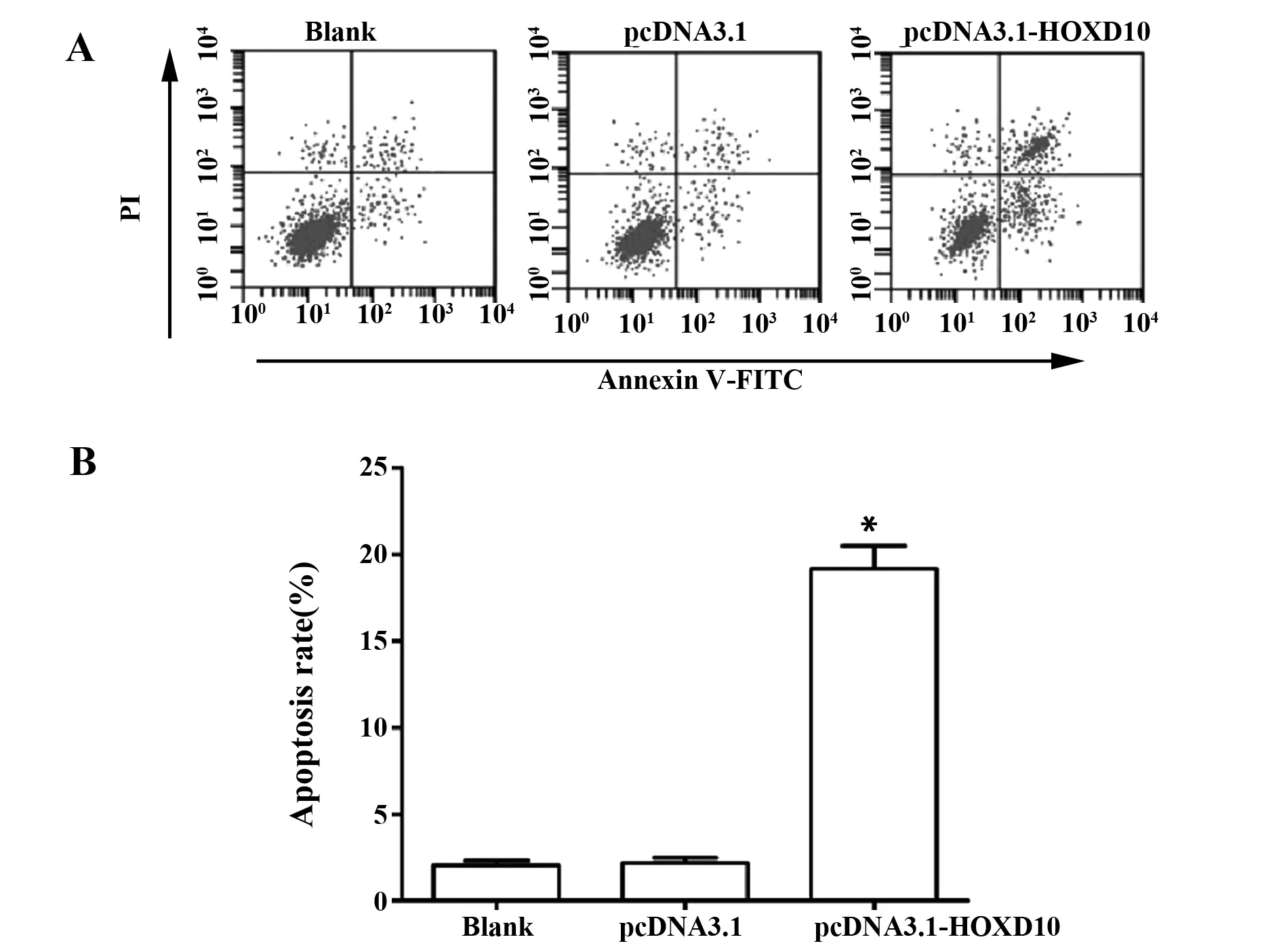
图4 过表达HOXD10对HT29细胞凋亡的影响Fig.4 Effect of overexpression of HOXD10 on apoptosis of HT29 cellsNote: A.Flow cytometry results;B.Apoptosis rate of each group;compared with pcDNA3.1 group,*.P<0.05.
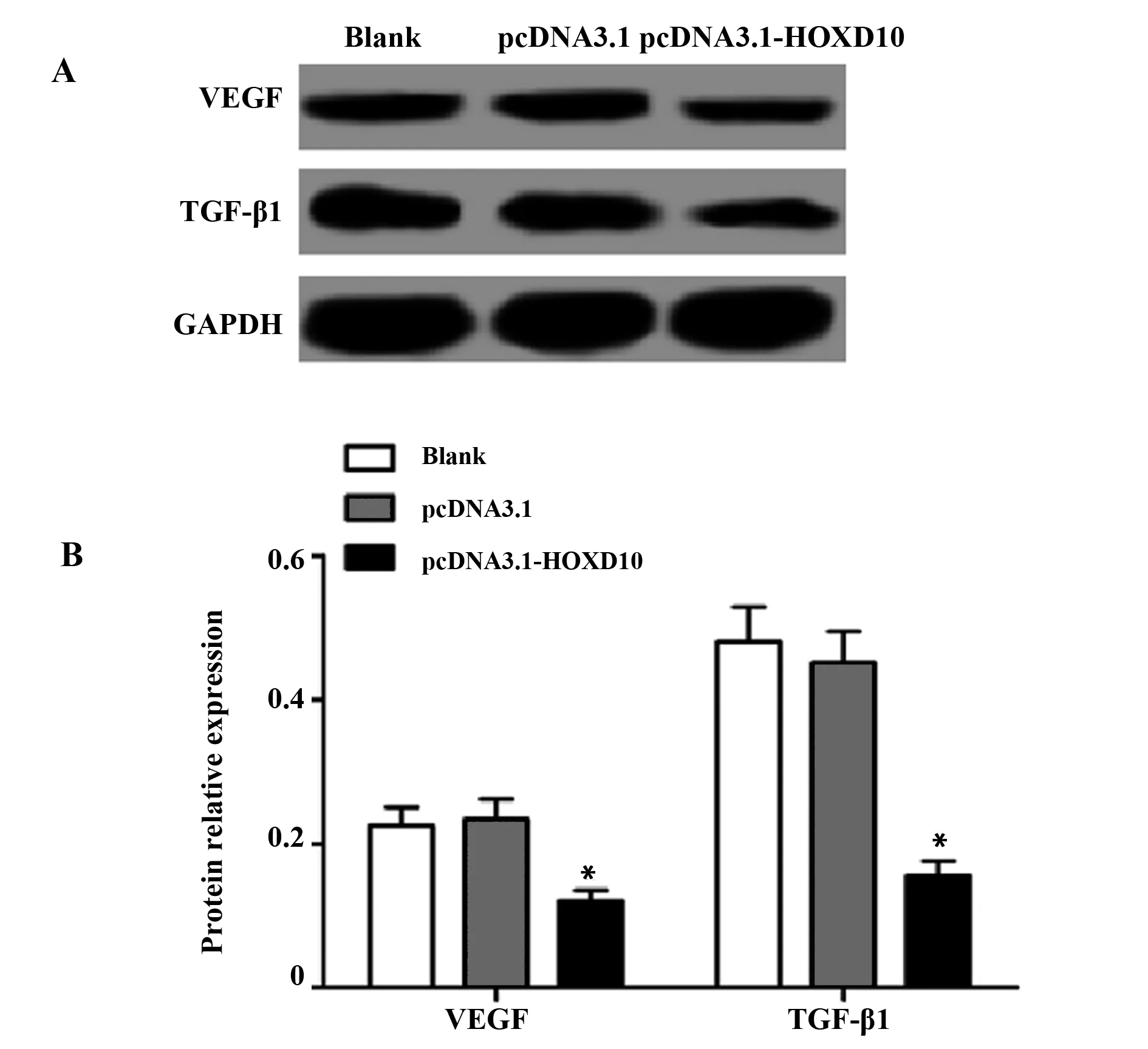
图5 过表达HOXD10对HT29细胞免疫抑制因子VEGF和TGF-β1表达的影响Fig.5 Effect of over expression of HOXD10 on expression of VEGF and TGF-β1 in HT29 cellsNote: A.The expression of VEGF and TGF-β1 protein electrophoresis;B.The relative expression of VEGF and TGF-β 1;compared with pcDNA3.1 group,*.P<0.05.
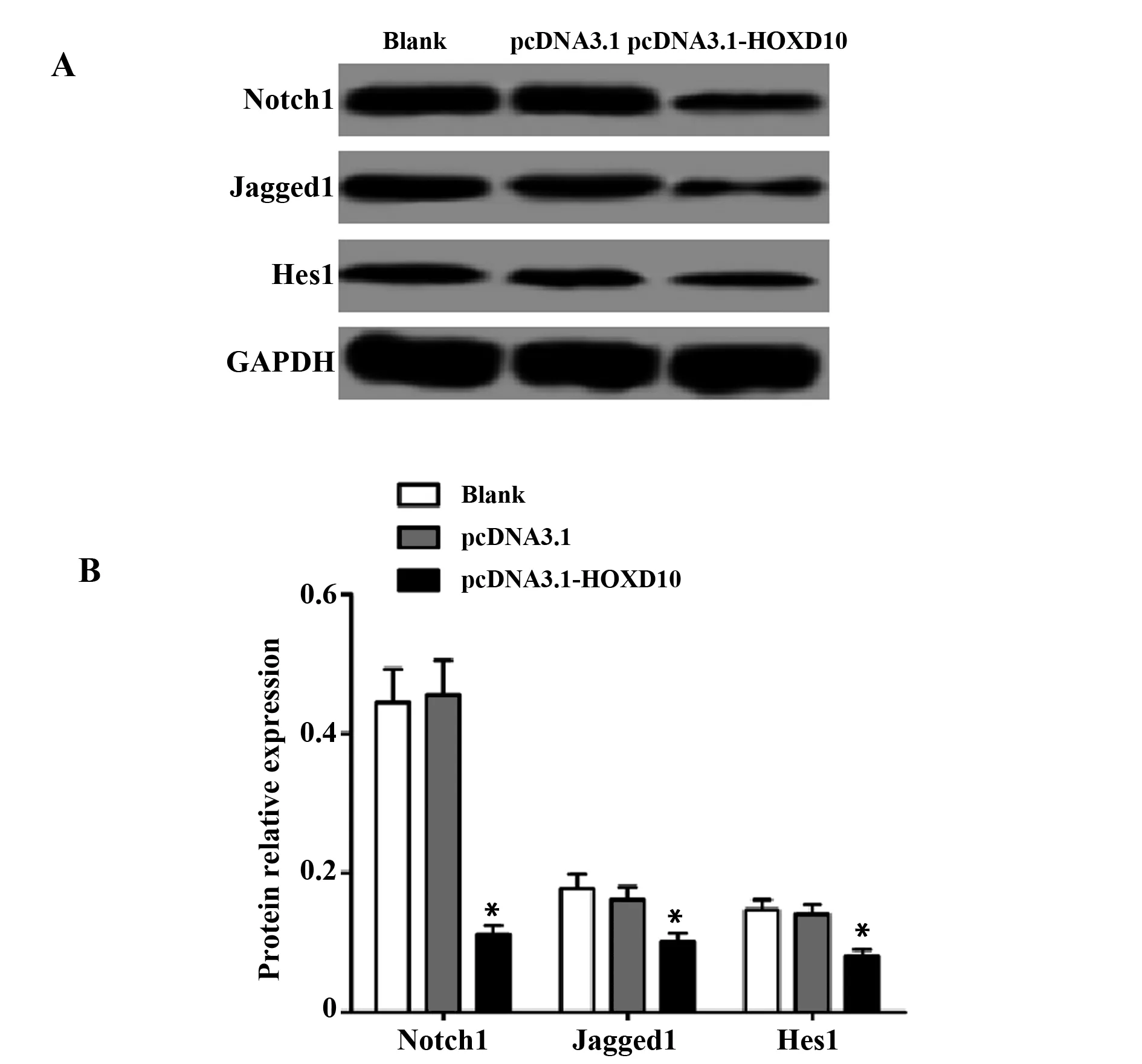
图6 过表达HOXD10对HT29细胞Notch信号通路的影响Fig.6 Effect of overexpression of HOXD10 on Notch signaling pathway in HT29 cellsNote: A.Protein expression electrophoresis map;B.Relative expression of protein;compared with pcDNA3.1 group,*.P<0.05.
3 讨论
结直肠癌的发生发展与其相关的抑癌基因、原癌基因、信号转导通路等密切相关,目前已发现多个可用于诊疗结直肠癌的分子靶点,但仍需寻找更多有效的靶点。HOX基因分为HOXⅠ类和HOX Ⅱ类基因,其中人的HOX基因家族属于HOXⅠ类基因,有HOXA/B/C/D四个簇,近些年的研究发现HOX基因影响多种实体肿瘤的发生及发展[8,9]。HOXD10是HOX基因家族中的一个成员,在肿瘤中的研究相对较少。有研究表明,肿瘤中HOXD10表达缺失或降低,可能发挥抑癌作用[10,11]。如胃癌中HOXD10表达降低,过表达HOXD10可抑制细胞的增殖和侵袭、克隆形成、阻滞细胞周期及诱导细胞凋亡[12];miR-224通过靶向HOXD10调控下游相关分子而影响肝癌细胞的迁移及侵袭能力[13]。结直肠癌中HOXD10的研究相对较少,有研究发现结直肠癌中HOXD10的低表达与肿瘤的浸润转移存在密切联系,miR-10b可通过靶向HOXD10促进结直肠癌细胞的侵袭[6,7],过表达HOXD10对结直肠癌细胞生物学特性的影响及机制研究的尚未清楚。
本研究中首先检测不同结直肠癌细胞中HOXD10的表达,发现在HT29细胞中HOXD10的表达最低,因此选择作为研究对象。通过将过表达HOXD10的质粒转染HT29细胞,发现HOXD10的表达明显升高,说明过表达HOXD10的HT29细胞建立成功,且发现过表达HOXD10可明显抑制HT29细胞活力和诱导细胞凋亡。这提示过表达HOXD10可影响结直肠癌的发生发展。Notch信号通路是一种重要的信号转导通路,不仅影响细胞正常发育、增殖分化和凋亡,且影响多种肿瘤的发生发展,由Notch受体、配体及核内结合蛋白和靶基因组成,在多种肿瘤中Notch信号通路处于激活状态,如结直肠癌、乳腺癌等,而抑制Notch信号通路可降低肿瘤的发生发展[13-15]。TGF-β是一组多能效生长抑制因子,具有非常广泛的生物学活性,参与组织发育、免疫反应等过程,发挥免疫抑制作用,可介导结直肠癌的免疫逃逸[16,17]。有研究显示,抑制Notch信号通路可逆转TGF-β1诱导的肺癌的EMT转变[18],血管内皮细胞生长因子(VEGF)是调控肿瘤血管生成的一个重要因素,多种肿瘤中呈现高表达,抑制其表达可降低乳腺癌、结直肠癌等肿瘤的增殖和诱导凋亡[19,20]。在研究肾母细胞瘤中发现,细胞加入Notch信号通路抑制剂可抑制Notch信号通路及明显降低VEGF的表达[21]。本研究结果显示,过表达HOXD10可明显降低TGF-β1、VEGF和Notch信号通路受体Notch1、配体Jagged1及下游靶基因Hes1的蛋白表达,这提示过表达HOXD10可能通过下调Notch信号通路影响结直肠癌的发生发展。
综上所述,上调结直肠癌细胞HOXD10基因表达可抑制癌细胞活力,诱导细胞凋亡,下调免疫抑制因子VEGF和TGF-β1表达,机制可能与下调Notch信号通路有关。本研究可能为结直肠癌的分子靶向治疗提供了一定的理论基础,但本研究检测的内容有限,值得进一步深入在体内及体外进一步研究。