迷迭香酸通过调控PI3K通路诱导急性T细胞白血病Jurkat细胞自噬和细胞凋亡①
2019-01-03郑晓强董金凤芮红兵
郑晓强 董金凤 芮红兵
(福建医科大学附属第一医院血液风湿科,福州 350005)
急性T细胞白血病是由感染人T细胞白血病病毒所致的一类恶性T细胞肿瘤[1]。研究表明,急性T细胞白血病是急性白血病常见的类型之一,其发病率约占儿童急性白血病发病率的15%和成年人急性白血病的25%[2]。目前对于急性T细胞白血病的治疗主要以放化疗为主,虽然治愈率较高,但预后复发率高达30%[3]。并且T细胞白血病细胞还具有较强侵袭性,可转移至骨髓及骨髓外的组织和器官,导致患者预后较差[4]。因此,寻找治疗急性T细胞白血病的新药物成为了目前研究的热点之一。迷迭香酸 (Rosmarinic acid,RA)是一类水溶性的天然酚酸类化合物,主要从唇形科植物迷迭香中分离得到,并广泛存在于紫草科、葫芦科等植物中[5]。研究表明,RA具有广泛的抗氧化、抗炎、抗病毒及抗癌活性[6]。Wu等[7]研究表明,RA能诱导急性白血病CEM/ADR5000细胞凋亡和坏死,但具体的作用机制还不清楚[7]。本研究以急性T细胞白血病细胞系Jurkat为研究对象,以探究RA对急性T细胞白血病的作用机制。
1 材料与方法
1.1材料 RPMI1640细胞培养液和胎牛血清购自美国Gibco公司,Annexin V细胞凋亡试剂盒购自美国Thermofisher公司,CCK8试剂盒、BCA试剂盒和RIPA裂解液购自北京索莱宝生物科技公司,Beclin1、P62、LC3、PI3K和Akt一抗购自美国Millipore公司。人急性T细胞白血病细胞株购自美国ATCC公司。
1.2方法
1.2.1细胞培养及分组 用含有10%胎牛血清的RPMI1640培养液培养Jurkat细胞,培养条件为37℃、5%CO2,隔天换液,每隔2 d传代一次。将Jurkat细胞随机分为Jurkat组、RA (5 μmol/L) 组、RA (10 μmol/L) 组RA (20 μmol/L) 组,分别用0、5、10和20 μmol/L的RA处理细胞,24 h后进行检测。
1.2.2CCK8检测细胞活性 将Jurkat细胞接种于96孔板中,接种密度为1×104个/ml。将细胞随机分为Jurkat组、RA(5 μmol/L)组、RA(10 μmol/L)组RA(20 μmol/L)组,用相应浓度的RA分别处理0、1、2、3和4 d,每孔分别加入10 μl的CCK8试剂,继续培养2 h检测各组细胞活性,计算细胞增殖倍数 (细胞增殖倍数=细胞活性/0 h时细胞活性)。
1.2.3流式细胞术检测细胞凋亡 将Jurkat细胞用不同浓度的RA处理24 h后,用0.25%的胰蛋白酶收集各组细胞,并将细胞浓度调整至1×106个/ml,用70%的酒精对细胞进行固定后,分别加入 1 μg/ml 的FITC-Annexin和PI染色液室温避光孵育15 min,用流式细胞仪检测各组细胞凋亡情况。
1.2.4克隆形成实验检测细胞存活 将Jurkat细胞以100个/ml的浓度接种于培养皿中,并分别加入含有0、5、10和20 μmol/L RA的培养液培养细胞2~3周,并经常观察细胞,当培养皿中出现肉眼可见的克隆时,终止培养。随后弃去培养液,用PBS清洗3次后,加入4%多聚甲醛室温固定细胞30 min,并加入适量的GIMSA染色液室温染色细胞15 min,15 min后洗去染色液,干燥后于可见光下观察细胞克隆数目,计算克隆形成率 (克隆形成率=克隆数/接种细胞数×100%)。
1.2.5Western blot检测蛋白表达 用RIPA裂解液提取各组细胞蛋白,并用BCA试剂盒检测细胞蛋白浓度。每组分别取30 μg的蛋白质用10% SDS-PAGE分离蛋白,用半干法将蛋白质转移到PVDF膜,用5%的脱脂奶粉室温封闭PVDF膜2 h,随后加入适宜浓度的一抗于4℃封闭过夜。第二天用缓冲液洗去未结合一抗,加入二抗室温封闭1 h后,滴加显色液用凝胶成像系统进行曝光显影,用Image J对蛋白质条带进行定量分析。
1.2.6免疫荧光检测LC3表达 将Jurkat细胞用不同浓度的RA处理后,滴加4%多聚甲醛固定细胞30 min。固定完成后用0.5%的TritonX-100对细胞膜进行通透,用缓冲液洗去TritonX-100后滴加5%的封闭用正常山羊血清室温封闭细胞2 h,随后以1∶200的浓度加入LC3一抗,并于4℃孵育过夜,第二天弃去一抗,加入FITC标记的二抗,室温封闭1 h后,用缓冲液洗去残余二抗,用含有DAPI染色液的封片液进行封片,于荧光显微镜下观察细胞染色情况。
2 结果
2.1RA对Jurkat细胞增殖的影响 RA处理细胞24 h后,与Jurkat组比较,RA (5 μmol/L) 组、RA (10 μmol/L) 组和RA (20 μmol/L) 组细胞增殖倍数明显降低 (P<0.01,图1),差异具有统计学意义。同时,RA (5、10、20 μmol/L) 还能显著减少每组细胞的克隆数(P<0.01,图2),并具有剂量依赖性。
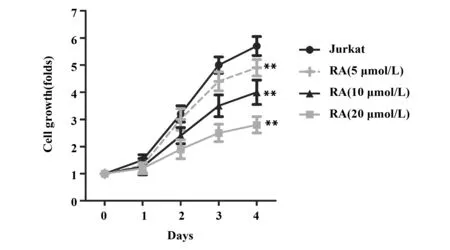
图1 RA对Jurkat细胞活性的影响Fig.1 Effect of RA on cell viability of JurkatNote: Cell viability was measured by CCK8 assay.n=6,**.P<0.01 vs Jurkat group.
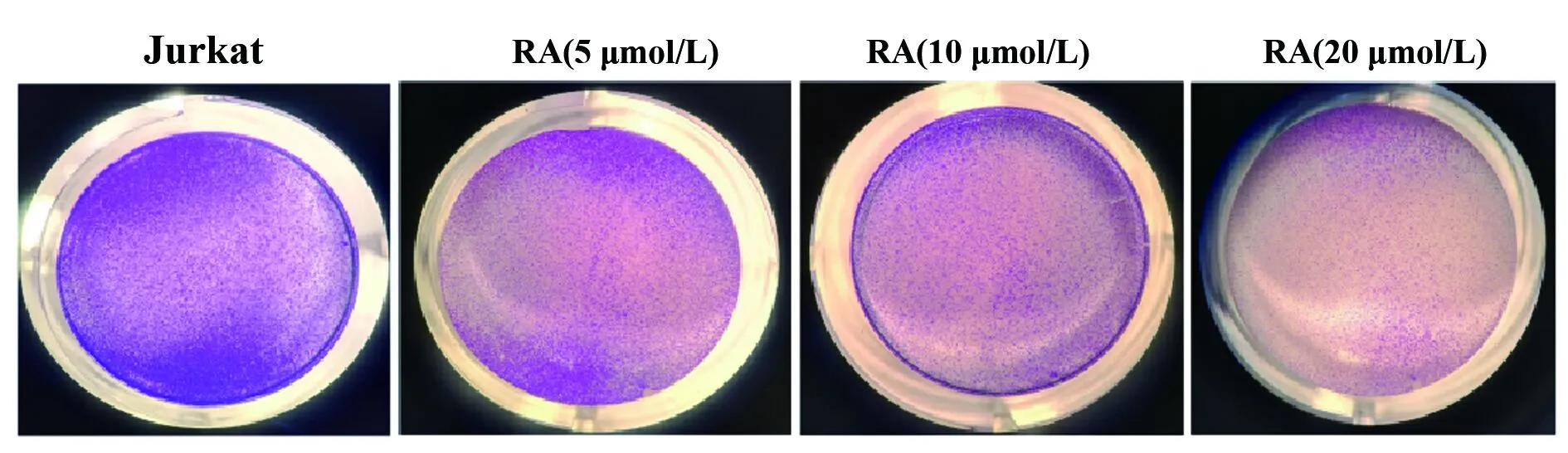
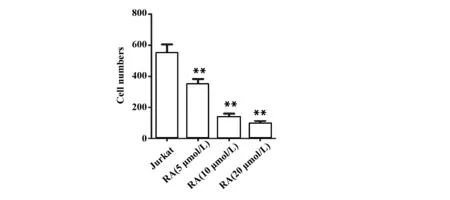
图2RA对Jurkat细胞增殖形成的影响
Fig.2EffectofRAoncellproliferationofJurkatcells
Note: Cell proliferation was determined by colon formation assay.n=6,**.P<0.01 vs Jurkat group.
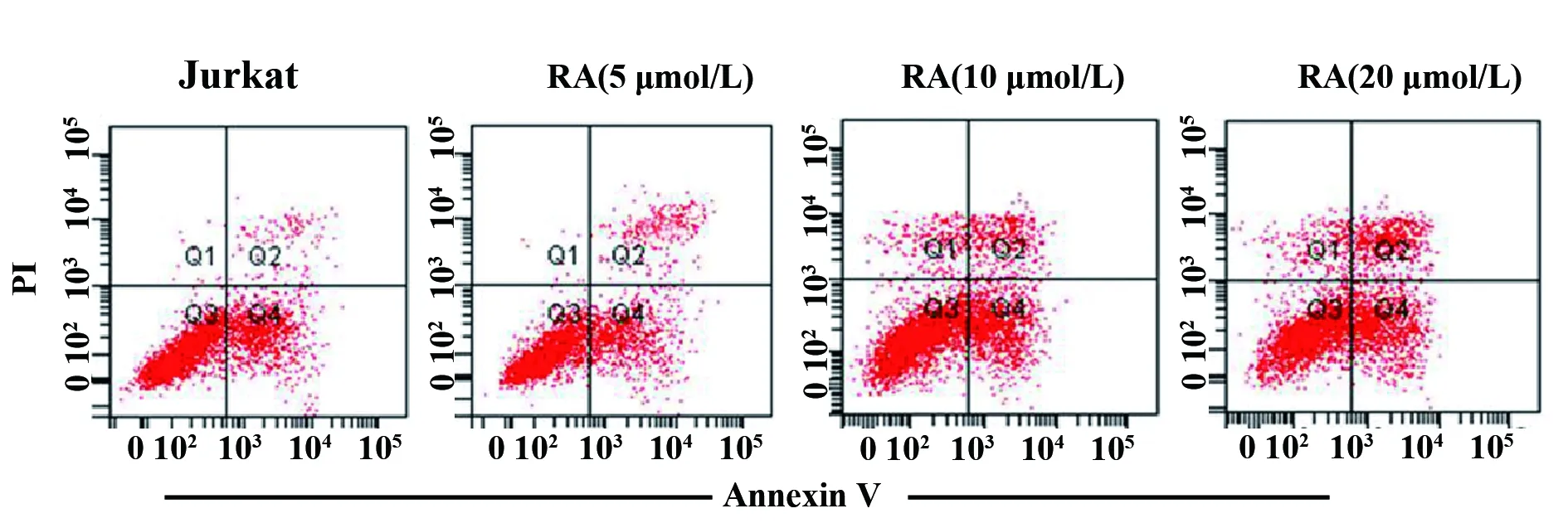
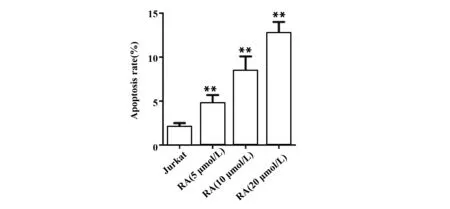
图3RA对Jurkat细胞凋亡的影响
Fig.3EffectofRAoncellapoptosisofJurkatcells
Note: Cell apoptosis was determined by flow cytometry.n=6,**.P<0.01 vs Jurkat group.
2.2RA对Jurkat细胞凋亡的影响 与Jurkat组比较, RA (5 μmol/L) 组、 RA (10 μmol/L) 组和RA(20 μmol/L) 组细胞凋亡率显著升高 (P<0.01,图3),表明RA能诱导T细胞白血病细胞系Jurkat细胞凋亡。
2.3RA对Jurkat细胞自噬的影响 如图4所示,与Jurkat组比较,RA(5 μmol/L) 组、RA(10 μmol/L) 组和RA(20 μmol/L)组细胞LCⅡ/LCⅠ的比值和Beclin1的表达水平明显升高(P<0.05,P<0.01,图4),RA(5、10、20 μmol/L)能显著抑制Jurkat细胞P62的表达(P<0.01,图4),表明RA能诱导Jurkat细胞自噬。此外,RA(5、10、20 μmol/L)还能显著促进LC3在Jurkat细胞中的表达(P<0.05,P<0.01,图5),进一步表明RA能促进Jurkat细胞自噬的发生。
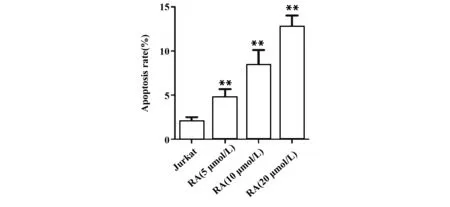
图4RA对Jurkat细胞LC3、Beclin1和P62蛋白表达的影响
Fig.4EffectsofRAonexpressionsofLC3,Belcin1andP62
Note: The protein levels was determined by Western blot.GAPDH was used as loading control.n=6,**.P<0.01 vs Jurkat group.
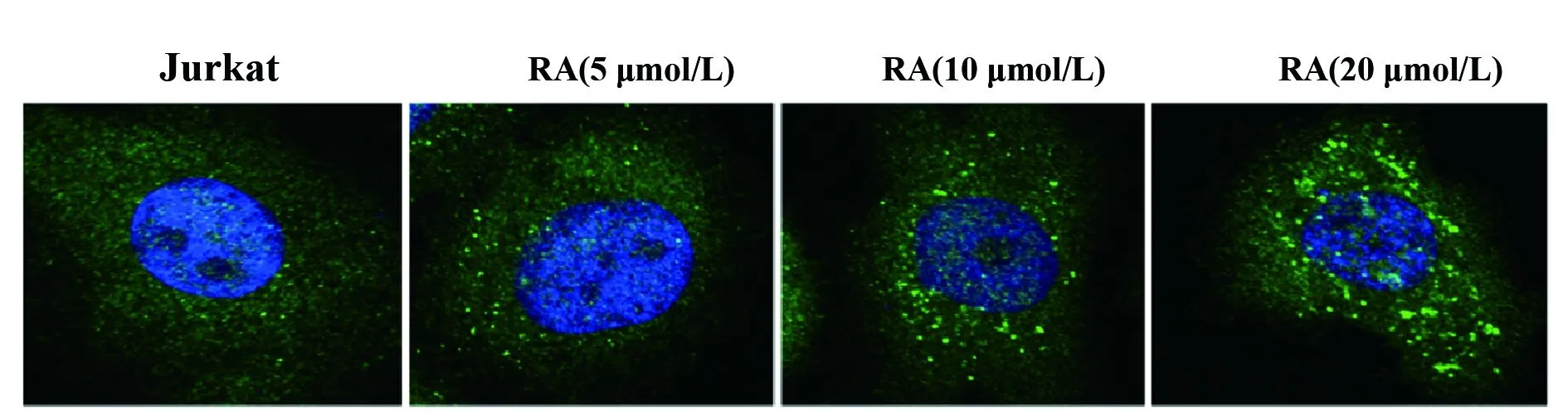
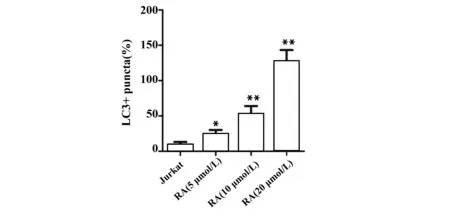
图5RA对Jurkat细胞LC3蛋白表达的影响
Fig.5EffectofRAonexpressionofLC3inJurkatcells
Note: The expression of LC3 was measured by immunofluorescence.n=6,*.P<0.05,**.P<0.01 vs Jurkat group.
2.4RA对PI3K/Akt信号通路的影响 Western blot实验结果表明,RA (5、10、20 μmol/L) 能抑制p-PI3K和p-Akt的表达,显著降低Jurkat细胞p-PI3K/PI3K和p-Akt/Akt的比值及 mTOR 的表达水平(P<0.05,P<0.01,图6),表明RA能抑制PI3K/Akt信号通路的激活。
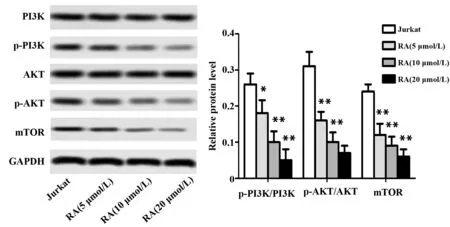
图6 RA对p-PI3K、PI3K、p-Akt、Akt和mTOR表达的影响Fig.6 Effects of RA on expressions of p-PI3K,PI3K,p-Akt,Akt and mTORNote: The levels of p-PI3K,PI3K,p-Akt,Akt and mTOR were measured by Western blot.GAPDH was used as loading control.n=6,*.P<0.05,**.P<0.01 vs Jurkat group.
3 讨论
现代研究表明,天然产物在抵抗癌症的发展和治疗方面有较大的优势,如槲皮素、甘草素及茶多酚等[8]。RA是一类提取于迷迭香、薄荷和紫苏果等植物中的天然化合物,大量研究表明RA具有广谱的抗癌活性,能通过抑制肝癌、胃癌及结肠癌等癌细胞增殖,从而抑制癌症的发展[5,9,10],也能抑制急性淋巴细胞白血病细胞凋亡,增强全反式维甲酸对白血病NB4细胞生长的抑制作用[7,11]。本文研究发现,RA能降低T细胞白血病Jurkat细胞增殖倍数,并具有时间和剂量依赖性。同时,RA还能抑制Jurkat克隆的形成,表明RA具有抑制急性T细胞白血病Jurkat细胞增殖的活性。此外,RA升高Jurkat细胞的凋亡率,并随浓度升高作用逐渐增强。细胞凋亡是指细胞程序性死亡,细胞凋亡的抑制与癌症的发生发展密切相关。实验结果表明RA可能通过抑制Jurkat细胞增殖、诱导细胞凋亡而减缓急性T细胞白血病的发生发展。
RA的抗癌作用涉及多个细胞和分子生物过程。RA可通过激活AMPK抑制结肠癌细胞发生上皮间质转化,从而抑制结肠癌的转移[12]。Wu等[13]研究发现RA还能通过调控Nrf2相关信号通路的激活影响乳腺癌HepG-2细胞的存活。自噬也是调控癌细胞存活的重要机制之一。研究表明,自噬在各种应激条件下能通过为细胞提供营养支撑,因此被认为是促进细胞存活的机制之一[14]。但也有研究表明,细胞自噬是细胞另一种程序性死亡的过程,自噬的激活可导致细胞的死亡[15,16]。癌症自噬抑制进一步表明细胞自噬是一类肿瘤抑制途径。PI3K、mTOR及Bcl-2等致癌基因能抑制癌细胞自噬的发生,P53、PTEN及TSC1/TSC2等抑癌基因的激活能诱导癌细胞自噬[17]。本文研究结果表明,RA能促进Beclin1和LC3表达,抑制P62表达并能升高LC3Ⅱ/LC3Ⅰ的比值。Beclin1、P62和LC3均是细胞自噬的标志性蛋白。Beclin1能通过促进Beclin1-hVps34复合物的形成促进癌细胞自噬和抑制癌细胞增殖[2]。LC3则与自噬小体的形成有关,被认为是自噬小体形成的特异性标志[18]。P62与溶酶体降解有关,与自噬程度呈负相关,提示RA能诱导Jurkat细胞自噬。
PI3K/Akt信号通路是调控细胞增殖、凋亡和自噬的重要信号通路。研究表明PI3K信号通路在急性T细胞白血病细胞中呈激活状态,被认为是治疗急性T细胞白血病的作用靶标之一,抑制PI3K活性能诱导T细胞白血病细胞的凋亡[19]。Akt是PI3K的下游靶标,PI3K激活可促进Akt活化,从而调控细胞生物学过程。Simioni等[20]研究表明,PI3K/Akt通路能参与T细胞白血病细胞增殖、凋亡自噬等过程的调控,用抑制剂抑制Akt活性后,T细胞白血病细胞的活性明显降低,细胞出现G0/G1期周期阻滞,并且还能诱导细胞凋亡和细胞自噬。本文研究发现RA还能抑制p-PI3K和p-Akt的表达,显著降低p-PI3K/PI3K和p-Akt/Akt的比值,表明RA能抑制Jurkat细胞PI3K/Akt信号通路激活,提示RA抑制Jurkat细胞增殖,诱导细胞凋亡和自噬的作用可能与抑制PI3K/Akt信号通路激活有关。
综上所述,RA能显著降低急性T细胞白血病Jurkat细胞增殖倍数,抑制细胞克隆形成,并能升高细胞凋亡率、促自噬标记蛋白Beclin1、LC3的表达,降低P62的蛋白表达水平,同时还能显著降低PI3K/PI3K和p-Akt/Akt的比值,提示RA能诱导急性T细胞白血病Jurkat细胞自噬和细胞凋亡,作用机制可能与抑制PI3K/Akt信号通路激活有关。本研究初步探究了RA对T细胞白血病Jurkat细胞增殖、凋亡及自噬的作用与机制,为RA应用于急性T细胞白血病的治疗提供了实验数据支撑。